饲料中添加芽孢杆菌组分对凡纳滨对虾幼虾生长、能量代谢和抗WSSV能力的影响*
单洪伟, 于 鹏, 刘 宽, 于明超,马 甡
(1.海水养殖教育部重点实验室(中国海洋大学),山东 青岛 266003; 2.通威股份有限公司,四川 成都 610041)
益生菌可以促进虾的生长、影响其消化酶活力、增强其免疫应答水平、提高其对病原菌的抵抗能力等,被广泛应用于对虾养殖中[1-2]。目前,凡纳滨对虾(Litopenaeusvannamei)养殖常用的益生菌种类包括光合细菌、酵母菌(Saccharomycessp.)、乳酸菌(Lactobacillussp.)及芽孢杆菌(Bacillussp.)等。其中,由于芽孢杆菌在养殖环境中分布广泛,致病性较低,已经在凡纳滨对虾养殖中广泛应用并取得了很好的效果。饲料添加是益生菌主要应用方式之一,除了直接在饲料中添加菌体外,细菌源活性物质,如肽聚糖、脂多糖、葡聚糖等可以作为免疫增强剂添加到饲料中以提高水产动物的抗病力[3-4]。
生物机体的能量代谢与各种生理功能密切相关,其在机体生长、繁育以及细胞稳态维持系统之间的分配存在一种利于自我生存的调控平衡态,一旦失衡就会引发组织功能紊乱,影响到机体整体的活力以及健康水平[5-6]。已有研究表明,凡纳滨对虾在感染白斑综合征病毒(White Spot Syndrome Virus,WSSV)后,能量代谢过程遭到破坏,机体能量代谢速率变缓,并会引发Warburg 效应,使体内乳酸含量增加,最终导致死亡[7-8]。因此,凡纳滨对虾的能量代谢与其抗病能力密切相关。但是目前,基于能量代谢角度探讨益生菌相关作用机制的研究较少。
该实验以前期筛选得到的一株芽孢杆菌为实验材料,粗提取其胞外蛋白和胞内多糖组分后与配合饲料混合并饲喂凡纳滨对虾,探究芽孢杆菌2种粗提物对凡纳滨对虾生长、能量代谢水平、消化酶活力及抗WSSV能力的影响。本研究一方面为芽孢杆菌功能组分在对虾养殖中的应用提供基础资料,另一方面尝试从能量代谢的角度阐明芽孢杆菌的益生机制。
1 材料与方法
1.1 实验材料和条件
1.1.1 实验菌株及组分提取 以本实验室筛选出的芽孢杆菌BZ5株为实验菌株。该菌株筛选自浙江舟山凡纳滨对虾养殖池塘,经16SrRNA基因序列鉴定及系统发生树构建结果显示,该菌株与巨大芽孢杆菌(B.megaterium)亲缘关系最近,前期研究结果表明其能够提高对虾抗WSSV能力[9]。
芽孢杆菌BZ5株胞外蛋白粗提物的提取采用硫酸铵沉淀法[10]。主要操作如下:将芽孢杆菌发酵液离心(4 ℃, 10 000 r/min, 10 min)后,在上清液中加入硫酸铵至80%饱和。静置24 h后再次离心(4 ℃, 10 000 r/min, 20 min),并收集沉淀。沉淀用一定量的PBS溶解后,用蒸馏水进行透析。透析液冻干后,即得到芽孢杆菌胞外蛋白粗提物。
芽孢杆菌BZ5株胞内多糖粗提物的提取采用水提醇沉法[11]。用超声波破碎芽孢杆菌菌体后,在破碎菌液中加入10倍体积蒸馏水,95 ℃恒温水煮2 h,然后收集离心(4 000 r/min, 10 min)后的上清液。加无水乙醇至上清液中,使乙醇终质量分数达到95%,离心(2 000 r/min, 10 min)后取沉淀。并利用Savage试剂(氯仿∶正丁醇=4∶1)去除沉淀中的蛋白层。收集去除蛋白层后的水相,通过冷冻干燥获得胞内多糖粗提物。
1.1.2 实验用虾及饲料 实验用凡纳滨对虾购自山东省青岛市宝荣水产科技发展有限公司,体色和活力正常,初始体重为(0.88±0.04) g,体长为(4.19±0.06) cm。
以烟台大乐凡纳滨对虾配合饲料为基础饲料。饲料的主要营养成分包括:粗蛋白含量≥39%、粗脂肪≥4%、粗纤维≤6%、钙≤5%、总磷≥1.2%、水分≤11.0%。将提取物用适量的水稀释,采用喷淋搅拌的方式与配合饲料进行混匀,于30 ℃条件下干燥并保存至-20 ℃条件下备用。以上2种粗提物添加量均为1%,即每kg配合饲料添加10 g粗提物。
1.1.3 实验条件 该实验在室内养殖水循环系统中进行。该水循环系统组成包括:玻璃缸(50 cm×35 cm×50 cm)、砂滤罐、紫外消毒器、泡沫分离器。整个养殖期间水质条件如下:水温(26.00±1.00)℃,盐度30.00±1.50,pH为7.7~8.1,DO≥6 mg/L。
1.2 实验设计与管理
1.2.1 养殖实验 实验设置对照组(Blank)、胞外蛋白组(Ex-Pro)及胞内多糖组(In-Poly)3个实验组。每个实验组设置4个平行组,每个平行15只对虾。其中,对照组只投喂配合饲料;胞外蛋白组投喂含1%芽孢杆菌胞外蛋白粗提物的配合饲料;胞内多糖组投喂含1%芽孢杆菌胞内多糖粗提物的配合饲料。养殖期间每天投喂3餐,根据对虾的生长及摄食情况合理调整投喂量,养殖实验共持续28 d。
1.2.2 WSSV感染实验 养殖实验结束后,凡纳滨对虾停食1 d,参照Feng[12]等的方法将各实验组剩余的虾进行WSSV注射感染实验。该实验所用WSSV由中国海洋大学水产动物病害与免疫学研究室提供,提取自感染WSSV病毒的中国对虾(Fenneropenaeuschinensis)鳃组织。使用前用0.01 mol/L PBS稀释1 000倍,在虾腹部第四、五节之间注射,注射剂量为50 μL。观察、统计各组凡纳滨对虾死亡数并计算累积死亡率。
1.3 样品采集与测定
1.3.1 样品采集与保存 于实验第0天从所有实验对虾中随机取3只对虾,实验过程中,分别在14和28 d随机从各实验组取3只对虾,将对虾肝胰腺、肌肉及肠道组织取出后放入超低温冰箱(-80 ℃)中保存备用。
1.3.2 样品测定 准确称取各组对虾肝胰腺、肌肉及肠道组织0.2 g于预冷的生理盐水(样品质量与生理盐水体积比为1∶9)中充分匀浆,离心(2 500 r/min, 10 min)取上清液进行各指标的测定。肝胰腺及肌肉中能量代谢相关酶指标包括己糖激酶(HK)活力、磷酸果糖激酶(PFK)活力、丙酮酸激酶(PK)活力、乳酸脱氢酶(LDH)活力、琥珀酸脱氢酶(SDH)活力、脂肪酸合酶(FAS)含量,肠道消化酶指标包括蛋白酶活力、淀粉酶活力、脂肪酶活力。以上指标均使用南京建成试剂盒测定,具体操作按照相应试剂盒操作说明完成。
肝胰腺中电子传递系统(Electron Transport System, ETS)活力参考De Coen等[13]的方法进行测定,操作步骤为:将肝胰腺组织放入缓冲液(75 mmol/L MgSO4,1.5 g/L polyvinypyrrolidone, 0.2% Triton X-100 and 0.1 mol/L TriseHCl, pH=8.5)中匀浆后,离心(800g, 10 min)并取上清液50 μL加入到150 μL反应体系(1.7 mmol/L NADH, 0.25 mmol/L NADPH, 0.2% Triton X-100 and 0.1 mmol/L TriseHCl, pH=8.5)中。在体系中继续加入100 μL p-Iodonitroterazolium,20 ℃下反应10 min,立即加入50 μL终止液(50%甲醛,50% 1 mol/L H3PO4)使反应终止,利用分光光度计测定体系最终吸光度OD490。通过ε=15 900/(mol·L-1)计算甲瓒的生成量,然后通过甲瓒的生成量换算成O2的消耗量(体系每生成2 mmol甲瓒消耗1 mmol O2),以消耗的O2量表示ETS活力。
在养殖实验结束后测量各组虾的质量,并计算其相对增重率(Weight gain rate, WGR)和特定生长率(Specific growth rate, SGR),计算公式如下:
WGR=[(Wt-W0)/W0] ×100;
SGR(%·d-1)=[(lnWt-lnW0)/T] ×100。
式中:W0表示初始质量(g);Wt表示养殖结束后的质量(g);T表示间隔天数(d)。
1.4 数据统计
实验数据采用平均数±标准差(Means±SD)表示,酶学测定时每个实验处理重复3次(N=3),对同一时间点不同实验组的数据进行单因素方差分析(One-way ANOVA),应用Duncan多重比较检验各组数据之间的差异性。通过软件SPSS 17.0进行数据统计与分析,P<0.05即表示具有显著差异。
2 实验结果
2.1 芽孢杆菌蛋白和多糖粗提物对幼虾生长性能的影响
养殖实验结束时,各组凡纳滨对虾的终末体重、WGR、SGR和成活率如表1所示。在饲料中添加芽孢杆菌胞外蛋白和胞内多糖粗提物后,凡纳滨对虾的体重、WGR、SGR及成活率与对照组相比无显著差异(P>0.05)。

表1 各组凡纳滨对虾的终末体重、相对增重率、特定生长率及成活率Table 1 Final body weight, WGR, SGR, and survival rate of L. vannamei in different groups
2.2 芽孢杆菌蛋白和多糖粗提物对幼虾肝胰腺中能量代谢相关酶活力的影响
饲喂胞内多糖粗提物使HK活力下降,且胞内多糖组HK活力在养殖实验前期显著低于对照组(P<0.05)(见图1A)。在养殖实验前期,胞外蛋白组PFK活力显著高于对照组(P<0.05)(见图1B),但实验结束时,胞外蛋白组与对照组之间无显著差异(P>0.05)。各组凡纳滨对虾PK活力无显著差异,但随着养殖时间的延长呈现下降的趋势(见图1C)。
胞外蛋白组和胞内多糖组LDH活力在养殖实验前期显著高于对照组(P<0.05)(见图1D)。但在养殖实验后期,胞外蛋白组与对照组无显著差异(P>0.05),而胞内多糖组显著低于对照组(P<0.05)。
胞外蛋白组SDH活力在养殖实验前期与对照组无显著差异(P>0.05),但养殖实验后期显著高于对照组(P<0.05)(见图1E)。饲喂胞内多糖粗提物后,凡纳滨对虾SDH活力与对照组无显著性差异及明显变化规律(P>0.05)(见图1E)。
饲喂胞外蛋白粗提物和胞内多糖粗提物一段时间后,幼虾FAS含量显著低于对照组(P<0.05)(见图1F),但饲喂随着时间的延长,各组之间FAS含量无显著差异(P>0.05)。
2.3 芽孢杆菌蛋白和多糖粗提物对幼虾肌肉中能量代谢相关酶活力的影响
胞外蛋白组的凡纳滨对虾在养殖实验后期HK活力显著高于对照组(P<0.05)(见图2A)。胞外蛋白组和胞内多糖组PFK活力在养殖实验后期显著低于对照组(P<0.05)(见图2B),且胞外蛋白粗提物的效果更加显著。与对照组相比,饲喂胞外蛋白粗提物和胞内多糖粗提物对PK活力无显著影响(P>0.05)(见图2C),但在养殖实验后期,胞外蛋白组显著低于胞内多糖组(P<0.05)。
饲喂2种不同粗提物对LDH活力均表现出显著影响(P<0.05)(见图2D)。其中,饲喂胞外蛋白粗提物后,凡纳滨对虾LDH活力显著低于对照组(P<0.05)。胞内多糖组LDH活力在养殖实验前期与对照组相比无显著差异(P>0.05),但随着饲喂时间的延长,显著低于对照组(P<0.05)。
SDH活力在养殖实验后期受到2种不同粗提物的显著影响(P<0.05)(见图2E),在养殖实验后期,胞外蛋白组和胞内多糖组SDH活力均显著高于对照组(P<0.05)。
在养殖实验前期,饲喂胞外蛋白粗提物和胞内多糖粗提物对FAS含量无显著影响(P>0.05)(见图2F),但随着饲喂时间的延长,在养殖实验后期,胞外蛋白组和胞内多糖组FAS含量显著低于对照组(P<0.05),其中胞内多糖组效果尤其显著。

(同一时间点上不同字母表示具有显著性差异(P<0.05)。At each time point, means with different letters are significantly different (P<0.05).)
图1 各组凡纳滨对虾肝胰腺中己糖激酶(HK, A)、磷酸果糖激酶(PFK, B)、丙酮酸激酶(PK, C)、
乳酸脱氢酶(LDH, D)、琥珀酸脱氢酶(SDH, E)活性和脂肪酸合酶(FAS, F)含量的变化
Fig.1 Variations of hexokinase (HK, A), phosphofructokinase (PFK, B), pyruvate kinase (PK, C), lactate
dehydrogenase (LDH, D), and succinate dehydrogenase (SDH, E) activity and fatty acid
synthase (FAS, F) content in the hepatopancreas ofL.vannameiin different groups
2.4 芽孢杆菌蛋白和多糖粗提物对幼虾肠道消化酶活力的影响
胞外蛋白组蛋白酶活力高于对照组,且在养殖实验前期达到显著水平(P<0.05)(见图3A)。在养殖实验的14和28 d,胞内多糖组蛋白酶活力均显著高于对照组(P<0.05)(见图3A)。饲喂胞外蛋白和胞内多糖粗提物对淀粉酶活力无显著影响(P>0.05)(见图3B)。脂肪酶活力受胞外蛋白粗提物的显著影响(P<0.05)(见图3C),胞外蛋白组脂肪酶活力低于对照组,且在养殖实验前期达到显著水平(P<0.05)。
2.5 芽孢杆菌蛋白和多糖粗提物对幼虾肝胰腺中ETS活力的影响
饲喂胞外蛋白与胞内多糖粗提物对ETS活力具有显著影响(P<0.05)(见图4)。胞外蛋白组与胞内多糖组凡纳滨对虾ETS活力显著高于对照组(P<0.05),其中胞外蛋白粗提物的作用尤为显著。
2.6 WSSV感染阶段对虾累积死亡率
感染WSSV后,对照组凡纳滨对虾累积死亡率高于胞外蛋白组和胞内多糖组(见图5)。对照组半致死时间LT50为42 h,胞外蛋白组和胞内多糖组凡纳滨对虾半致死时间LT50分别为53和45 h,相较于对照组分别延长了26.19%和7.14%。
3 讨论
3.1 饲料中添加芽孢杆菌胞外蛋白和胞内多糖粗提物对幼虾生长的影响
芽孢杆菌是对虾养殖过程中常用的益生菌,同样也是饲料中主要益生菌添加种类。唐杨等研究发现饲料中添加蜡样芽孢杆菌(B.cereus)可提高凡纳滨对虾的生长速度[14]。但刘强强等将地衣芽孢杆菌(B.licheniformis)添加至对虾饲料中,发现其对凡纳滨对虾生长的促进作用不显著[15]。此外,某些外源蛋白[16]和多糖[17]等饲料添加剂对对虾生长、存活等方面的提高作用也已被证实。然而,本实验发现,在饲料中添加芽孢杆菌胞外蛋白或胞内多糖粗提物对促进幼虾生长及提高成活率的效果并不显著。

(同一时间点上不同字母表示具有显著性差异(P<0.05)。At each time point, means with different letters are significantly different (P<0.05).)
图2 各组凡纳滨对虾肌肉中己糖激酶(HK, A)、磷酸果糖激酶(PFK, B)、丙酮酸激酶(PK, C)、
乳酸脱氢酶(LDH, D)、琥珀酸脱氢酶(SDH, E)活性和脂肪酸合酶(FAS, F)含量的变化
Fig.2 Variations of hexokinase (HK, A), phosphofructokinase (PFK, B), pyruvate kinase (PK, C),
lactate dehydrogenase (LDH, D),and succinate dehydrogenase (SDH, E) activity and fatty acid synthase (FAS, F)
content in the muscle ofL.vannameiin different groups
3.2 饲料中添加芽孢杆菌胞外蛋白和胞内多糖粗提物对幼虾能量代谢相关酶的影响
HK、PK、PFK作为糖酵解途径3个关键的变构调节酶,其活力可反映机体糖酵解途径的水平[18]。该实验中发现,饲喂胞外蛋白粗提物一段时间后,肝胰腺中PFK活力有一定程度的提高,但在养殖实验后期,胞外蛋白组肝胰腺及肌肉组织中糖酵解相关酶活力与对照组相比差异不显著,甚至低于对照组。由以上结果推测饲喂胞外蛋白粗提物一定时间内能够刺激凡纳滨对虾幼虾肝胰腺糖酵解能力的增强。但随着饲喂时间的延长,肝胰腺糖酵解途径水平减弱。而饲喂胞内多糖粗提物对肝胰腺和肌肉中HK、PK和PFK活力影响不显著,表明胞内多糖粗提物对其糖酵解能力无显著影响。
LDH是葡萄糖的无氧分解酶,其作用是将糖酵解途径产生的丙酮酸在无氧条件下还原成乳酸[19]。养殖实验前期,胞外蛋白和胞内多糖组肝胰腺和肌肉中LDH活力均高于对照组,而到了养殖实验后期,与对照组之间无显著差异甚至低于对照组。肌肉中LDH活性呈现出与肝胰腺中相似的变化规律,养殖实验后期,胞外蛋白和胞内多糖组幼虾肌肉中LDH活力显著低于对照组。该实验结果表明胞外蛋白及胞内多糖粗提物能够在一定程度上加强幼虾肝胰腺对糖类能源物质的无氧代谢能力,但随着饲喂时间延长,效果逐渐不明显,甚至会减弱机体对糖类的无氧代谢能力。该结果与粗提物对糖酵解途径的影响一致。
SDH是三羧酸循环的关键酶,可为真核细胞和多种原核细胞需氧和产能的呼吸链提供电子[20],其活力可在一定程度上反映糖类有氧代谢的水平[21]。该实验发现,饲喂胞外蛋白及胞内多糖粗提物能不同程度地提高凡纳滨对虾幼虾机体SDH活力,相比较而言,胞外蛋白粗提物的效果更加明显。SDH活力的提高表明饲喂胞外蛋白及胞内多糖粗提物在一定程度上能提高糖类的有氧代谢水平,加快机体对糖类的转化利用。
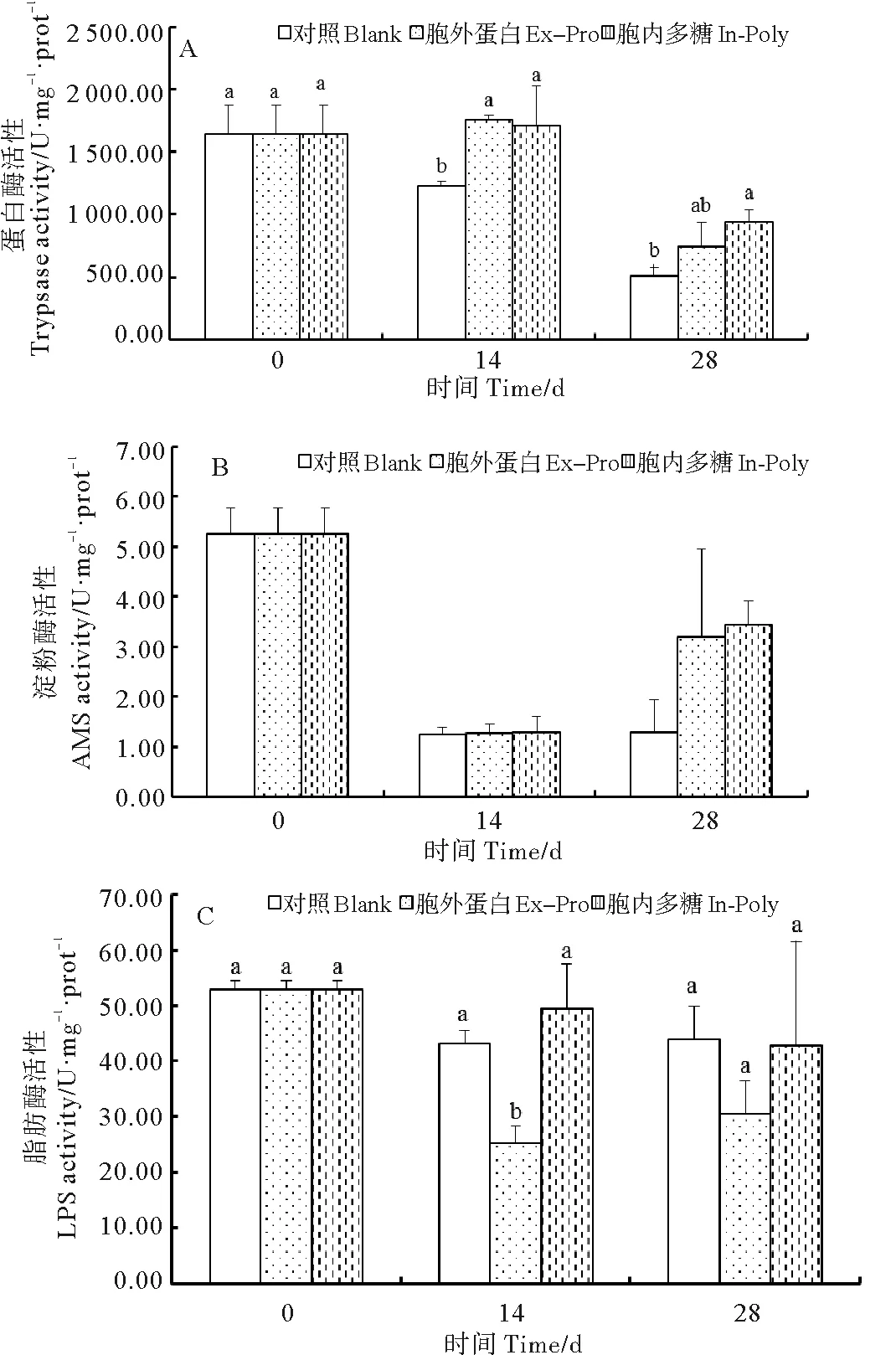
(同一时间点上不同字母表示具有显著性差异(P<0.05)。At each time point, means with different letters are significantly different (P<0.05).)
图3 各组凡纳滨对虾肠道中蛋白酶(Trypsase, A)、
淀粉酶(AMS, B)、脂肪酶(LPS, C)活性的变化
Fig.3 Variations of intestinal protease (A), amylase (B), and
lipase (C) activity ofL.vannameiin different groups
FAS是一种多酶复合体,在机体脂类代谢过程中具有重要作用[22]。FAS的多寡、活力的高低一定程度上可以反映动物机体脂质代谢水平[23]。有研究表明,动物机体FAS含量受到碳水化合物[24]、蛋白质[25]及脂肪酸[26]种类及含量等因素的影响。本实验中,饲喂胞外蛋白及胞内多糖粗提物一段时间后,幼虾肝胰腺中FAS含量有所下降,肌肉中FAS含量无明显变化。表明饲喂胞外蛋白及胞内多糖粗提物对凡纳滨对虾幼虾脂类代谢水平具有一定的抑制作用,且主要作用于肝胰腺中。但随着饲喂时间的延长,各组幼虾肝胰腺中FAS含量无显著差异,胞外蛋白组和胞内多糖组肌肉中FAS含量显著低于对照组,推测2种粗提物对脂类代谢的抑制作用逐渐转移至肌肉组织中。其中的具体机制还有待进一步探讨。

(同一时间点上不同字母表示具有显著性差异(P<0.05)。At each time point, means with different letters are significantly different (P<0.05).)
图4 各组凡纳滨对虾肝胰腺中电子传递系统(ETS)活性的变化
Fig.4 Variations of ETS activity in the hepatopancreas
ofL.vannameiin different groups

图5 感染WSSV后凡纳滨对虾的累积死亡率Fig. 5 Cumulative mortality rate of L. vannamei in different groups during the WSSV infection period
3.3 饲料中添加芽孢杆菌胞外蛋白和胞内多糖粗提物对幼虾肠道消化酶的影响
动物的消化器官对饲料的组成具有较强的敏感性,饲料的组成能调节消化酶活力,进而对动物的其它生理状态造成影响[27]。Ziaei-Nejad等发现,在对虾饲料中添加芽孢杆菌能够提高对虾肠道消化酶活力[28]。胡毅等也发现在饲料中添加益生菌能够提高对虾肠道蛋白酶和淀粉酶活力,并推测消化酶活力的提高可能会促进对虾的生长[29]。该实验中发现饲喂芽孢杆菌2种粗提物后,蛋白酶活力均显著提高,表明2种粗提物均会增强凡纳滨对虾幼虾肠道对蛋白质营养的吸收。除此之外,还发现胞外蛋白组的脂肪酶活力显著低于对照组,表明胞外蛋白粗提物降低了幼虾对脂肪营养的吸收利用,这可能与上述胞外蛋白组对虾肝胰腺及肌肉组织中FAS含量的较低有一定关系。
3.4 饲料中添加芽孢杆菌胞外蛋白和胞内多糖粗提物对幼虾肝胰腺ETS活力的影响
ETS可将电子从待氧化的底物逐级传递到分子氧,同时释放能量,其活力可用以反应机体的代谢水平[30]。该实验中,饲料中添加2种粗提物后可以有效提高幼虾肝胰腺中的ETS活力,表明胞外蛋白和胞内多糖粗提物能够提高凡纳滨对虾幼虾机体的整体代谢水平。结合上述机体能量代谢相关酶结果分析,糖类有氧代谢水平的提高可能是ETS活力增强的原因之一。
3.5 饲料中添加芽孢杆菌胞外蛋白和胞内多糖粗提物对幼虾抗WSSV能力的影响
芽孢杆菌作为一类在对虾养殖中广泛应用的益生菌,已有研究证明其中的某些菌株能够提高对虾抗WSSV能力[31]。此外,已有报道称蛋白[32]、多糖[33]等功能性饲料添加剂能够起到相似的作用。该实验所选取的芽孢杆菌BZ5株已在前期研究中证明了其能够提高凡纳滨对虾抗WSSV能力[9, 34]。该实验再次证明了该芽孢杆菌的胞外蛋白和胞内多糖粗提物能够在一定程度延长WSSV感染后的LT50。其中,胞外蛋白粗提物的作用尤其明显。因此推测胞外蛋白和胞内多糖可能是该菌株提高凡纳滨对虾抗WSSV能力的功能组分。
学者们通常是从提高机体免疫能力的角度解释对虾抗病能力提高的原因。然而,已有研究表明对虾在提高机体免疫应答水平的同时会大量消耗能量[35-36],因此能量代谢水平与凡纳滨对虾抗病原感染能力密切相关。该实验发现饲喂2种粗提物提高了幼虾机体代谢水平,尤其是糖类的有氧代谢水平。幼虾感染WSSV后,能源物质能够快速动员以抵抗病原感染,因此可能是对虾感染WSSV后LT50延长的原因之一。而且,胞外蛋白粗提物对糖类代谢水平的提高作用较胞内多糖粗提物更加显著,这可能是胞外蛋白组幼虾LT50明显长于胞内多糖组的原因。
此外,FAS在动物抗菌及抗病毒免疫中的作用也逐渐被研究者证明。Yang等研究表明,WSSV会诱导对虾FAS表达增加,改变宿主体内的脂类代谢平衡,直接影响病毒组装[37]。Hsieh等发现,在FAS抑制剂存在的条件下,WSSV病毒体的形成受损[38]。该实验中发现饲喂胞外蛋白和胞内多糖粗提物使幼虾FAS含量下降,一定程度上可能会提高其抗WSSV感染死亡能力。
4 结语
在饲料中添加芽孢杆菌胞外蛋白和胞内多糖粗提物对凡纳滨对虾幼虾生长无显著性影响,但一定程度上影响了机体能量代谢水平和肠道消化酶活力。其对幼虾能量代谢的影响具体表现在提高了糖类的有氧代谢水平,抑制了脂类代谢水平。2种粗提物对凡纳滨对虾幼虾抗WSSV能力均有不同程度的提高,通过结果分析,推测这种抗病能力的提高与其对虾的能量代谢水平的影响密切相关。

