Fischer吲哚合成研究探索
张 玉,高 盼
(1江苏天和制药有限公司 质量部,江苏 扬州 225211;2.扬州大学 化学化工学院,江苏 扬州 225002)
吲哚是自然界中存在最为普遍的杂环之一,由于生物活性吲哚分子具有突出的结构多样性特质,因此吲哚环系统已成为许多药物的重要结构成分[1-2]。取代吲哚被称为“特权结构”,因为它们能够与许多具有高亲和力的受体结合[3]。近一百多年来,吲哚的合成和官能团化一直是有机合成化学家们关注的一个重要领域,并且已经开发出许多制备吲哚的方法,合成的关键因素包括起始原料是否简单易得和官能团的耐受性[4-6]。在某些情况下,特定的取代模式仍然很难通过标准的吲哚形成反应获得,因此,一系列新的方法学应运而生。
合成工艺化学家主要对温和条件下的合成方法感兴趣,这些方法不仅可以提供吲哚环的快速组装策略,且具有广泛的官能团耐受性,和符合原子经济性。实施实用、安全和可拓展的方法来大规模制备吲哚类化合物对于工业设计和生产以及学术界的研究人员来说都是至关重要的。近100多年来,Fischer吲哚合成反应一直是合成各种吲哚中间体和生物活性化合物非常实用和重要的方法,该反应将烯醇化N-芳基腙转化为吲哚提供了一种简单、有效的方法[7]。在大部分情况下,Fischer吲哚化反应是通过简单地使用适当的酸或酸催化剂加热酮或醛和芳基肼而进行的,而不分离腙中间体。Fischer反应的优点包括在芳环上可以接受各种类型的取代基,并且不需要通过形成新的C-C和C-N键来对底物进行预先官能团化。N-芳基腙通常通过芳基肼与可烯醇化酮缩合制备,由于很少有芳基肼在商业上可买到,它们通常是通过还原芳基重氮盐来制备的,而芳基重氮盐又是从廉价的苯胺中获得的。另外,芳基偶氮盐也可通过Japp-Klingemann反应直接转化为腙[8]。
自1883年Fischer反应首次被发现后的几十年里,化学家对该反应的机理进行了广泛的研究[9-10],直至1924年Robinson提出的反应路径得到了广泛的认同(图 1)。首先苯基肼与酮形成苯腙在酸性条件下质子化异构化得到烯肼中间体1,随后经过[3,3]重排形成亚胺中间体2,中间体2通过质子转移芳构化后得到中间体3,分子内亲核进攻亚胺关环得到吲哚啉类化合物4,最后脱去一分子的氨气芳构化得到最终吲哚产物。从该机理可以看出,当酮的羰基两侧都存在α氢时,会出现选择性的问题。本文综述了Fischer吲哚合成反应的方法学和应用研究进展,在过去的十年中,关于该反应的报道已有800多篇,但是大部分都集中在各类药物分子的小规模合成,该篇综述将重点介绍关于Fischer策略的大规模合成方法,这为工业生产提供有力的参考依据。

图1 Robinson提出的反应路径
1 通过芳基肼合成吲哚
临床研究表明MDL 103371这是一种有效的甘氨酸受体拮抗剂,具有治疗中风的潜在功效。Watson课题组利用商业易得的3,5-二氯苯肼盐酸盐5与丙酮酸乙酯在乙醇中得到E/Z混合物腙化合物6,在PPA(多聚磷酸)存在下通过Fischer环化得到吲哚化合物7,最后通过Vilsmeier-Haack甲酰化得到千克级三号位醛基取代吲哚化合物8,8可以通过六步反应,以49%的总收率得到最终产物9,实现了MDL 103371的大规模制备[11](图 2)。

图2 MDL 103371的制备路径
与芳基肼形成腙的不仅局限于醛酮类化合物,还可以利用缩醛,Bosch利用芳基胺10在亚硝酸钠和盐酸条件下生成重氮盐[12],利用氯化锡还原以82%的收率得到相应的肼11,此时使用缩醛12在Fischer反应的条件下实现了色胺13的合成,最后利用还原胺化以88%的收率得到最终目标产物14,这是一种有效的血清素受体激动剂[13](图 3)。
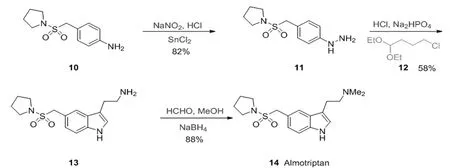
图3 Almotriptan合成路径
环烯醚化合物同样可以用于Fischer吲哚反应,实现多种色胺衍生物的合成,Anderson课题组优化了五氟吲哚17的合成方法[14](图 4),向对氟苯肼盐酸盐的丙二醇水溶液中缓慢加入二氢吡喃(BHT),能够高收率的得到化合物17,随后经历多步反应能够以50%的收率得到最终产物5-HT受体拮抗剂18。
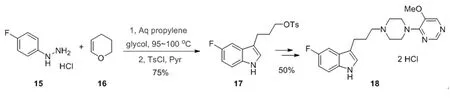
图4 5-HT受体拮抗剂合成路径
2 通过Japp-Klingemann反应合成吲哚
Japp-Klingemann反应为Fischer法合成吲哚提供了新的途径,反应历程如下[15],重氮盐与β-二酮酯化合物20反应可以得到腙21,随后环化芳构化得到最终吲哚产物(图 5)[16],该策略避免使用了价格昂贵,不易得的芳基肼作为起始原料,直接利用廉价的苯胺类化合物合成相应的重氮盐。
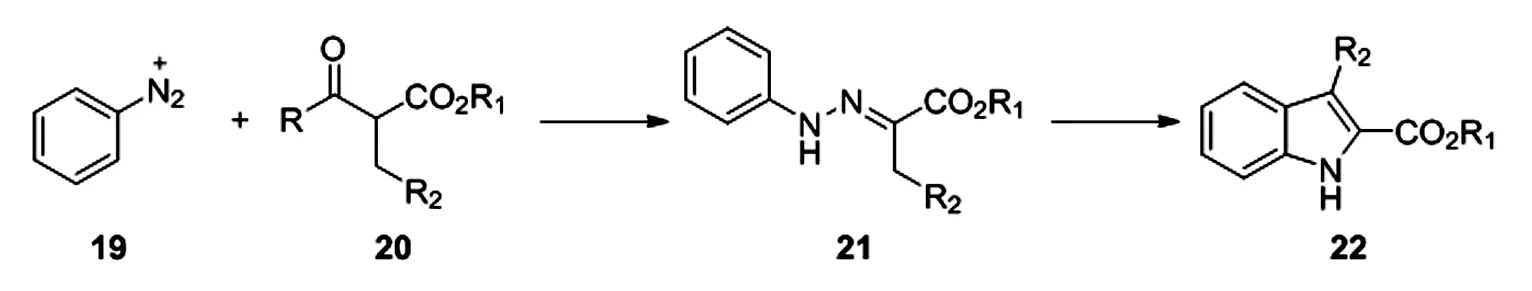
图5 Japp-Klingemann反应合成吲哚
利用该策略已经实现多种药物分子的高效合成,吲哚衍生物26已经被证明是许多药物分子合成的关键中间体[17],利用从商业获得26,可以实现非核苷类逆转录酶(RT)抑制剂阿替维啶(Atevirdine U-87201E)的产业规模级合成[18]。近期Bessard发现了一种新颖高效的工艺[19],通过Japp-Klingemann和Fischer-indole合成法,以廉价易得的丙二酸衍生物为起始原料制备27。将对甲氧基苯胺23通过经典方法合成相应的重氮盐,无需后续处理,直接将得到的重氮盐溶液与2-甲基丙二酸二甲酯反应得到相应的偶氮中间体24,该步骤能否成功,碱的选择起到了决定性的作用,最终选择以甲醇/水为溶剂,碳酸钠和三乙胺各一个当量,得到最佳结果。随后中间体24在催化量的乙醇钠条件下经过Japp-Klingemann重排得到腙25,最后通入盐酸气条件下实现Fischer环化以64%的总收率得到关键中间体26(图 6)。
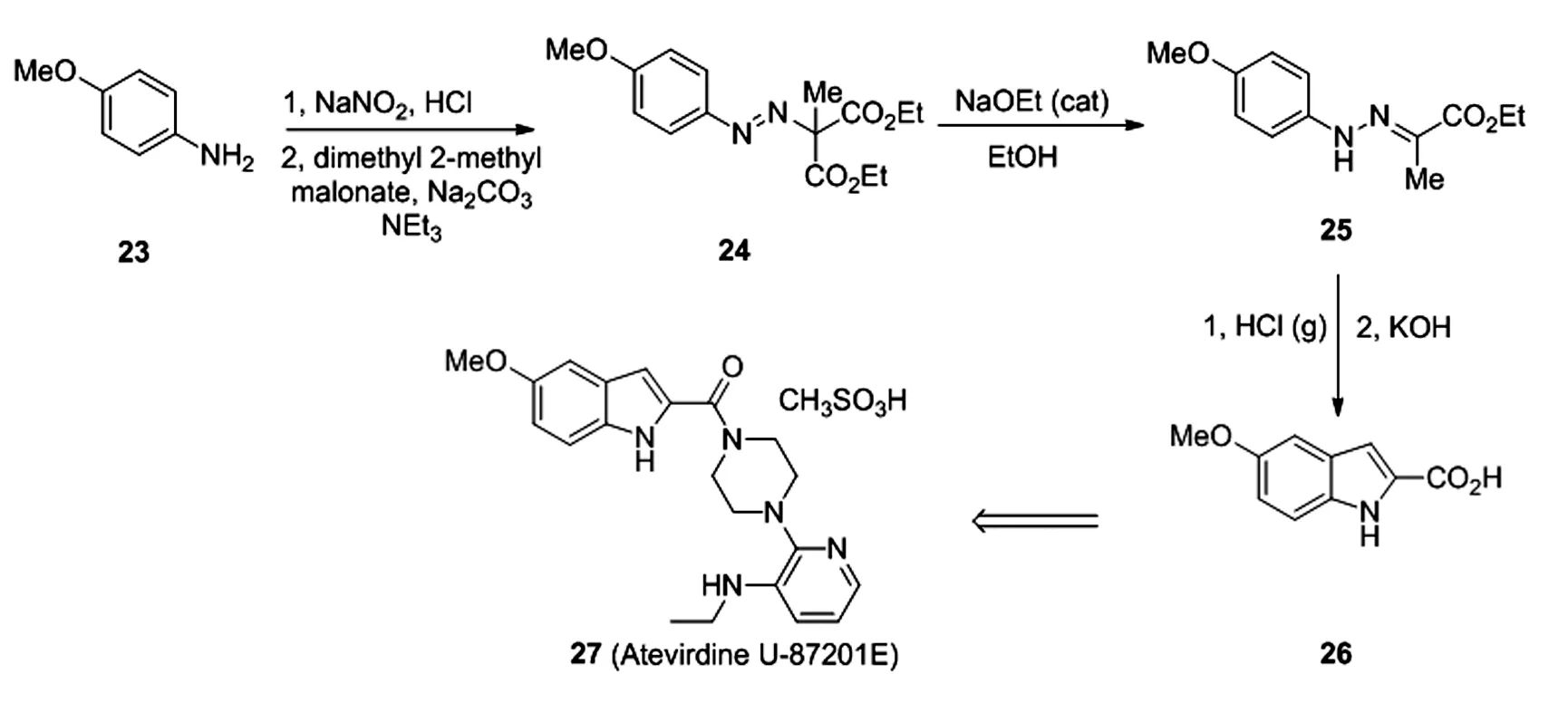
图6 阿替维啶(Atevirdine U-87201E)合成路径
Cook利用Japp-Klingemann合成法实现了5,6-二取代-3-甲基吲哚的大规模工业合成[20],以31a为例,他们以3-氯茴香胺为原料在标准条件下重氮化后与α-乙基乙酰乙酸乙酯反应得到29,随后在盐酸的乙醇溶液中Fischer环化得到30a,30a只需要在混合物中重结晶即可得到纯产物,最后在铜作用下脱羧得到31a。利用吲哚31a-31d可以合成多种重要的天然产物,例如31a可以用来制备L(-)-6-氯-5-羟色胺酸[21],它是合成keramamide A的关键中间体。类似的31b可以也可以用于各种类型天然产物分子的全合成,例如(+)majvinine,(+)-10-methoxyaffinisine,(+)-N-methylsarpagine,和macralstonidine[22-23]。
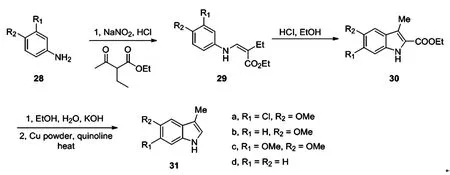
图7 5,6-二取代-3-甲基吲哚合成路径
3 通过金属催化实现吲哚合成
Fischer吲哚反应的局限性之一是需要经历取代芳基肼或芳基腙中间体,如前面所述,制备N-芳基腙的最常用方法是N-芳基肼与羰基化合物直接缩合,或者芳基重氮卤化物的Japp-Klingemann反应。这两种方法都涉及芳基重氮盐的形成,这些盐要么还原成肼,要么直接在Japp-Klingemann反应中反应。Buchwald为了克服这一局限性[24],他报告了一种钯催化偶联策略,用于从市售廉价的二苯甲酮腙32和芳基溴化物33制备N-芳基二苯甲酮腙34(图 8)。二苯甲酮腙34通常是结晶状的,且稳定不可降解,不能进行Fischer吲哚化;然而,在各种酮存在下用酸处理时,能够形成可烯醇化的腙,能够得到高产率的吲哚36。一般来说,对甲苯磺酸(p-TSA)是费希尔反应的最佳酸催化剂,只需要略微过量的酮。这种方法普适性非常好,能够兼容各种溴代芳烃和酮类化合物。该策略可以进一步拓展,通过加入LDA和卤代烷烃将34转化为35,随后得到N-烷基吲哚化合物37。
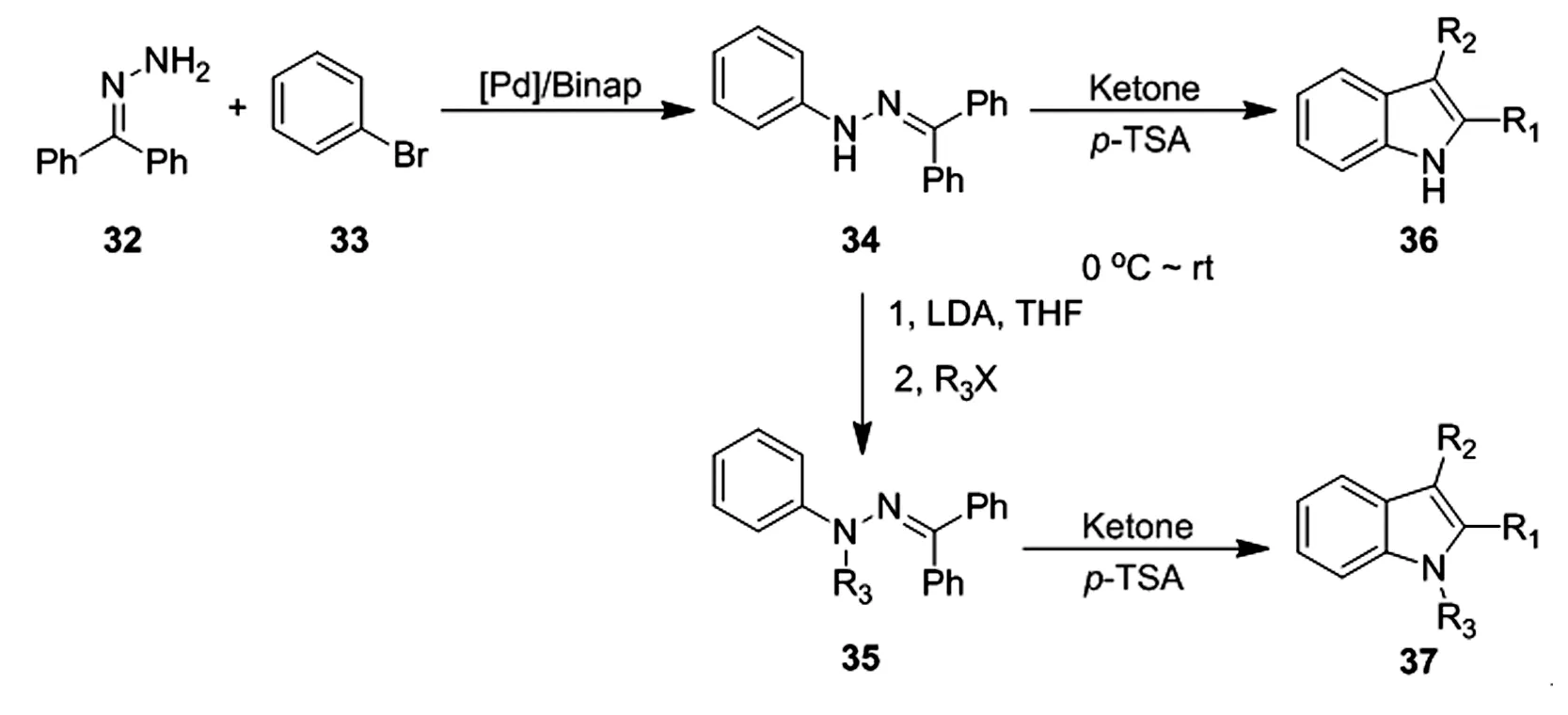
图8 N-烷基吲哚化合物合成路径
尽管有传统Fischer法合成吲哚已经较为成熟,且具有很好的官能团耐受性,但是肼与未保护的醛反应通常产率较低,并可产生不需要的副产物[25]。有许多策略已经被用来克服这个问题,包括转化为缩醛、烯醇醚或亚硫酸氢盐加合物。最近,Odom实现了钛催化炔烃与肼的分子间氢胺化反应直接生成腙[26]38在芳基肼39的存在下通过钛催化实现了腙40的合成,产物腙40通过添加ZnCl2进行一锅Fischer吲哚反应,在克及规模高产率地得到N-烷基和N-芳基吲哚41。这是通过炔烃合成腙的一个崭新方法,并且已经推广应用于工业生产(图 9)。
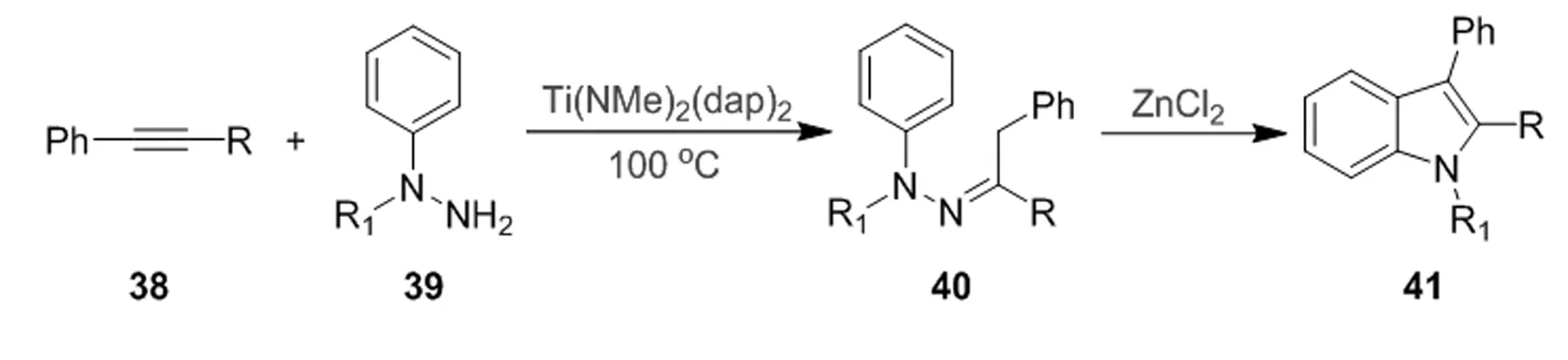
图9 N-芳基吲哚合成路径
作为炔烃氢化胺化研究的一部分,Bellar使用环戊二烯基钛催化剂[(η5-Cp)2Ti(η2-Me3SiC2-SiMe3)]对芳基肼与各种炔烃加成氢胺化反应的区域选择性进行了研究[27],开发了一种高效的一锅法合成色胺和色胺同系物的途径(图 10)。该机理涉及高选择性、钛催化的炔烃42的Markovnikov氢化胺化反应,以提供N-芳基-N-氯代烷基腙。原位Fischer反应得到较高产率的色胺衍生物44。
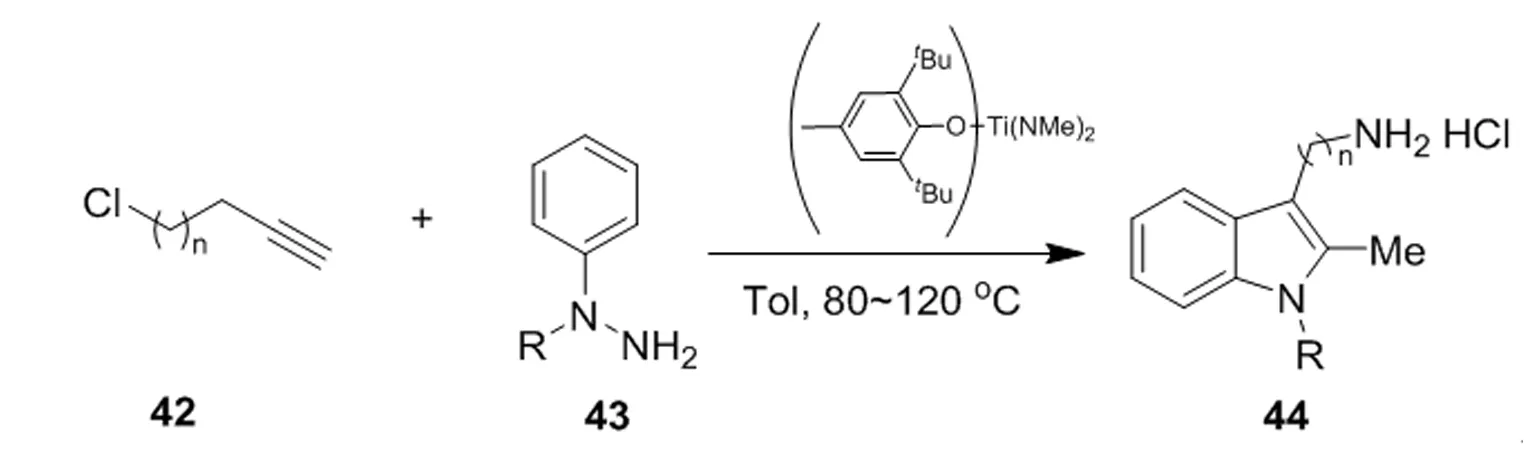
图10 一种高效的一锅法合成色胺和色胺同系物的途径
众所周知,通过烯烃的氢甲酰化反应可用于Fischer吲哚法所用到的醛类化合物合成[28]。最初由Eilbracht实现的氢甲酰化/Fischer吲哚串联反应已发展成为一种有效的一锅法合成复杂吲哚的方法[29]。一般的反应途径包括原位生成醛中间体46,与芳基肼缩合得到腙中间体47,最后[3,3]-sigmatropic重排得到吲哚产物48(图 11)。
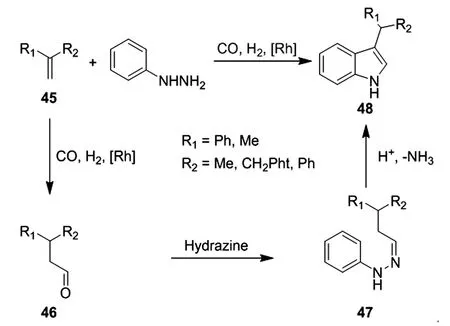
图11 [3,3]-sigmatropic重排得到吲哚产物的合成路径
Eilbracht和Schmidt最近报道了使用串联氢甲酰化/Fischer吲哚化策略合成具有药理意义的氨烷基取代吲哚[30-31]。以Xantphos为配体,以各种烯丙基胺和肼为原料,能够得到各种色胺类化合物。Rh/Xantphos体系对烯丙基胺具有非常好的区域选择性氢甲酰化反应,在此过程中没有检测到异构体的醛产物,该历程首先进行烯49的氢甲酰化反应,得到相应的腙中间体,然后腙在4 %的H2SO4水溶液中加热至100°C完成Fischer反应。氨基甲酸酯保护基51e和51f尤其值得注意,因为它们是构建复杂分子的潜在前体,如L-775606(209)。
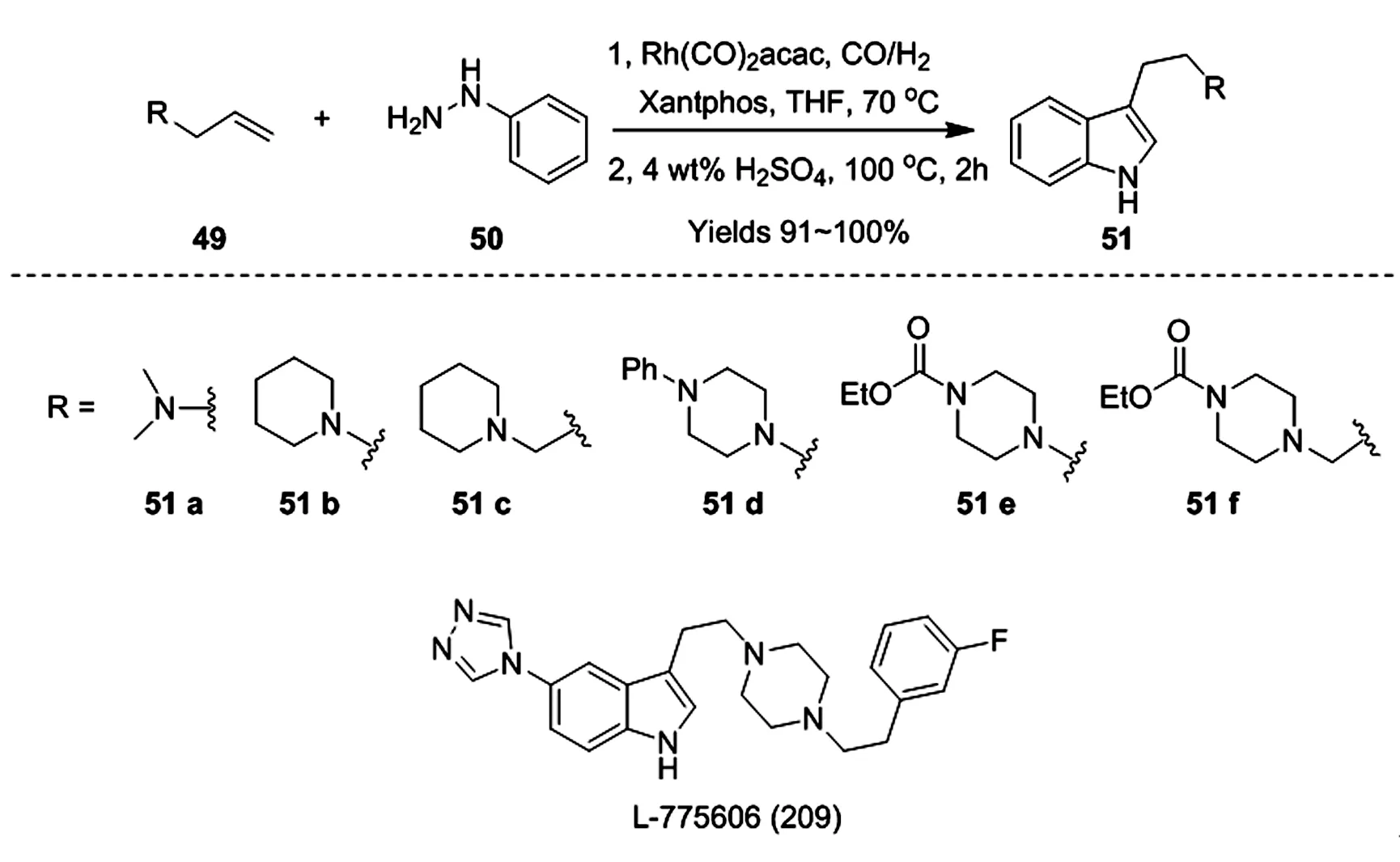
图12 L-775606(209)的合成路径
随后对该策略进行了改进,以在不需要改变溶剂的情况下,一次操作中进行氢甲酰化/Fischer反应,使用水溶性配体在硫酸水溶液中进行整个反应。对粗反应混合物进行简单的碱化、萃取和结晶,得到所需的吲哚54,产率较高(图 13)。
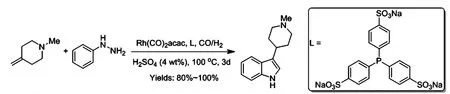
图13 氢/Fischer反应得到吲哚产物的方法

