色胺酮抑制胸腺基质淋巴细胞生成素促肥大细胞增殖的药理机制*
王福银,杜倩,孔丽娟,程春红,王磊
(1.黑龙江省大庆龙南医院药剂科,黑龙江大庆163453;2.河北医科大学,河北石家庄050017)
色胺酮抑制胸腺基质淋巴细胞生成素促肥大细胞增殖的药理机制*
王福银1,杜倩1,孔丽娟1,程春红1,王磊2
(1.黑龙江省大庆龙南医院药剂科,黑龙江大庆163453;2.河北医科大学,河北石家庄050017)
目的探讨色胺酮抑制由胸腺基质淋巴细胞生成素(TSLP)促肥大细胞增殖的药理机制,为色胺酮治疗肥大细胞相关过敏性皮炎提供理论依据。方法在TSLP刺激人源肥大细胞系-1(HMC-1)细胞增殖的前提下,同步采用色胺酮处理增殖的细胞,观察对细胞增殖的影响和相关蛋白水平变化。噻唑蓝(MTT)比色法检测不同浓度色胺酮处理对细胞活力的影响;溴脱氧尿苷渗入试验和Ki67 mR NA水平检测不同处理组细胞增殖情况;蛋白免疫印迹法(Western blot)检测鼠双微体基因2(MDM2)、P53、Caspase-3、多聚ADP-核糖聚合酶(PAR P)剪切蛋白水平变化;实时荧光定量聚合酶链反应检测白细胞介素7受体α(IL-7R a)和TSLPR mR NA的含量。结果MTT比色法结果表明,色胺酮无细胞毒性;溴脱氧尿苷渗入试验和Ki67 mR NA水平的检测均显示色胺酮抑制TSLP刺激的肥大细胞增殖;色胺酮抑制TSLP刺激的HMC-1中MDM2蛋白表达水平,蛋白灰度分析比较差异有统计学意义;色胺酮处理后,HMC-1细胞中,P53蛋白和凋亡标志蛋白Caspase-3、PAR P剪切蛋白水平升高,且蛋白灰度分析比较差异有统计学意义;TSLP上游调控蛋白IL-7R a和TSLPR mR NA水平在色胺酮的作用下受到抑制。结论色胺酮可抑制TSLP促肥大细胞增殖,对治疗肥大细胞相关过敏性皮炎有一定的潜力。
色胺酮;胸腺基质淋巴细胞生成素;人源肥大细胞系-1细胞;半胱天冬酶-3;多聚ADP-核糖聚合酶
过敏性皮炎是一种由免疫细胞和炎症介质相互作用引发的皮肤免疫系统紊乱[1],在免疫反应中,细胞因子通过招募活化的免疫细胞到皮肤损伤部位,从而进一步放大并维持紊乱状态[2],肥大细胞是一种重要的免疫细胞,在内脏黏膜和皮肤下微血管周围广泛分布。另外,其可分泌多种细胞因子,如血小板活化因子,肿瘤坏死因子等,参与免疫调节或过敏反应,并在过敏性皮炎中发挥不可或缺的作用[3-4]。胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin,TSLP)作为表皮屏障缺陷的标志[5],经由白细胞介素7受体α(interleukin 7receptor a chain,IL-7Ra)和TSLP受体(thymic stromal lymphopoietin receptor,TSLPR)在TSLP信号通路上游形成异质二聚体进而发挥功能,参与过敏性皮炎的发生、发展,相关报道称TSLP在肥大细胞的增殖过程中发挥关键作用[6-8]。鼠双微体基因2(murine double mimute 2,MDM2)是一种E3泛素连接酶,可通过泛素降解途径降解P53蛋白,进而抑制肿瘤细胞生长,可调控TSLP促成的肥大细胞增殖[8-9]。另外,研究人员发现MDM2在抑制细胞增殖的同时还可导致半胱天冬酶-3的激活,进而剪切多聚ADP-核糖聚合酶(cleavage of poly-ADP-ribose polymerase,PARP)引发细胞凋亡[10]。
色胺酮是一种吲哚喹唑啉类生物碱,存在于多种植物中。有研究报道,色胺酮有抗炎症、抗过敏等药理学功能[11-13]。因此,笔者猜测色胺酮对过敏性皮炎有一定的治疗作用。笔者通过对TSLP信号通路中MDM2、P53、TSLPR等进行验证,初步探讨色胺酮在过敏性皮炎中的药理机制,为色胺酮治疗肥大细胞相关过敏性皮炎提供理论依据。
1 材料与方法
1.1实验仪器和试剂
1.1.1实验仪器蛋白免疫印迹法(Western blot)设备电泳仪、转膜仪、玻璃胶版等(美国Bio-rad公司),聚合酶链式反应(polymerase chain reaction,PCR)仪(美国Bio-rad公司),实时荧光定量PCR系统(美国ABI公司),倒置显微镜(日本Olympus公司),冷冻离心机、酶标仪、NanoDrop分光光度计(美国Thermo公司)。
1.1.2实验试剂色胺酮(Tryptanthrin,TR)(美国Sigma公司,纯度≥98%,SML0310),二甲基亚砜(dimethyl sulfoxide,DMSO)溶解稀释色胺酮,置于-20℃冰箱冷冻保存,5-溴脱氧尿嘧啶核苷(5-Bromo-2-deoxy Uridine,BrdU)(美国Sigma公司),重组TSLP(美国RD Systems公司),胎牛血清、伊思考夫改良杜尔贝可细胞培养基(iscove's modified dulbecco's medium,IMDM)(美国Gibco公司),BrdU、MDM2、P53、PARP、半胱天冬酶-3、β-actin抗体(美国Santa公司),人源肥大细胞系-1(human mast cell line,HMC-1)细胞来自美国菌种保藏中心细胞库。
1.2实验方法
1.2.1细胞培养含10%胎牛血清的IMDM(加青霉素和链霉素)培养HMC-1细胞,置于孵箱37℃、5%二氧化碳CO2,平均2~3 d传代1次,取对数生长期细胞进行实验。
1.2.2细胞处理和分组色胺酮由DMSO稀释于-20℃冰箱冷冻备用,TSLP蛋白经转染试剂处理进入肥大细胞。实验细胞主要分为3组:空白对照组为DMSO空白和空载质粒转染;TSLP刺激组为转染重组TSLP蛋白处理;色胺酮处理组为TSLP刺激合并转染重组TSLP蛋白后,加入不同浓度色胺酮处理。
1.2.3溴脱氧尿苷渗入试验采用台盼蓝细胞计数方法,各处理组细胞1×104个,设置3次重复,加入Brdu作用3 h,磷酸缓冲盐溶液冲洗1次,经固定、解链、封闭后,一抗4℃孵育过夜,二抗孵育1 h。通过免疫比色法比较各组细胞增殖情况。
1.2.4噻唑蓝[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT]比色法MTT比色法检测细胞活力,计数生长对数期的肥大细胞约1×105个/L,传入96孔板,分为空白处理组、0.1、1.0和10.0μmol共4组,每组8个复孔,并与MTT溶液(5mg/ml)37℃孵育4h。终止培养后,每孔加入200μl DMSO,溶解甲瓒结晶。酶标仪检测各孔在540nm处的吸光度值。
1.2.5Western blot检测收集各处理组的肥大细胞,RIPA裂解液4℃裂解30min,最大转速离心5min,收集蛋白,并进行蛋白定量。5×loading加入蛋白液中95℃煮10min,视定量结果加入样品,经10%分离胶分离90min,100V恒压转膜100 min。5%的脱脂牛奶封闭1h,4℃过夜孵育蛋白一抗。第2天,TBST溶液洗膜3遍,5min/次,室温孵育二抗1h,洗膜3遍,7 min/次;加入A、B发光液后,暗室操作曝光。随机选取曝光蛋白条带3处位置进行蛋白灰度分析,进行各处理组蛋白水平比较。
1.2.6实时荧光定量PCR反应采用Trizol抽提RNA的方法进行总RNA的提取,RNA提取在通风厨中进行。各处理组细胞经1ml Trizol处理后,将裂解物吸置于离心管中,加入200μl氯仿,颠倒震荡数10下。4℃、12 000 r/min离心10 min,缓慢吸出400μl上清液放置于新的离心管中。加入等体积的异丙醇充分混合后,4℃、最大转速离心10min。弃上清,加入75%乙醇1ml,洗涤沉淀,4℃、12 000 r/min离心5 min。弃上清液,吸净酒精,并在通风厨中放置,待残留的酒精液体完全挥发后,视沉淀加适量的无RNA酶H2O,70℃煮10 min。测定RNA浓度,取2μg RNA进行反转录PCR反应。各处理组设置3重复,采用2-△△CT方法对数据进行分析,GAPDH为内参蛋白。见表1。

表1 实时荧光定量PCR反应引物序列
1.3统计学方法
采用SPSS 19.0统计软件进行数据分析,计量资料均采用数±标准差(±s)表示,组间的比较用单因素方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1色胺酮对HMC-1肥大细胞活力和增殖的影响
MTT比色法结果显示,0.1、1.0和10.0μmol的色胺酮分别处理HMC-1细胞后,各组OD值比较,经单因素方差分析,差异无统计学意义(F=0.785,P= 0.512),细胞活力未受到影响。见表2。
表2 色胺酮对细胞活力的影响(μmol±s)

表2 色胺酮对细胞活力的影响(μmol±s)
色胺酮浓度0.00.11.010.0F值P值OD值0.444±0.0090.455±0.0210.453±0.0210.446±0.0120.7850.512
溴脱氧尿苷实验结果显示,TSLP刺激组与空白对照组渗入BrdU的细胞含量比较,经t检验,差异有统计学意义(t=8.557,P=0.001),TSLP刺激组比空白对照组含量高;10.0μmol色胺酮单独处理后,色胺酮刺激组和对照组比较,经t检验,差异无统计学意义(P>0.05);在TSLP刺激后,并于1.0和10.0μmol色胺酮处理组中,色胺酮处理组和TSLP刺激组渗入BrdU的细胞含量比较,经t检验,差异有统计学意义(t=6.532和9.910,P=0.003和0.001),0.1μmol色胺酮处理后,差异无统计学意义(P>0.05),1.0和10.0μmol色胺酮处理组中渗入BrdU的细胞含量高于TSLP刺激组。见图1A。
Ki-67mRNA检测结果显示,TSLP刺激组与空白对照组比较,经t检验,相对Ki-67mRNA水平,差异有统计学意义(t=68.663,P=0.000),TSLP刺激组水平高于空白对照组;经0.1、1.0和10.0μmol色胺酮再次处理后,各组与TSLP刺激组相对Ki-67 mRNA水平比较,经t检验,差异有统计学意义[t= 9.390、18.164和42.819,P=0.001、0.000和0.000],经色胺酮处理后,细胞中相对Ki-67 mRNA水平升高。见图1B~D。
2.2色胺酮抑制HMC-1细胞中MDM2和P53蛋白水平的表达
Western blot结果表明,在TSLP刺激后,HMC-1细胞中MDM2和P53蛋白水平升高,经0.1、1.0和10.0μmol色胺酮处理后,MDM2蛋白水平降低,P53蛋白水平升高,且浓度越高,变化越大。蛋白灰度结果显示,TSLP刺激组与空白对照组MDM2和P53蛋白水平比较,经t检验,差异有统计学意义(t=36.947和55.118,P=0.000),TSLP刺激后MDM2和P53蛋白水平降低;经0.1、1.0和10.0μmol色胺酮处理后,与TSLP刺激组比较,经t检验,差异有统计学意义(MDM2蛋白:t=52.693、57.034和57.808,P=0.000;P53蛋白:t=42.866、9.550和16.977,P=0.000、0.001和0.000),MDM2蛋白水平受到抑制,P53蛋白水平升高。见图2。
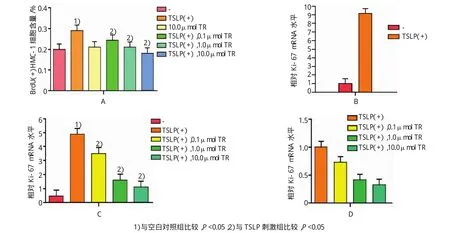
图1 色胺酮对HMC-1肥大细胞增殖的影响

图2 色胺酮抑制HMC-1细胞中MDM2和P53蛋白水平的表达
2.3HMC-1细胞中凋亡标志蛋白半胱天冬酶-3和PARP剪切蛋白在色胺酮的作用下的表达
Western blot结果表明,半胱天冬酶-3和PARP剪切蛋白水平在TSLP的刺激后降低,经0.1、1.0和10.0μmol色胺酮处理后,蛋白水平回升。蛋白灰度分析显示,与空白对照组半胱天冬酶-3和PARP剪切蛋白水平比较,经t检验,差异有统计学意义(t= 8.033和27.587,P=0.001和0.000),半胱天冬酶-3和PARP剪切蛋白在TSLP刺激后水平降低;经0.1、1.0和10.0μmol色胺酮处理后,与TSLP刺激组半胱天冬酶-3和PARP剪切蛋白水平比较,经t检验,差异有统计学意义(半胱天冬酶-3:t=8.379、9.273和18.864,P=0.001、0.001和0.000;PARP剪切蛋白:t= 13.629、31.576和21.330,P=0.000),半胱天冬酶-3和PARP剪切蛋白水平升高。见图3。
2.4色胺酮降低TSLP上游信号通路中IL-7Rα和TSLPR mRNA水平
实时荧光定量PCR结果显示,TSLP刺激组与空白对照组mRNA水平比较,经t检验,差异有统计学意义(t=6.307和9.874,P=0.003和0.001),TSLP上游信号蛋白IL-7Rα和TSLPR mRNA水平在TSLP刺激后均升高;经0.1、1.0和10.0μmol色胺酮处理后,色胺酮处理组与TSLP刺激组mRNA水平比较,经t检验,差异有统计学意义(IL-7Rα:t=3.141、6.563和5.529,P=0.035、0.003和0.005;TSLPR mRNA:t= 2.948、8.017和7.626,P=0.042、0.001和0.002),两者mRNA水平均降低。见图4。

图3 HMC-1细胞中凋亡标志蛋白半胱天冬酶-3和PARP剪切蛋白在色胺酮的作用下表达升高

图4 色胺酮降低TSLP上游信号通路中IL-7Rα和TSLPR蛋白mRNA水平
3 讨论
肥大细胞与过敏性皮炎密切相关,在皮肤损伤部位,肥大细胞不断聚集,最终导致皮肤炎症[14-16];有报道称TSLP在过敏性皮炎患者皮肤损伤部位高度表达[17],近年来,更有研究发现,TSLP可调控肥大细胞增殖,加剧肥大细胞调节的疾病,如过敏性皮炎[8]。色胺酮具有潜在的抗过敏药效,因此,笔者对色胺酮在TSLP促肥大细胞增殖进程中发挥的药理机制进行探索,以期为色胺酮治疗过敏性皮炎提供理论依据。本研究结果证实,色胺酮可抑制TSLP促HMC-1肥大细胞的增殖,初步结果表明,色胺酮可通过抑制MDM2蛋白表达,提高P53蛋白水平,进而引起凋亡标志蛋白半胱天冬酶-3和PARP剪切蛋白水平升高,激活细胞凋亡;另外,通过对TSLP上游信号通路的检测发现,IL-7Rα和TSLPR mRNA水平在色胺酮的作用下降低。
BrdU是一种胸腺嘧啶的衍生物,在DNA合成S期,可代替胸腺嘧啶参与DNA新链合成,并稳定存在细胞核内,供于检测。本研究发现,色胺酮抑制BrdU嵌入TSLP刺激的肥大细胞。研究报道,Ki-67mRNA水平的检测可作为细胞增殖活性的一个标志[18],而笔者对Ki-67水平的检测同样证实色胺酮可抑制TSLP促肥大细胞增殖。
MDM2参与P53蛋白的降解,并在P53蛋白稳态中发挥关键作用[19]。相关研究结果证实,MDM2和P53通路调节细胞增殖和凋亡[20]。本实验结果显示,色胺酮抑制MDM2、P53蛋白水平升高,表明色胺酮在MDM2和P53通路中发挥作用。
半胱天冬酶在调控细胞凋亡进展中发挥关键作用[21],在细胞凋亡发生时,半胱天冬酶-3将113 kD的PARP蛋白分别剪切至89和24 kD片段大小[22],另外,半胱天冬酶-3和PARP剪切蛋白也被报道参与过敏反应[23-24];近年来,色胺酮被报道在白血病细胞中发挥抑制细胞增殖并引发细胞凋亡的作用[25]。本实验通过对半胱天冬酶-3和PARP剪切蛋白的表达水平检测发现,在HMC-1肥大细胞中,色胺酮处理后两者蛋白水平升高,提示色胺酮可加速在肥大细胞中的凋亡进展。
IL-7Rα和TSLPR在TSLP上游信号通路形成异质二聚体复合物,促使TSLP发挥作用[6],为进一步探索色胺酮在肥大细胞中的药理机制,笔者检测两者mRNA水平表达,实时荧光定量PCR结果显示,mRNA水平降低,提示色胺酮可抑制两者在转录水平上的表达。
值得注意的是,实验过程中0.1μmol色胺酮处理组与TSLP刺激组TSLPR mRNA水平比较,差异无统计学意义。其原因可能为:①实验操作误差;②低浓度色胺酮药力低效,提示在临床上对色胺酮的使用浓度需谨慎。
综上所述,本研究结果显示,在TSLP刺激的HMC-1肥大细胞中,色胺酮可抑制促细胞增殖作用,可能的机制是色胺酮通过调控MDM2和P53蛋白水平的表达,激活凋亡信号,加速细胞凋亡过程,抑制TSLP发挥的促进作用。另外,色胺酮也可抑制TSLP上游通路中IL-7Rα和TSLPR mRNA水平的表达。
[1]KIM J Y,JEONG MS,PARK MK,et al.Time-dependent progression from the acute to chronic phases in atopic dermatitis induced by epicutaneous allergen stimμLation in NC/Nga mice[J]. Experimental Dermatology,2014,23(1):53-57.
[2]CHURCH M K,LEVI-SCHAFFER F.The human mast cell[J]. Journal of Allergy and Clinical Immunology,1997,99(2):155-160.
[3]VOEHRINGER D.Protective and pathological roles of mast cells and basophils[J].Nature reviews Immunology,2013,13(5):362-375.
[4]LIU F T,GOODARZI H,CHEN H Y.IgE,mast cells,and eosinophils in atopic dermatitis[J].Clinical Reviews in Allergy Immunology,2011,41(3):298-310.
[5]DEMEHRI S,MORIMOTO M,HOLTZMAN MJ,et al.Skin-derived TSLP triggers progression from epidermal-barrier defects to asthma[J].PLoS Biology,2009,7(5):DOI:10.1371/journal.pbio. 1000067.
[6]LIU Y J.Thymic stromal lymphopoietin and OX40 ligand pathway in the initiation of dendritic cell-mediated allergic inflammation[J].The Journal of Allergy and Clinical Immunology,2007, 120(2):238-244.
[7]YOO J,OMORI M,GYARMATI D,et al.Spontaneous atopic dermatitis in mice expressing an inducible thymic stromal lymphopoietin transgene specifically in the skin[J].The Journal of Experimental Medicine,2005,202(4):541-549.
[8]HAN N R,OH H A,NAM S Y,et al.TSLP induces mast cell development and aggravates allergic reactions through the activation of MDM2 and STAT6[J].The Journal of Investigative Dermatology,2014,134(10):2521-2530.
[9]HAUPT Y,MAYA R,KAZAZ A,et al.Mdm2 promotes the rapid degradation of p53[J].Nature,1997,387(6630):296-299.
[10]ZHANG P,ELABD S,HAMMER S,et al.TRIM25 has a dual function in the p53/Mdm2 circuit[J].Oncogene,2015,34(46): 5729-5738.
[11]SCOVILL J,BLANK E,KONNICK M,et al.Antitrypanosomal activities of tryptanthrins[J].Antimicrobial Agents and Chemotherapy, 2002,46(3):882-883.
[12]RECIO MC,CERDA-NICOLAS M,POTTERAT O,et al.Anti-inflammatory and antiallergic activity in vivo of lipophilic Isatis tinctoria extracts and tryptanthrin[J].Planta Medica,2006, 72(6):539-546.
[13]IWAKI K,OHASHI E,ARAI N,et al.Tryptanthrin inhibits Th2 development,and IgE-mediated degranμLation and IL-4 production by rat basophilic leukemia RBL-2H3 cells[J].Journal of Ethnopharmacology,2011,134(2):450-459.
[14]HORSMANHEIMO L,HARVIMA I T,JARVIKALLIO A,et al. Mast cells are one major source of interleukin-4 in atopic dermatitis[J].The British Journal of Dermatology,1994,131(3): 348-353.
[15]SUGIURA H,UEHARA M.Mitosis of mast cells in skin lesions of atopic dermatitis[J].Acta Dermato-venereologica,1993, 73(4):296-299.
[16]KAWAKAMI T,ANDO T,KIMURA M,et al.Mast cells in atopic dermatitis[J].Current Opinion in Immunology,2009,21(6): 666-678.
[17]SOUMELIS V,RECHE P A,KANZLER H,et al.Human epithelial cells trigger dendritic cell mediated allergic inflammation by producing TSLP[J].Nature Immunology,2002,3(7):673-680.
[18]KEE N,SIVALINGAM S,BOONSTRA R,et al.The utility of Ki-67 and BrdU as proliferative markers of adμLt neurogenesis[J].Journal of Neuroscience Methods,2002,115(1):97-105.
[19]CHAO C C.Mechanisms of p53 degradation[J].Clinica Chimica Acta,2015,438:139-147.
[20]WANG Z,LI B.MDM2 links genotoxic stress and metabolism to p53[J].Protein Cell,2010,1(12):1063-1072.
[21]COHEN G M.Caspases:the executioners of apoptosis[J].The Biochemical Journal,1997,326(1):1-16.
[22]LAZEBNIK Y A,KAUFMANN S H,DESNOYERS S,et al. Cleavage of poly(ADP-ribose)polymerase by a proteinase with properties like ICE[J].Nature,1994,371(6495):346-347.
[23]GAO Z,MA Y,ZHAO D,et al.Neochromine S5 improves contact hypersensitivity through a selective effect on activated T lymphocytes[J].Biochemical Pharmacology,2014,92(2):358-368.
[24]FANG F,TANG Y,GAO Z,et al.A novel regulatory mechanism of naringenin through inhibition of T lymphocyte function in contact hypersensitivity suppression[J].Biochemical and Biophysical Research Communications,2010,397(2):163-169.
[25]MIAO S,SHI X,ZHANG H,et al.Proliferation-attenuating and apoptosis-inducing effects oftryptanthrin on human chronic myeloid leukemia K562 cell line in vitro[J].International Journal of Molecular Sciences,2011,12(6):3831-3845.
(张蕾编辑)
Pharmacological mechanism of tryptanthrin inhibition of mast cell proliferation promoted by thymic stromal lymphopoietin*
Fu-yin Wang1,Qian Du1,Li-juan Kong1,Chun-hong Cheng1,Lei Wang2
(1.Department of Pharmacy,Longnan Hospital,Daqing,Heilongjiang 163453,China;2.Hebei Medical University,Shijiazhuang,Hebei 050017,China)
Objective To investigate the pharmacological mechanism of tryptanthrin(TR)in suppressing mast cell proliferation promoted by thymic stromal lymphopoietin(TSLP),so as to provide academic evidence for mast cell induced allergic dermatitis(AD)therapy through TR.Methods After HMC-1 cells were stimulated by TSLP,cell proliferation was observed with another treatment of TR,and the relative protein levels were detected as well.The cells were divided into four groups:blank control,TSLP stimulating,TR treating and TSLP combined with TR groups.Cell viability was tested by MTT assay with various concentrations of TR.Cell proliferation effect was verified through BrdU assay and Ki67 mRNA level detection.MDM2,p53,cleaved caspase-3 and cleaved poly-ADP-ribose polymerase(PARP)protein levels were measured by Western blot.IL-7Ra and TSLPR mRNA levels were detected by real-time fluorescent quantitative PCR.Results MTT assay showed TR had no cytotoxicity.BrdU and Ki67 assay indicated that TR evidently suppressed mast cell proliferation promoted by TSLP.After TR treatment,MDM2 protein level decreased in HMC-1 cells and the difference had statistical significance;on the contrary,p53,cleaved caspase and cleaved PARP protein levels significantly elevated.The upstream regulatory protein IL-7Ra and TSLPR mRNA levels were inhibited obviously with TR treatment.Conclusions TR could suppress mast cell proliferation promoted by TSLP,and exhibits certain potential in AD therapy.
tryptanthrin;thymic stromal lymphopoietin;human mast cell line-1 cell;caspase-3;cleavage of poly-ADP-ribose polymerase
R 965
A
10.3969/j.issn.1005-8982.2016.18.003
1005-8982(2016)18-0011-07
2016-04-13
国家自然青年科学基金(No:81202401)

