cGMP和Ca2+通过提升PM H+-ATPase活性降低Na+/K+比维持苔草愈伤组织离子稳态
贾红磊, 马佩云
(陕西科技大学 环境科学与工程学院, 陕西 西安 710021)
0 引言
在世界许多地区,土壤盐分过高一直是农业生产的主要制约因素,目前土壤盐碱化和次生盐碱化问题在世界范围内广泛存在,已经成为影响植物生长发育的重要环境因素[1].当植物暴露于NaCl中时,细胞离子稳态可能会受到损害.越来越多的证据表明,耐盐植物在高盐条件下细胞胞浆中通常保持高钾(K+)和低钠(Na+)[2].植物细胞离子稳态调节过程是由多个运输系统介导的,如H+-ATPase、载体(转运蛋白和逆向转运蛋白)及与质膜(PM)和液泡膜相关的通道[3].
从细胞质和液泡中有效地排除过量的Na+是植物适应盐胁迫的主要机制[4].作为一种初级转运体,PM H+-ATPase介导ATP依赖的H+进入细胞外间隙,从而在PM之间产生pH和电位差[5].对PM H+-ATPase活性的调控可能是提升植物耐盐性的重要调控机制.
环鸟苷酸(cGMP)是一种重要的第二信使分子,通过直接的上下游效应调节复杂的信号传递[6].研究报道cGMP在叶绿体发育、大麦α淀粉酶诱导和盐胁迫下维持细胞离子平衡中的作用[7].cGMP在生物、非生物胁迫及传递植物激素信号响应植物生理过程起着非常重要的作用[8].
钙离子(Ca2+)是动物和植物中的关键第二信使分子[9].在植物中,Ca2+瞬变介导了对环境胁迫的反应,包括盐、干旱、寒冷等[10].Ca2+信号赋予酶活性、细胞结构和基因表达的变化,这些变化共同使植物能够应对不断变化的环境[11].Ca2+还涉及各种信使分子,如环鸟苷酸(cGMP)、(过氧化氢)H2O2等.McAinsh等[12]发现,外源性H2O2诱导了保卫细胞内Ca2+的升高,且cGMP水平与Ca2+水平同步增加,它们协同又独立地发挥作用[13].
苔属植物是被子植物中最大的属之一,在世界范围内有2 000多种[14],多分布在湿地、北极和高山植被Carexmoorcroftii是一种生长在中国西北部高海拔地区的植物.它在稳定沙丘和为中国西北部的动物提供食物方面也起着非常重要的作用.沙生型(DC)生长在含有一定量的石膏、碳酸钙和盐的土壤中.因此,DC具有极强的抗旱性和较强的耐盐性[4].因此,选取它为研究植物适应各种环境条件的理想材料,将另一种全年生长在湿地水生型(SC)作为对照进行研究,探索信号分子cGMP和Ca2+参与维持盐胁迫下C.moorcroftii愈伤组织细胞内离子稳态的作用,使人们对耐盐植物有更深一步的了解,从而采取相应的策略去利用它们改良盐碱地以及创造良好的经济效益和社会效益,并为在盐碱地苔属植物的种植以及耐盐生理机制的研究提供一定的科学依据.
1 材料与方法
1.1 材料及培养
两种生态型C.morcroftii植物种子从中国青海省唐古拉县获得 (34 °16′04″N,92 °29′47″E),愈伤组织从成熟的种子中获得.愈伤组织在湿度为70%和光周期为16 h、温度保持在24 ℃的培养箱中培养4个月.称取0.50±0.05 g的愈伤组织置于30 mL的MS固体培养基上进行培养22天后,对愈伤组织进行不同处理.
首先,采用0、100 mM、200 mM、300 mM的NaCl处理愈伤组织24 h,对不同处理下的离子渗透率、相对含水量及Na+、K+含量进行测定,确定合适浓度的NaCl进行后续实验.其次采用既定NaCl浓度与0.5μM、5μM、50μM、100μM的8-Br-cGMP处理愈伤组织,测定Na+、K+含量,以确定最佳8-Br-cGMP的浓度.
然后,采用确定浓度的8-Br-cGMP、cGMP抑制剂(50μM Ly83583)、Ca2+螯合剂(10 mM EGTA)处理6 h后,测定愈伤组织中Na+、K+含量、cGMP合成量以及PM H+ATPase活性来探究cGMP及Ca2+在调节盐胁迫中细胞内离子稳态方面的生理作用.
1.2 实验方法
1.2.1 离子渗透率测定
采用Sairam等[15]的方法测定离子渗透率.用去离子水收集和洗涤愈伤组织三次,以去除表面粘附的电解质.然后将洗涤后的样品放置在试管中,在25 ℃下浸入10 mL去离子水中3 h.孵育后,测定浸泡液的电导率(C1),并测定去离子水的电导率(C0).之后,在沸水中加热1 h,根据公式(1)测定浸泡液的电导率(C2),相对离子渗透率以电导率的百分比表示.
EL=(C1-C0)/(C2-C0)×100%
(1)
1.2.2 相对含水量(RWC)测定
称取新鲜愈伤组织的鲜重(FW),在80 ℃下加热48 h之后称其干重(DW),根据公式(2)测定相对含水量.
RWC=(FW-DW)/FW×100%
(2)
1.2.3 Na+、K+含量测定
元素比测量使用安装Kevex能量色散X射线探测器的扫描电子显微镜(菲利普斯电子公司,埃因达伦,荷兰)采用X射线显微分析方法测定Na+及K+含量.愈伤组织用去离子水冲洗5次,然后在50 ℃下干燥48 h.将干燥的愈伤组织用研钵粉碎,每个样本至少检测三个点,测定组织中Na+、K+的含量,Na+、K+的含量以Na+、K+的原子序数百分比表示.
1.2.4 cGMP提取及测定
样品收集后迅速冷冻在液氮中.在冷冻组织中加入5倍体积0.1 M HCl.样品在冰上用多管型匀浆器将其研磨至匀浆,在4 000 g下离心5 min,收集上清液进行分析.用cGMP免疫分析试剂盒(Bio Vision,USA)测定cGMP含量.
1.2.5 PM H+-ATPase活性测定
采用Yang等[16]描述的方法提取PM.质膜蛋白用于PM H+-ATPase活性的测定.测定PM H+-ATPase的活性.
1.2.6 蛋白印迹分析
根据Laemmli[17]描述的方法采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)进行蛋白印迹分析.在含6 M尿素的11.5% (w/v)丙烯酰胺凝胶上负载和分离约50 mg总蛋白.电泳后分离的蛋白质被转移到聚乙烯膜上.用5%脱脂牛奶在0.5% (w/v) Tween 20、10 mM Tris-HCl (pH=8.0)和150 mM NaCl封闭90 min.加入PM Na+/H+逆向转运蛋白抗体孵育过夜.洗涤后,加入碱性磷酸酶偶联的第二抗体,孵育2 h,按照说明书进行测定.以牛血清白蛋白为标准用Bradford法[18]测定蛋白质含量.
1.3 数据分析
本实验所有指标都重复测定三次,采用Origin 8.0软件进行数据作图,数据采用单因素方差分析,平均值采用SPSS统计软件17.0进行Tukey检验.图中不同字母代表平均值在p<0.05水平有统计学差异.
2 结果与讨论
2.1 NaCl对离子渗透率(EL)、相对含水量(RWC)的影响
由于离子渗透率(EL)和相对含水量(RWC)被认为是应激诱导细胞损伤的良好指标.因此,在盐胁迫下,测定了水生型(SC)、沙生型(DC)愈伤组织中的EL和RWC.如图1(a)所示,在100 mM及200 mM NaCl处理下,EL与未处理的DC愈伤组织无显著性差异,而SC愈伤组织则分别增加了83.7%和122.3%.在较高NaCl浓度(300 mM)处理下,DC愈伤组织EL增加97.8%,SC愈伤组织增加133.4%.如图1(b)所示,在100 mM至300 mM NaCl浓度处理中,SC和DC愈伤组织中的RWC分别下降了11.6%~15.7%和6.5%~11.9%.试验结果表明,DC愈伤组织在低浓度NaCl处理下比SC愈伤组织的耐受性强.
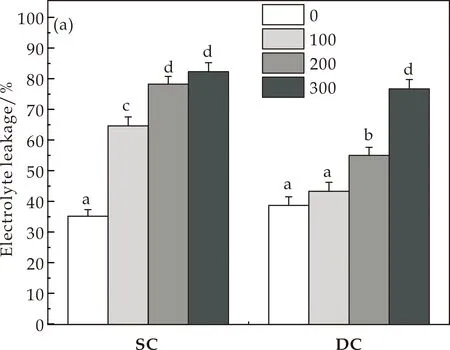
(a)离子渗透率(EL)

(b)相对含水量(RWC)图1 NaCl对DC及SC离子渗透率、相对含水率的影响
2.2 NaCl提高愈伤组织中Na+/K+比值
细胞内离子平衡与植物对盐胁迫的适应密切相关.控制净Na+流入并保持细胞质中较低的Na+/K+比对植物盐耐受性提升具有重要意义[19].在100 mM与200 mM NaCl处理时,SC愈伤组织Na+百分比分别显著性增加104.2%和192%,K+百分比下降15.6%和31.1%,导致SC愈伤组织Na+/K+比急剧增加,而在DC愈伤组织中Na+/K+比无显著性变化(图2(a)~(c)).当采用300 mM NaCl处理时,SC和DC愈伤组织Na+/K+比均明显增加(图2(c)).唐晓倩等[20]研究发现,低浓度NaCl处理下,西伯利亚白刺可以通过增加根系离子含量提高根系渗透势差来适应盐胁迫,与本研究结果一致.
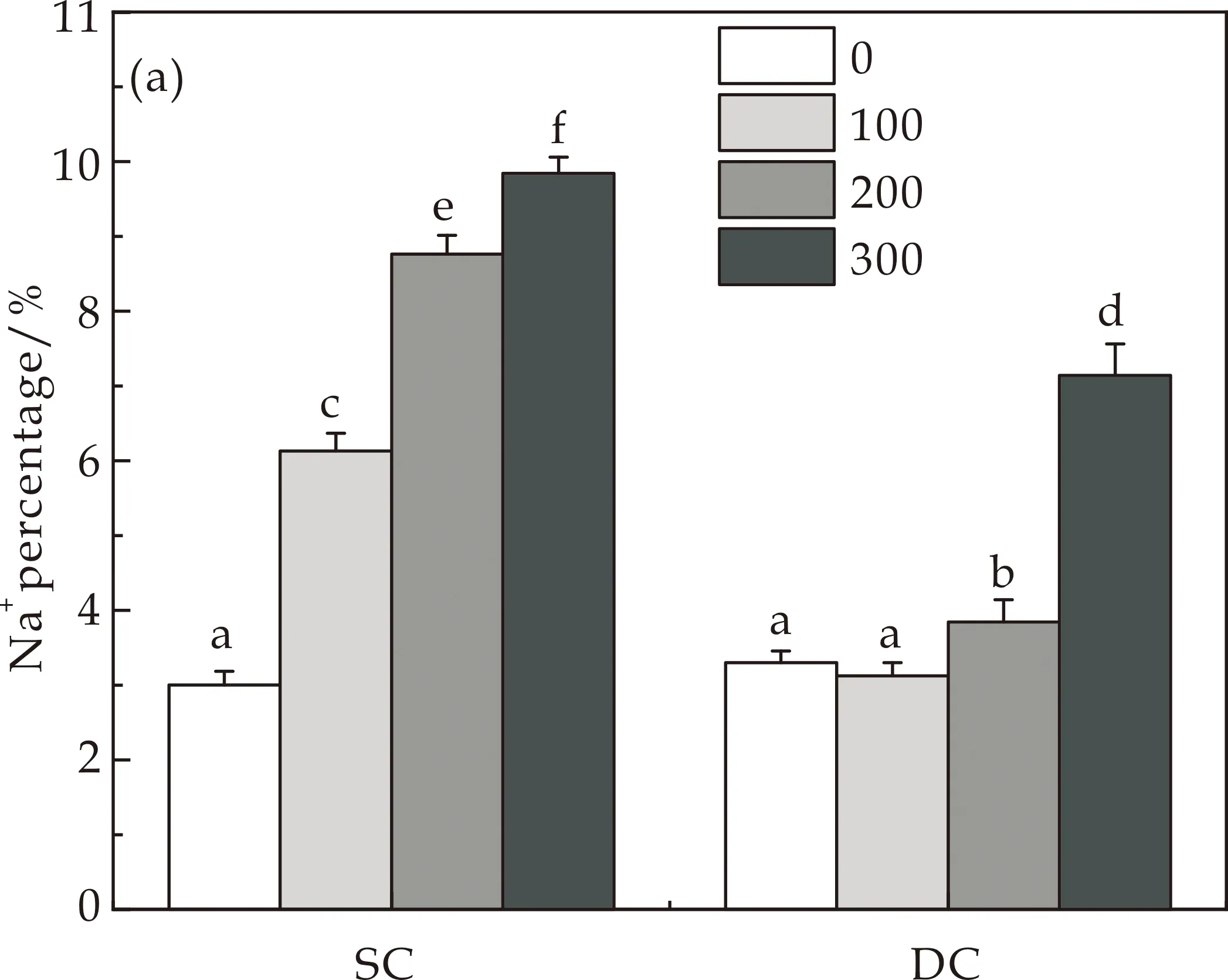
(a)Na+含量

(b)K+含量

(c)Na+/K+图2 NaCl对DC和SC愈伤组织元素比的影响
以上实验结果表明,与SC愈伤组织相比,100 mM及200 mM NaCl处理下DC愈伤组织的EL、RWC和Na+/K+比略有变化,说明DC愈伤组织比SC愈伤组织具有更强的耐盐性.因此,本研究旨在了解DC愈伤组织耐盐性的原因.综合考虑,本研究采用100 mM NaCl处理进行后续实验.
2.3 盐胁迫下cGMP和EGTA对Na+/K+比的影响
cGMP被认为是第二个抗环境胁迫的信使分子[21],本文研究了8-Br-cGMP(cGMP类似物)对盐胁迫下DC和SC愈伤组织元素比的影响.在DC和SC愈伤组织中,8-Br-cGMP处理可降低Na+百分比和Na+/K+比率,在盐胁迫条件和对照条件下增加K+百分比.用50μM 8-Br-cGMP处理,Na+百分比达到最小值(SC愈伤组织中是对照组的108%,DC愈伤组织是对照组的55.5%),K+百分比达到最大值(SC愈伤组织中是对照的106%,DC愈伤组织中是对照的126%),从而在盐胁迫下产生最小的Na+/K+比(图3(a)~(c)).说明50μM 8-Br-cGMP能够显著降低Na+含量以及Na+/K+比.Li等[22]在拟南芥根系中也发现cGMP能够维持较低的Na+/K+比缓解盐胁迫造成的损伤.从细胞质中有效地排除多余的Na+植物适应盐胁迫的主要机制[23].基于以上结果,在后续实验中使用50μM 8-Br-cGMP.

(a)Na+含量

(b)K+含量
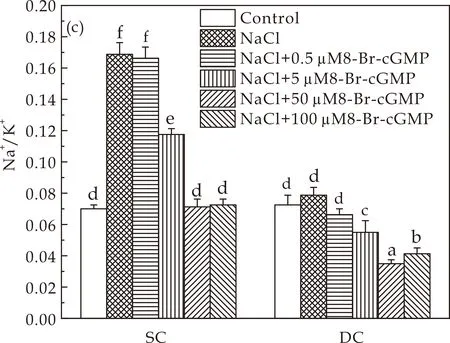
(c)Na+/K+图3 8-Br-cGMP对盐胁迫下DC和SC愈伤组织中元素比的影响
作为一种信号分子,cGMP在胁迫条件下参与了许多非生物胁迫反应,产生cGMP来激活植物的抗性机制[24].Ca2+作为上游或下游成分参与植物抗性防御和许多信号分子功能[25].外源Ca2+的应用已被证明能显著缓解盐胁迫对许多物种造成的危害[26].为了阐明cGMP及Ca2+在耐盐植物的作用,本研究采用Ly83583(cGMP抑制剂)及EGTA(Ca2+螯合剂)两种试剂对愈伤组织中Na+/K+比率进行测定.如图4所示,Ly83583可显著提高Na+百分比,降低K+百分比,从而使DC和SC愈伤组织在盐胁迫下的Na+/K+比急剧增加.此外还发现,EGTA处理可以消除8-Br-cGMP对DC和SC愈伤组织盐胁迫下元素比的影响(图4(c)).基于以上结果,本研究得出结论,cGMP的产生是通过影响DC愈伤组织的元素比来提高盐耐受性.相反,在耐盐性较差的SC愈伤组织中,Na+不能从植物细胞中排出,离子稳态性能较弱.
2.4 DC和SC愈伤组织中内源cGMP的含量
采用不同处理方法,在DC和SC愈伤组织中检测内源性cGMP(环鸟苷酸)含量.由图5可知,应用8-Br-cGMP可显著提高内源cGMP含量 (SC愈伤组织中是对照的213%,DC愈伤组织中是对照的239%).盐胁迫下DC愈伤组织的内源cGMP含量增加了64.1%,而SC愈伤组织的内源cGMP含量下降了32.5%.在DC愈伤组织中8-Br-cGMP+NaCl处理增强了NaCl对内源cGMP含量的影响,但消除了NaCl对SC愈伤组织内源性cGMP含量的影响.相反,Ly83583+NaCl处理降低了DC和SC愈伤组织的内源cGMP含量.
南文斌[27]研究发现,Ly83583也显著性降低拟南芥根部内源cGMP含量,影响了根系生长发育.说明内源cGMP的合成对植物生长至关重要.然而,在100 mM NaCl处理下,EGTA处理并未改变内源cGMP水平.因此,本研究认为NaCl胁迫下C.morcroftii愈伤组织中Ca2+可能作为下游信号被cGMP激活.

(a)Na+含量
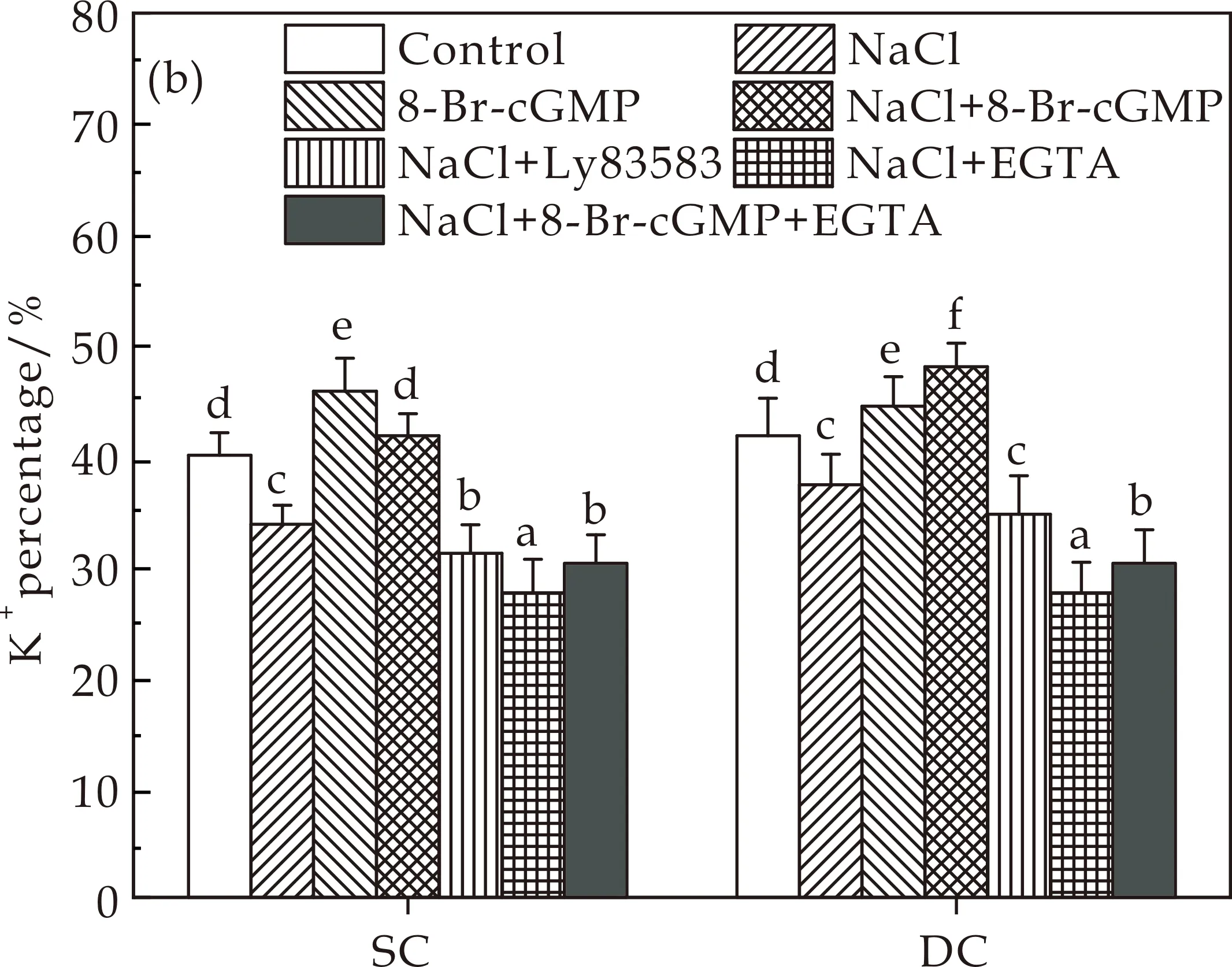
(b)K+含量
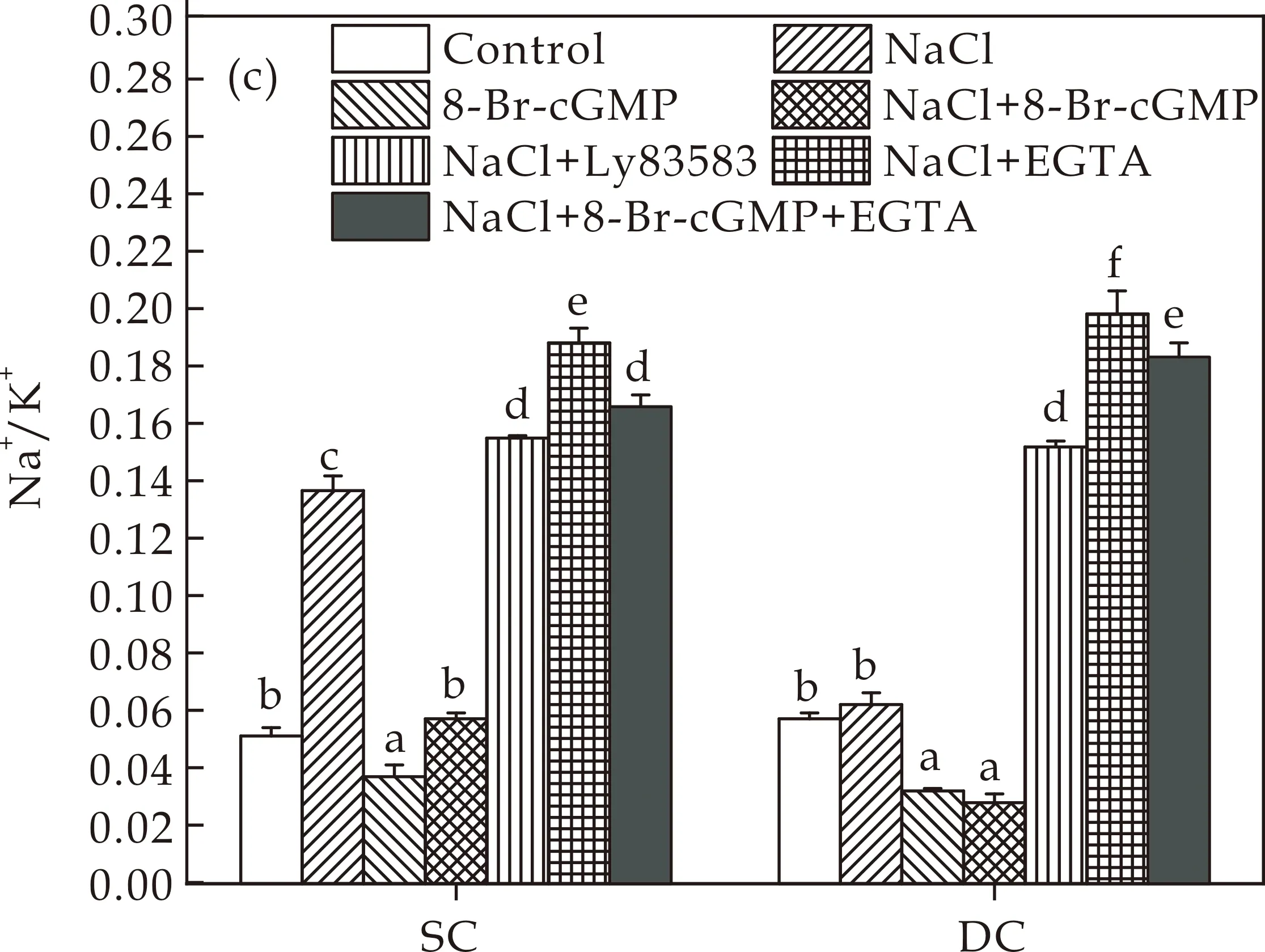
(c)Na+/K+图4 8-Br-cGMP、Ly83583和EGTA对DC和SC愈伤组织盐胁迫下元素比的影响

图5 DC及SC愈伤组织内源cGMP的含量
2.5 cGMP诱导DC和SC愈伤组织中PM H+- ATPase的活性
本研究发现8-Br-cGMP在盐胁迫下能够影响元素比率(图3),但是否会影响PM H+-ATPase活性尚不清楚.因此,本文研究了8-Br-cGMP在盐胁迫下对PM H+-ATPase活性的影响.如图6所示,在DC愈伤组织中,PM H+-ATPase的活性提高了104.7%,相反,在100 mM NaCl处理时,SC愈伤组织中PM H+-ATPase活性降低了32.4%.在盐胁迫下,8-Br-cGMP处理可使SC和DC愈伤组织中PM H+-ATPase的活性分别提高82.1%和136.5%.然而,Ly83583使SC和DC愈伤组织中PM H+-ATPase的活性分别降低了25.8%和16.7%.研究还发现,在DC和SC愈伤组织中,EGTA显著性降低盐胁迫下8-Br-cGMP诱导的PM H+-ATPase活性,说明Ca2+在诱导cGMP提高PM H+-ATPase的活性中很关键,且是不可或缺的.Li等[24]研究发现Ca2+能够参与cGMP介导的信号通路,从而刺激PM H+-ATPase基因表达.以上研究结果表明,cGMP和Ca2+在调节DC和SC愈伤组织PM H+-ATPase的活性中起着至关重要的作用.

图6 8-Br-cGMP、Ly83583和EGTA对盐胁迫下DC及SC愈伤组织中PM H+-ATPase活性的影响
3 结论
本研究数据表明,cGMP(环鸟甘酸)和Ca2+能够响应沙生型(DC)愈伤组织耐盐性的信号网络,并协同调节Na+/K+比率维持离子稳态及PM H+ATPase活性;在此过程中,Ca2+作为cGMP的下游信号调节PM H+-ATPase活性,为离子跨膜运输提供驱动力,最终提高C.Moorcroftii愈伤组织耐盐性;Ca2+在cGMP介导的信号通路中也是一种不可或缺的的物质.
本研究为在盐碱地苔属植物的种植以及耐盐生理机制的研究提供一定的科学依据,并期望能够采取相应的策略去利用它们改良盐碱地以及创造良好的经济效益和社会效益.

