成人Still病合并巨噬细胞活化综合征致急性肝衰竭行肝移植1例报告
马海英, 刘 彦, 李志琴, 王 虎, 张灵强, 陈 虹, 樊海宁
1 青海大学附属医院 a. 肝胆胰外科; b.科研管理部, 西宁 810001; 2 北京清华长庚医院 肝胆胰中心, 北京 102218;3 青海省卫生健康委员会, 西宁 810001
1 病例资料
患者女性,30 岁,因“体检发现肝功能异常3周,皮肤巩膜黄染2周,意识障碍1 d”由北京地坛医院转入北京清华长庚医院就诊。患者于入院3周前体检时发现ALT、AST升高,后无明显诱因出现皮肤及巩膜黄染,伴发热、尿色加深,最高体温可达40 ℃,至北京大学第三医院就诊,查肝功能:ALT 2933 U/L,AST 2904 U/L,TBil 72 μmol/L,DBil 53 μmol/L,血清铁蛋白(SF)>10 500 μg/L。腹部超声示:肝脏形态正常,未见胆管扩张,胆囊异常回声。予以保肝等对症治疗。入院10 d前就诊于北京地坛医院,查肝功能:ALT 3163 U/L,AST 2939 U/L,TBil 215 μmol/L,DBil 164 μmol/L;凝血功能:PTA 55%, PT 15.3 s, APTT 35.9 s;HBV阴性,HCV阴性。给予患者保肝及地塞米松(10 mg,每日1次,静注7 d),症状缓解不明显,病情进行性加重,于入院前1天下午,患者出现意识不清,呈中昏迷状态,为求进一步诊治来本院就诊,以 “急性肝衰竭、肝性脑病”收入院。
既往史:患者3年前因“发热”就诊于北京协和医院,白细胞计数最高12×109/L,SF最高609 μg/L,存在网状青斑皮疹,诊断为“成人 Still 病(adult-onset Still’s disease,AOSD)”,给予激素及免疫抑制剂治疗,坚持服药控制病情。病情稳定后因备孕于1年半前经门诊复查后停用甲氨蝶呤,于1年前停用咪唑硫嘌呤,3个多月前自行停用激素等所有药物。既往无饮酒史。
查体:体温36.5 ℃,心率52次/min,呼吸15次/min,血压128/60 mm Hg,血氧饱和度 100%,吸入氧浓度 40%。患者呈中昏迷状态。Glassow评分5分E1V1M3。双侧瞳孔直径3 mm,对光反射灵敏。左侧Babinski征阳性。皮肤、巩膜黄染,左前臂及右前臂可见片状瘀斑青紫,全身浅表淋巴结未触及。双肺呼吸音粗,未闻及湿啰音。心律齐,各瓣膜听诊区未及心脏杂音。腹平软,无压痛,肝脾未触及,胆囊未触及;腹部叩诊鼓音;肠鸣音3~4次/min。双下肢不肿。
辅助检查: EB病毒DNA<4.00×102拷贝/ml。巨细胞病毒阴性。抗核抗体、抗可溶性抗原谱、抗磷脂抗体、自身免疫性肝病抗体、抗中性粒细胞胞浆抗体、抗双链DNA抗体均阴性(部分检验结果见表1)。胸腹 CT: 双侧胸腔少量积液,肝脏各叶比例略欠协调,肝门肝裂增宽,肝实质密度略欠均匀,少量腹水。头颅CT:脑组织肿胀,脑水肿。
入院后给予保肝、抑酸,输注血浆、纤维蛋白原、白蛋白,血浆置换、降血氨、激素等治疗,患者昏迷症状无好转,于入院后第2天行气管插管呼吸机辅助通气。考虑急性肝衰竭及肝性脑病加重,脑组织水肿明显,故在保肝、降颅内压治疗同时,于入院后第4天在全麻下行“原位肝移植术”。供体资料: 男性,36 岁,脑死亡患者,既往无肝炎,术前肝、肾功能正常。供肝重 2380 g,供肝快速病理:轻度大-小泡混合性脂肪变,部分肝细胞内可见淤胆,并可见小胆管内胆栓形成,汇管区纤维组织轻度增生,散在及灶状淋巴细胞浸润。术中见患肝萎缩、黄染、质软、明显坏死变性。术中无肝期50 min。供肝冷缺血时间3 h 50 min,热缺血时间1 min。术中出血600 ml,尿量 1790 ml,输红细胞 4 U,血浆400 ml。术后病理: (病肝)坏死肝细胞周围大量组织细胞浸润,组织细胞胞浆内可见吞噬的红细胞、白细胞碎片。结合病史,病变符合巨噬细胞活化综合征(macrophage activation syndrome,MAS) 。免疫组化:CD4淋巴细胞(+)、CD8淋巴细胞(+)、CD68组织细胞(+)。特殊染色:PAS(-)、D-PAS(-)。
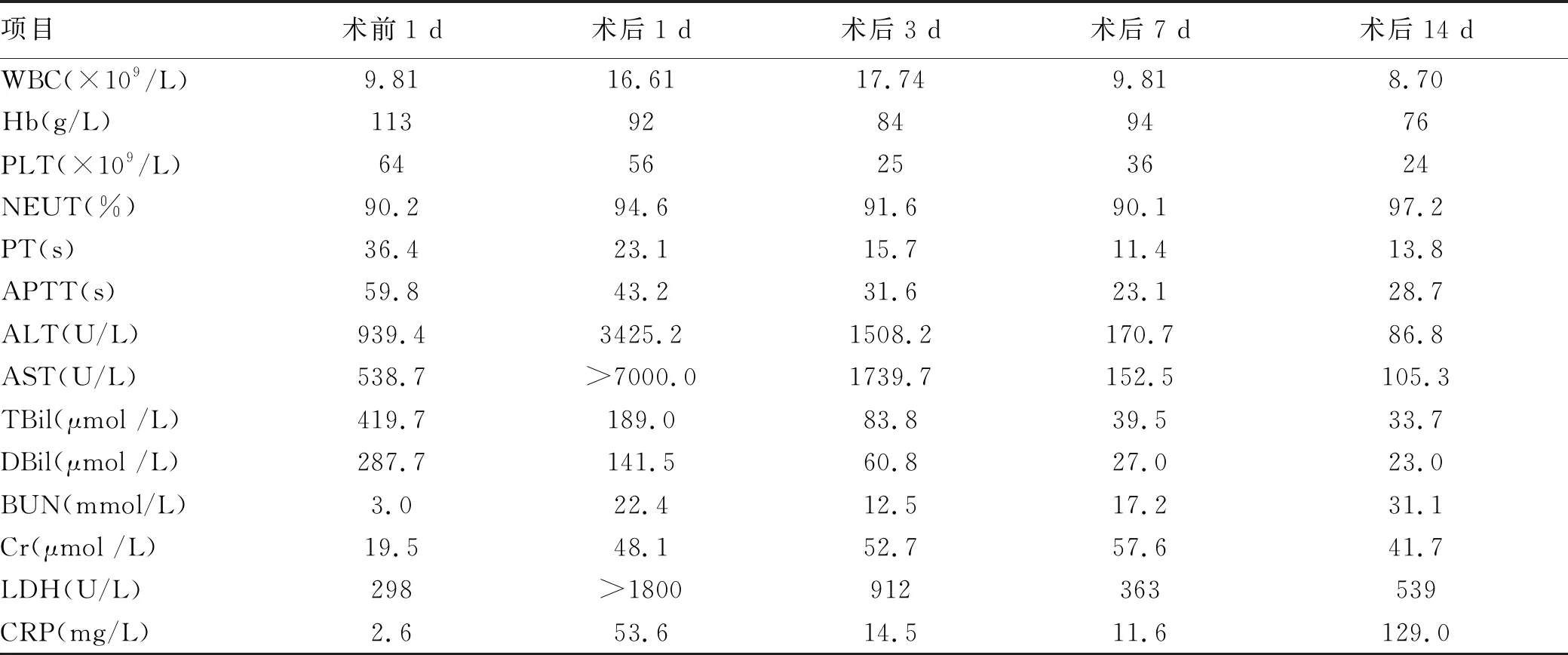
表1 患者肝移植术前、术后部分检验结果
肝移植术后1 d复查腹部CT提示:移植肝内低强化灶,考虑缺血可能。患者肝功能异常,予以对症输注血制品,并行多次血浆置换治疗,后肝功能明显好转。术后患者出现急性肾损伤,间断行床旁血滤治疗后好转,尿量及肾功能恢复正常。患者因肝衰竭导致脑水肿,术后脑水肿减轻,术后Glassow评分E4V2M1,可自主睁眼,偶有追视,不能遵嘱。患者术后出现SF(>40 000 μg/L)、LDH和CRP升高。给予甲强龙5 mg,每6小时给药1次×1 d→40 mg每6小时给药1次×1 d→30 mg每6小时给药1次×7 d→80 mg每日1次×3 d→40 mg每日1次×7 d治疗。免疫抑制剂的使用:术后第2天开始,给予他克莫司1.5 mg,每12小时给药1次;骁悉0.5 mg,每12小时给药1次。术后9 d全院会诊后将免疫抑制剂更换为环孢素100 mg,每12小时给药1次,术后24 d加量至150 mg,每12小时给药1次。术后17~22 d予丙种球蛋白治疗。术后文氏孔及肝门引流管尖端细菌培养示:鲍曼不动杆菌(CR-AB);菌量:大量。抗感染方案调整为:利奈唑胺0.6 g,每12小时给药1次+头孢哌酮舒巴坦3 g,每12小时给药1次+替加环素100 mg ,每12小时给药1次+卡泊芬净50 mg,每日1次。
术后20 d,患者腹部切口感染,给予清创缝合。腹腔积液行腹穿放腹水,并留取标本送检。继续抗感染治疗,检测炎症指标变化。继续环孢素150 mg ,每12小时给药1次+吗替麦考酚酯0.5 g,每12小时给药1次抗排斥治疗,甲强龙40 mg,每日1次满1周后改为20 mg,每日1次。复查头MRI可见双侧颞叶肿胀,右侧颞极右侧岛叶明显,双侧额叶皮层可见长T2信号,神经内科建议脱水降颅压,考虑患者暂无脑水肿体征,结合其肾功能,暂根据其出入量变化予以利尿治疗。患者无自主活动,为预防废用性肌肉萎缩,请康复科指导康复治疗。
术后1个月,患者出现消化道出血症状,考虑应激性溃疡及激素副作用可能性大。经凝血酶冻干粉鼻饲、碳酸氢钠冲洗、奥美拉唑泵入及输注红细胞后,患者消化道出血症状好转。完善骨髓穿刺,骨髓细胞形态学报告:增生活跃,粒∶红=2.98∶1,粒系中、晚幼粒细胞比例升高,部分可见胞浆颗粒粗大,余各阶段比例及形态大致正常,红系各阶段比例及形态大致正常,红细胞部分中心淡染区扩大,淋巴细胞及单核细胞比例形态正常。可见吞噬细胞及吞噬血细胞现象。巨核细胞不少,PLT轻度减少,未见其他异常细胞及寄生虫。
术后4个月余,患者腹部切口有新鲜肉芽生长,意识有一定的恢复,认识亲人和熟人,问答基本切题,能自行吃饭,双上肢肌力正常,活动可,双下肢肌力1~2级。后患者无明显诱因突然出现右上肢不能活动,并伴有发热,最高体温可达39.3 ℃,行头颅CT及MR提示:颅内有直径约3 cm的疑似感染病灶。行腰椎穿刺并送脑脊液病原生物学检测提示:曲霉菌感染。结合术后长期口服免疫抑制剂和使用激素类药物病史及症状体征、影像学检查、脑脊液检测结果,考虑颅内真菌感染。患者尿培养提示大肠埃希菌感染,结合术后长期留置导尿管病史,考虑泌尿系统存在逆行感染。给予卡泊芬净及万古霉素抗感染治疗。后患者家属要求自动出院,嘱院外继续口服环孢素及他克莫司免疫抑制治疗,继续切口换药及抗感染治疗。
2 讨论
AOSD是一组病因不明的临床综合征,以高热、一过性皮疹、关节痛、关节炎、咽痛和WBC明显增高为临床特征,常伴有肝、脾、淋巴结肿大。目前研究[1]发现单核-巨噬细胞活化是AOSD发病的重要环节,活化的单核-巨噬细胞生成大量的细胞因子,参与疾病的发生、发展。AOSD患者可出现肝肿大和肝酶升高[2],致重度肝损伤甚至急性肝衰竭也有报道。发生 AOSD 致肝衰竭患者常有长期大量服用非甾体抗炎药等药物病史,本病例服用激素及免疫抑制剂3年余后停药,故药物性因素及停药反应在本例AOSD 致急性肝衰竭中有不可忽视的影响。
MAS或嗜血细胞综合征 (hemophagocytic lymphohistiocytosis,HLH)是一种与多器官系统功能障碍相关的细胞因子炎症风暴综合征。AOSD 出现持续高热、血细胞减少、血沉和纤维蛋白原降低时需考虑并发 MAS[3-4]。有研究[5]指出成人HLH可检测到相关的基因变异。本例患者完善嗜血基因检测结果:检出ITKp.R581W变异,为杂合变异,该变异在HLH患者中检出;该患者还检出LYSTp.D2665G变异及TCN2p.I142V变异,均为杂合变异。外送标本检测:血浆ADAMTS13 抑制物阴性,自然杀伤细胞活性16.65%,sCD25:41 608 pg/ml(正常参考值:<6400 pg/ml)。关于成人 HLH 的诊断,本例患者符合发热、血细胞减少、嗜血现象、自然杀伤细胞活性降低、高铁蛋白血症 5 条,考虑诊断为HLH。本例患者发病后未及时行常规化疗,仅使用激素类药物治疗,病情发展迅速,导致急性肝衰竭。
早期识别MAS是改善患者预后的关键之一。对于不明原因急性肝功能异常伴发热的患者,应及时行HLH相关检查。有助于早期识别的临床表现有:发热热型的改变,由间歇发热变为持续发热,肝脾淋巴结肿大及中枢神经系统功能障碍等;还包括血常规的改变,SF增高,肝功能出现异常等[6],对于疾病的早期诊断也有重要意义。AOSD患者需早期规范治疗。AOSD的治疗通常选择糖皮质激素、非甾体抗炎药及改善病情抗风湿药。在上述药物不能控制病情时,也可选择生物制剂,如IL-1阻断剂等[7-9]。另外,中医治疗也可尝试。
HLH可累及多器官,易引起多器官功能衰竭。急性肝衰竭是一种进展迅速、预后极差的临床危重症,内科治疗生存率低,肝移植手术可提高短期生存率[10-11]。本例患者术前虽已出现脑水肿症状,但尚未形成脑疝,不存在明显的肝移植禁忌。通过本病例,作者认为对于合并自身免疫因素导致肝损伤者引起的急性肝衰竭,也可作为肝移植的相对适应证,行肝移植手术。
作者贡献声明:马海英、刘彦直接参与了起草文章,论文撰写;陈虹、张灵强对文章中知识性的内容给予指导和帮助;樊海宁指导撰写文章并最后定稿;李志琴、王虎主要对文章提供行政支持,包括科研基金经费等支持。

