基于四氧化三铁磁性纳米材料检测油炸食品中特丁基对苯二酚的研究
(.黄河水利职业技术学院环境工程学院,河南开封475000;.河南大学化学化工学院,河南开封475000)
特丁基对苯二酚(tert-butylhydroquinone,TBHQ)作为一种新合成的抗氧化剂,由于具有稳定性好、耐高温、低毒、抑菌等作用,在工业生产中具有广泛的应用[1-3]。但研究发现:TBHQ过量使用或使用不当时会对人的身体健康造成严重影响,因此我国对TBHQ的使用有着严格的监管。GB2760-2014《食品安全国家标准食品添加剂使用标准》规定:TBHQ在油炸面制品中的限量为200 mg/kg(以油脂中的含量计),在油炸肉制品中禁止添加[4-5]。因此,建立一种方便、快捷的检测方法对市场上食品中的TBHQ进行快速有效的定量分析具有重要的意义。
目前,关于TBHQ的检测方法有气相色谱法、液相色谱、毛细管电泳法等,这些方法虽然具有检出限低、灵敏度高等优点,但其由于前处理繁琐,仪器昂贵,需要专人,因此不适合现场快速有效的定量分析[6-8]。电化学分析法由于具有操作简单、方便、快捷等优点,在TBHQ现场快速、有效的定量分析方面存在较大的应用潜力[9-10]。
Fe3O4磁性纳米材料由于具有导电性好、吸附性强、比表面积大、具有良好的催化作用等优点成为近几年电化学分析研究的重点[11-13]。目前,虽然关于Fe3O4磁性纳米材料的相关研究已有报道,但关于Fe3O4纳米材料在TBHQ电化学检测方面的研究还鲜有报道。因此,本文以Fe3O4为基质,制备电化学传感器对油炸食品中的TBHQ进行快速、有效的定量分析。
1 材料与方法
1.1 材料与试剂
TBHQ:国药集团化学试剂有限公司;37%盐酸、氯化钾:洛阳昊华化学试剂有限公司;冰乙酸、高氯酸:天津市福晨化学试剂厂;铁氰化钾、磷酸:洛阳市化学试剂厂;无水乙醇:天津市天力化学试剂有限公司;薯条:市售;所有化学试剂均为分析纯。
1.2 仪器与设备
CHI-660E电化学工作站:上海辰华仪器有限公司;三电极系统[Ag/AgCl电极为参比电极,铂电极(Pt)为对电极]:以玻碳电极为工作电极;JSM-7001F场发射扫描电子显微镜(field emission scanning electron microscope,FESEM)、JEM-ARNPOOF NEOARM 透射电子显微镜(transmission elec-tron microscope,TEM):日本JEOL;KQ-500E超声波清洗器:昆山市超声仪器有限公司;IKAC-MAG HST恒温磁力搅拌器:上海司乐仪器有限公司;移液枪:赛默飞世尔(上海)仪器有限公司。
1.3 试验方法
1.3.1 Fe3O4制备
Fe3O4球合成:分别取FeCl3粉末5 g,柠檬酸三钠1.8 g于300 mL锥形瓶中,加入150 mL乙醇溶液,超声分散0.5 h然后强烈搅拌1 h使其分散均匀,在搅拌过程中加入醋酸钠7.5 g搅拌0.5 h,然后将混合物移入水热釜中加热至200℃,保持8 h,然后冷却至室温25℃,用蒸馏水、乙醇洗涤数次,最后于60℃烘干备用既得Fe3O4纳米材料。
1.3.2 Fe3O4/GCE制备
GCE电极的处理参照文献[14-15]。用10 μL移液枪吸取一定量1.0 mg/mL的Fe3O4修饰液滴于GCE电极表面,然后用烧杯罩在上面(防止其被污染),25℃条件下自然干燥,即得Fe3O4/GCE。
1.4 样品处理
准确称取薯条10.000 0 g用研钵进行粉碎,然后置于300 mL锥形瓶中加入150 mL无水乙醇溶解,混合均匀静置8 h,然后用布氏漏斗过滤将滤液转移至500 mL容量瓶中,用无水乙醇定容,备用。
1.5 数据处理
运用origin 8.5对试验结果进行数据分析及处理。
2 结果与分析
2.1 不同材料的形貌表征
利用SEM和透射电子显微镜对Fe3O4纳米材料进行表征,其结果如图1所示。
由图1可知,Fe3O4呈均匀的球形结构,其直径约为50 nm~100 nm,具有较大的比表面积,可以为电化学反应提供较多的附着位点,增加其表面电子的转移,提高电化学反应的电流响应。

图1 Fe3O4的SEM和TEM图Fig.1 SEM and TEM image of Fe3O4
2.2 不同电极的电化学表征
在 10 mmol/L 的 [Fe(CN)6]3-溶液(含 0.1 mol/L KCl)中分别对GCE和Fe3O4/GCE进行交流阻抗分析,其结果见图2。
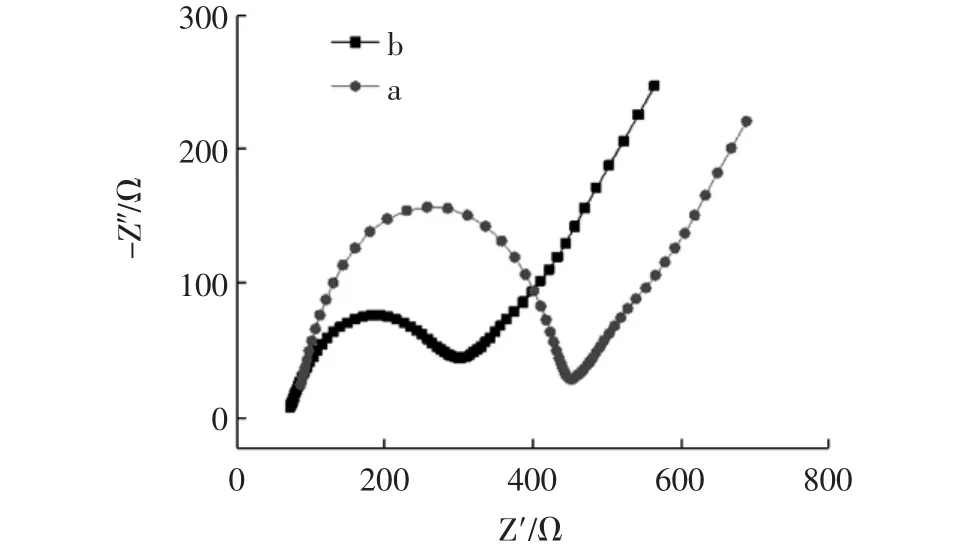
图2 GCE,Fe3O4/GCE在10 mmol/L的[Fe(CN)6]3-(含0.1 mol/L KCl)溶液中的交流阻抗图谱Fig.2 Electrochemical impedance spectroscopy of GCE,Fe3O4/GCE in 10 mmol/L[Fe(CN)6]3-containing 0.1 mol/L KCl
由图2可知,GCE电阻为363 Ω,Fe3O4/GCE电阻为234 Ω与GCE相比阻抗降低了35.54%,这说明Fe3O4纳米材料具有较高的比表面积和良好的吸附性,能够给电极表面反应物提供较多的结合位点,促进电极表面电子的转移速率,提高电极导电性,增加响应电流,进而降低电极表面阻抗。
2.3 TBHQ在不同电极上的电化学行为
以0.1 mol/L的HCl为支持电解质溶液,分别用GCE和Fe3O4/GCE对20 μg/mL的TBHQ进行循环伏安(cyclic voltammetry,CV)扫描,其结果如图3所示。
由图3可知,GCE氧化峰电流 IP为49.04 μA,Fe3O4/GCE氧化峰电流IP为61.88 μA与GCE相比,Fe3O4/GCE在20 μg/mL的TBHQ溶液中氧化峰电流提高了26.18%,且氧化峰电位负移了0.022 V,这说明Fe3O4的存在对TBHQ产生了催化作用[16],加快了电极表面电化学反应的进行,加速了电子转移速率。

图3 GCE和Fe3O4/GCE在20 μg/mLTBHQ溶液中的循环伏安曲线Fig.3 CV response of GCE and Fe3O4/GCE in 20 μg/mL TBHQ
2.4 缓冲溶液的选择
分别以0.1 mol/L的HCl、醋酸、磷酸和高氯酸为支持电解质溶液,Fe3O4/GCE为工作电极对20 μg/mL的TBHQ进行CV扫描,其结果如图4所示。

图4 Fe3O4/GCE在不同缓冲溶液中的CV曲线Fig.4 CV curves of Fe3O4/GCE in different buffer solutions
由图4可知,4种电解质对Fe3O4/GCE表面的电化学反应有显著性影响,其中当以0.1 mol/L盐酸缓冲液为支持电解质溶液时,氧化电流值最大,IP为60.68 μA,并且氧化还原电位差ΔEp最小为39 mV,这说明与其他3种缓冲液相比盐酸缓冲液能很好地消除反应离子的电迁移,促进离子的扩散,减小液界面电势差,提高电流响应,因此选取HCl为支持电解质溶液。
2.5 缓冲溶液浓度的选择
分别以 0.05、0.08、0.10、0.12、0.15、0.18、0.20 mol/L 的盐酸为支持电解质溶液对20 μg/mL的TBHQ进行CV扫描,其结果如图5所示。
由图5可知,随着盐酸浓度的增加,Fe3O4/GCE在20 μg/mL的TBHQ中测得的氧化峰电流先增大后减小,且当盐酸浓度为0.10 mol/L时,氧化峰电流最大IP为60.78 μA,这是因为在一定浓度范围内随着电解质浓度的增加能够有效地促进电极表面离子的扩散和转移,提高电化学反应,但当浓度过高时,离子间的相互作用力增大,影响电极表面离子的扩散速率进而影响电极表面的电化学反应,降低氧化峰电流。因此,选取0.10 mol/L盐酸缓冲液为支持电解质溶液。

图5 缓冲溶液浓度对Fe3O4/GCE的影响Fig.5 The effect of buffer concentration on the response of Fe3O4/GCE
2.6 修饰量的选择
以0.1 mol/L的盐酸缓冲液为支持电解质,分别以1.0、2.0、3.0、4.0、5.0、6.0 μL 的 Fe3O4修饰 GCE 制备Fe3O4/GCE传感器对20 μg/mL的TBHQ进行CV扫描,其结果如图6所示。

图6 Fe3O4修饰量对Fe3O4/GCE的影响Fig.6 The effect of Fe3O4loading on the response of Fe3O4/GCE
由图6可知,随着Fe3O4修饰量的增加,Fe3O4/GCE在20 μg/mL TBHQ中测得的氧化峰电流先增大后减小,当修饰量为3μL时氧化峰电流达到最大为61.09μA。这是因为Fe3O4具有良好的导电性,能够有效地促进电子的转移,增加电流响应,但当修饰量过多时会导致电极表面涂层较厚,Fe3O4聚集,阻碍电子的转移,增加阻抗,进而降低电流响应,因此Fe3O4修饰量选取3 μL。
2.7 不同扫描速率的CV曲线
以0 mol/L的盐酸缓冲液为支持电解质,分别以10、20、30、40、60、80、100、150、200、300、400、500 mV/s的扫描速率对20 μg/mL TBHQ进行CV扫描,其结果如图7所示。
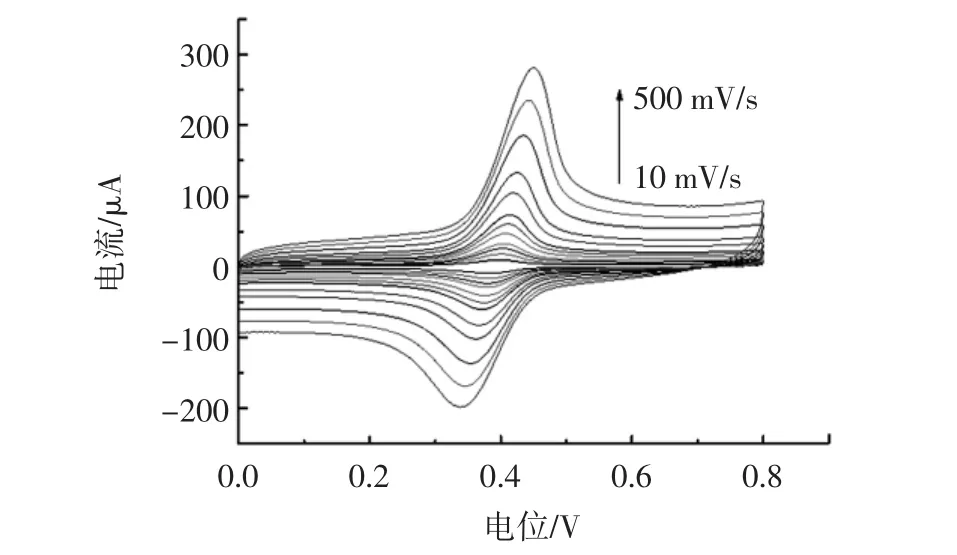
图7 Fe3O4/GCE在不同扫描速率下在20 μg/mL TBHQ中的CV曲线Fig.7 CV curves of Fe3O4/GCE in 20 μg/mL TBHQ at different scan rates
由图7可知,随着扫描速率的增加,Fe3O4/GCE在20 μg/mL TBHQ中测得的氧化峰电流也逐渐增加,且其扫描速率平方根与峰电流值呈线性关系,这说明电极表面的反应主要受扩散过程控制。
2.8 标准曲线的绘制
在最佳试验条件下分别对 0.1 μg/mL~50 μg/mL的TBHQ进行定量分析,其结果如图8所示。

图8 TBHQ浓度与氧化峰电流间的关系曲线Fig.8 Relationship curve between oxidation peak current and concentration of TBHQ
由图8可知,TBHQ浓度与其氧化峰电流在0.5 μg/mL~35 μg/mL 范围内呈良好的线性关系,线性方程为:Y=2.984 1X+0.048 0(X为TBHQ浓度,Y为氧化峰电流),R2=0.999 6,相关性较好,检出限(3σ)为0.21 μg/mL,检出限较低,线性范围较宽符合试验要求。
2.9 实际样品检测
在最佳试验条件下采用加标法对薯条中TBHQ进行实际样品检测,根据标准曲线计算出其含量,平行测定3次,其结果见表1。
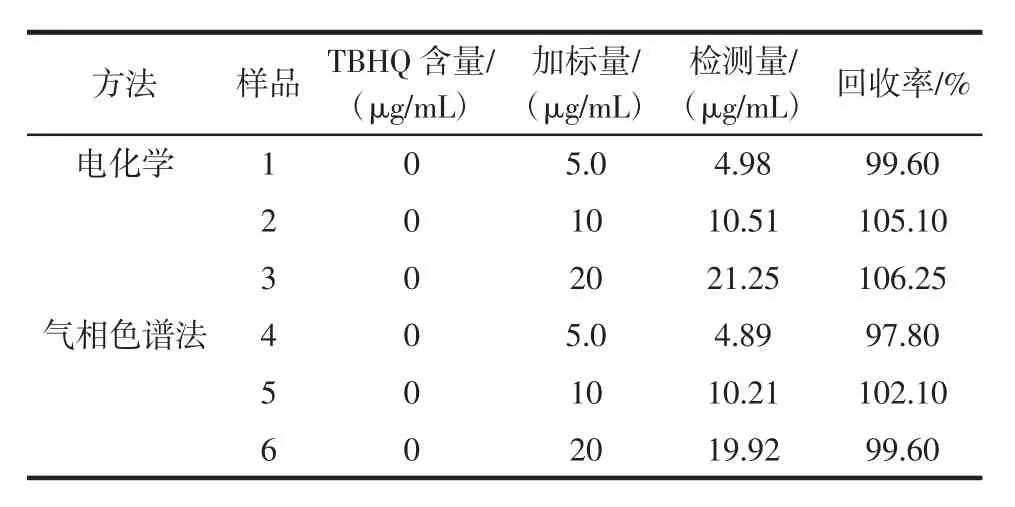
表1 实际样品检测及加标后回收率Table 1 Detection of TBHQ and recovery of TBHQ
由表1可知,TBHQ加标回收率在99.60%~106.25%之间,精密度较高,符合试验要求,且与气相色谱法相比,结果一致,可信度较高,可用于实际样品中TBHQ的定量分析。
2.10 重复性研究
在最佳试验条件下用Fe3O4/GCE对20 μg/mL的TBHQ连续扫描10次,其结果见表2。

表2 TBHQ连续扫描10次的氧化峰电流Table 2 Oxidation peak current of TBHQ scanned for 10 times continuously
由表2可知,在最优试验条件下,对20 μg/mL的TBHQ连续扫描10次的峰电位及峰电流值的标准偏差为1.26%,说明Fe3O4/GCE的稳定性、重复性较好。
3 结论
在Fe3O4磁性纳米材料的基础上制备了Fe3O4/GCE传感器,对薯条中的TBHQ进行定量分析。结果表明:Fe3O4具有良好的导电性、吸附作用和催化效果,能够有效地促进电子的转移,增加相应电流,提高电极灵敏度。利用Fe3O4/GCE对薯条中的TBHQ进行定量分析,其加标回收率在99.60%~106.25%之间,精密度较高,符合试验要求,且Fe3O4/GCE的稳定性、重复性较好,与气相色谱法相比,结果一致,可信度较高,且该方法简单、方便、快捷、成本低可用于实际样品中TBHQ现场快速有效的定量分析。

