青稞蛋白质的微波辅助提取工艺及性质研究
霍金杰,肖志刚,王娜,单秀峰,王依凡,王可心,段庆松,高育哲,*
(1.沈阳师范大学粮食学院,辽宁沈阳110034;2.沈阳师范大学实验教学中心,辽宁沈阳110034)
青稞是一种重要的高原谷类作物,主要生长在我国西藏、青海、四川、云南等地区[1],具有高蛋白、耐高寒、耐贫瘠的优良特性,另外还由高纤维、高维生素、低脂肪、低糖等营养成分构成[2-4],据分析,青稞的粗蛋白含量为7.68%~17.52%,高于一般的谷物,但是略低于小麦和燕麦。青稞蛋白质主要包括谷蛋白(43.83%)和醇溶蛋白(18.25%)[5]。据证明,青稞蛋白质含有18种氨基酸,包括8种必需氨基酸[6],尤其富含大米和小麦等谷物蛋白质中缺乏的赖氨酸,其含量达0.36 g/100 g[7],是一种优质的植物蛋白质资源[8]。青稞还具有生长期短的优点,病虫害的发生很少,是高原地区真正绿色无污染的食品[9]。
国内外对于青稞蛋白质提取常用的方法有物理法、化学法和生物酶法[10],碱溶酸沉法是提取植物蛋白最普遍最常用的方法[11]。微波辅助是物理方法,避免了化学试剂的引入,绿色安全无污染并且不改变蛋白质的性质。
本文以青稞米为原料,采用微波辅助碱溶酸沉法提高青稞蛋白质的提取率,通过单因素和响应面试验优化提取的工艺条件,同时分析并比较微波辅助提取青稞蛋白的功能性质并对其结构进行表征。
1 材料与方法
1.1 原料与试剂
青稞米:宁夏五朵梅食品股份有限公司;盐酸(分析纯)、氢氧化钠(分析纯)、浓硫酸(分析纯):沈阳化学试剂厂;硫酸铜(分析纯):天津市大茂化学试剂厂;硼酸:天津博迪化工股份有限公司;硫酸钾(分析纯):天津市北联精细化学品开发有限公司;十二烷基硫酸钠:天津市恒兴化学试剂有限公司;食用大豆油:辽宁省营口市金龙鱼精炼一级大豆油。
1.2 仪器与设备
常压微波合成 (MAS-IIPLUS):上海新仪微波化学科技有限公司;数显电子恒温水浴锅(HH-6):常州国华电器有限公司;低速离心机(LXJ-IIB):上海安亭科学仪器厂;低速离心机(LD5-2A):北京医用离心机厂;高速均质机(IP 21):IKA Works Guangzhou;凯氏定氮仪(SKD-200)、红外智能消化炉(SKD-20S2):上海沛欧分析仪器有限公司;数显pH计(pHS-25):上海仪电科学仪器股份有限公司;紫外可见分光光度计(722型):上海佑科仪器仪表有限公司;分析天平(ESJ12-4B):沈阳龙腾电子有限公司;粉碎机(JFSD-100):上海嘉定粮油仪器有限公司;高速冷冻离心机(X-12R):美国Beckman公司;冷冻干燥机(Scientz-12N):宁波新芝生物科技股份有限公司;冰箱(BCD-198):博西华家用电器有限公司。
1.3 青稞蛋白质的提取及优化方法
1.3.1 青稞蛋白质提取的工艺流程
称取100 g青稞米→粉碎→过筛→取青稞粉按1∶20(g/mL)加水混匀→微波辅助→调pH值至碱性→恒温水浴→离心→收集上清液→调pH值至酸性→恒温水浴→离心→去上清液→取底部沉淀物。
1.3.2 蛋白质含量的测定
参照GB 5009.5-2016《食品安全国家标准食品中蛋白质的测定》中的方法并加以修改,蛋白质的含量计算公式如下:

式中:X为试样中的蛋白质含量,g/100 g;c为盐酸标准液的浓度,mol/L;F为氮换算蛋白质的系数,5.83;V1为试液消耗盐酸标准滴定液的体积,mL;V2为试剂空白消耗盐酸标准滴定液的体积,mL;m为试样的质量,g。
1.3.3 微波辅助提取青稞蛋白质的单因素试验
以蛋白质提取率为测定指标,控制料液比1∶20(g/mL),考察在微波过程中,青稞蛋白质的溶液pH值、微波时间、微波功率、微波温度对青稞蛋白质提取率的影响。
1.3.4 响应面优化试验
以蛋白质提取率为响应值,基于单因素试验选择微波温度(A)、微波时间(B)、微波功率(C)、青稞溶液的pH值(D)进行四因素三水平的试验,优化微波辅助碱溶酸沉法的提取条件。利用Design-Export 8.0对试验数据进行回归分析,得到以青稞蛋白质提取率为响应值的回归模型,对提取率进行预测分析,对模型进行方差显著性检验分析,确定各因素对杏仁蛋白质提取率的影响结果,分析各因素间交互作用,绘制影响因素的响应面图。试验因素水平见表1。

表1 因素水平表Table 1 Factors and levels table
1.4 青稞蛋白质功能性质的测定
1.4.1 青稞蛋白质持水性的测定
取10 mL塑料离心管,称重记为m1,准确称取0.5 g蛋白质样品于离心管中加水配置成一定浓度的样液,调节pH值为7,在离心管中充分振荡,室温25℃静置 30 min,使其充分吸水,温度分别选取 30、40、50、60、70℃,3 000 r/min离心30 min倒去上清液,静置10min,称重记为m2,计算青稞蛋白的持水力(water holding capacity,WHC),以(g/g)表示。

1.4.2 青稞蛋白质吸油性的测定
取10 mL塑料离心管,称重记为m1,准确称取0.5 g样品置于10 mL离心管中,加5 mL大豆油,混匀后恒温静置 30 min,温度分别选取 30、40、50、60、70 ℃,3 000 r/min离心30 min,倒掉上清液,将离心管倒放在滤纸上,10 min后称量,离心管和残留物的总质量m2。吸油性以每克样品吸附油的质量(g/g)表示。

1.4.3 青稞蛋白质起泡性和泡沫稳定性的测定
配置1%的蛋白质溶液20 mL,调节pH值至4.0、5.0、6.0、7.0、8.0、9.0,在高速组织搅拌机中以10 000 r/min的转速均质1 min,迅速转入50 mL量筒中,记录均质停止时泡沫体积V0、30 min时泡沫体积V30,计算青稞蛋白的起泡性(foaming capacity,FC)和泡沫稳定性(foaming stability,FS)。
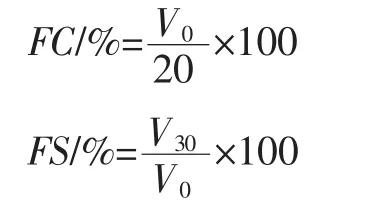
1.4.4 青稞蛋白质乳化性和乳化活性的测定
配置18 mL浓度为1%的蛋白质溶液,调节pH值至 4.0、5.0、6.0、7.0、8.0、9.0,加入 6 mL 的一级精炼大豆油混合,10 000 r/min均质1 min,静置,分别在0 min和10 min时从容器底部取50 μL乳状液于试管中,加入5 mL 0.1%的十二烷基硫酸钠(sodium dodecyl sulfate,SDS)混匀后以0.1%SDS为空白于500 nm测吸光度,计算乳化活性(emulsification activity index,EAI)和乳化稳定性(emulsifying stability index,ESI)。

式中:T为2.302;N为稀释倍数,100;C为蛋白质的质量浓度,g/mL;Ø为溶液中油的体积分数,0.25;A0为0 min乳化液的吸光度;A10为静置10 min后乳化液的吸光度。
1.4.5 青稞蛋白质溶解性的测定
配置1%的蛋白质溶液20 mL,分别调节pH3、4、5、6、7、8和9,在30℃水浴磁力搅拌1 h,3 500 r/min离心20 min,吸取上清液1 mL定容到50 mL,500 nm下比色测其吸光度,以单位体积单位质量样品的吸光度作为溶解指数。

式中:A为3次平行试验测得的吸光度的平均值;W 为所称样品的质量,g;A1为溶解指数,(g·mL)-1。
1.5 青稞蛋白质热特性的测定
用差式扫描量热仪测定青稞蛋白质的变性温度,准确称取5 mg样品置于铝制钳锅中,密封压盖后进行扫描。以空铝盒为对照,氮气流速50 mL/min,扫描温度从30℃到250℃,升温速率为10℃/min。利用Universal配套软件(V3.8,TA Inc,USA)分析处理数据。
1.6 蛋白质二级结构的测定
取适量干燥后的蛋白质样品放入红外光谱仪中进行分析,于红外光谱仪中做全波段(400 cm-1~4 000 cm-1)扫描。红外谱图的处理:利用Origin8.5软件进行绘图分析。
2 结果与分析
2.1 单因素试验结果
2.1.1 微波功率对青稞蛋白质提取率的影响
微波功率对青稞蛋白质提取率的影响见图1。
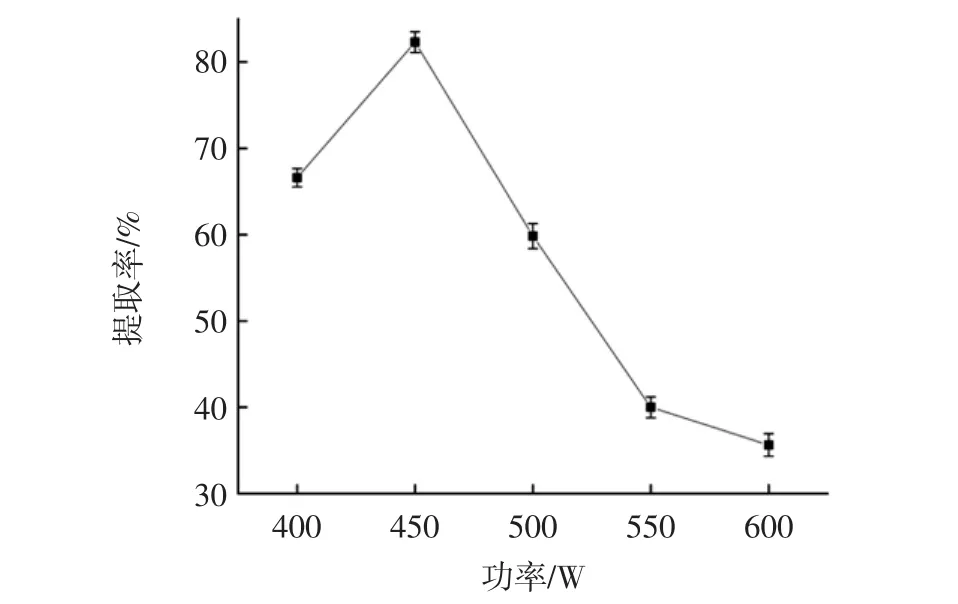
图1 微波功率对青稞蛋白质提取率的影响Fig.1 Effect of microwave power on extraction rate of barley protein
如图1所示,随着功率的升高,青稞蛋白质的提取率先升高后降低,当微波功率为450 W时,青稞蛋白质的提取率达到最高80.6%,随着微波功率的继续增大,青稞蛋白质的提取率降低,并且降低的幅度变大,原因可能是当微波功率较高的时候,升温速度快,青稞粉的细胞破碎程度较大,蛋白质的溶出量较多。因此选择微波功率450 W,进行下一步的响应面试验。
2.1.2 微波时间对青稞蛋白质提取率的影响
微波时间对青稞蛋白质提取率的影响见图2。

图2 微波时间对青稞蛋白质提取率的影响Fig.2 Effect of microwave time on extraction rate of barley protein
由图2可知,随着微波时间的增加,青稞蛋白质的提取率呈现出先升高后降低的趋势,在微波时间为9 min时,提取率达到了最大值74.2%,随着微波时间的进一步加长,蛋白质的提取率反而下降。可能是因为微波时间较短时,辐射的能量不足,青稞粉的细胞破裂程度较低,溶出的蛋白质较少,随着微波时间的增长,青稞粉的细胞破裂程度大,青稞蛋白质的溶出量逐渐增大,当微波时间逐渐大到一定程度,导致局部过热,青稞蛋白质的提取率下降。
2.1.3 微波温度对青稞蛋白质提取率的影响
微波温度对青稞蛋白质提取率的影响见图3。

图3 微波温度对青稞蛋白质提取率的影响Fig.3 Effect of microwave temperature on extraction rate of barley protein
由图3可知,随着微波温度的升高,青稞蛋白质的提取率增大,在微波时间为40℃时,提取率最大达到72.8%,随着微波温度的进一步升高,蛋白质的提取率下降。原因可能是,微波温度较低时辐射的能量不足,青稞粉的细胞破裂程度较低,溶出的蛋白质较少,随着微波温度的升高,蛋白质的分子构象发生改变,使蛋白质更容易从原料中溶解出来[12],青稞蛋白质的溶出量逐渐增大并且达到最大值,当微波温度高到一定程度,细胞被破坏,青稞蛋白质的提取率下降。
2.1.4 溶液pH值对青稞蛋白质提取率的影响
溶液pH值对青稞蛋白质提取率的影响见图4。
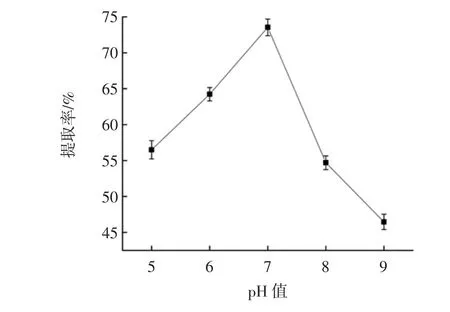
图4 溶液pH值对青稞蛋白质提取率的影响Fig.4 Effect of solution pH on extraction rate of highland barley protein
由图4可知,青稞溶液从酸性到碱性条件下,青稞蛋白质的提取率先升高后下降,pH值为7时提取率最大为74.4%,原因可能是在酸性条件下青稞溶液溶解的不完全,而在碱性环境下,各种杂质开始溶解,干扰了青稞蛋白质的纯度,所以pH值为7时,青稞蛋白质的提取率最高。
2.2 响应面优化提取工艺
2.2.1 响应面试验设计与结果
响应面试验研究是以蛋白质提取率为响应值,自变量为溶液的pH值、微波温度、微波时间、微波功率。根据设计的29组试验,通过每组都进行3组平行试验,来确保数据的精确性,结果如表2所示。
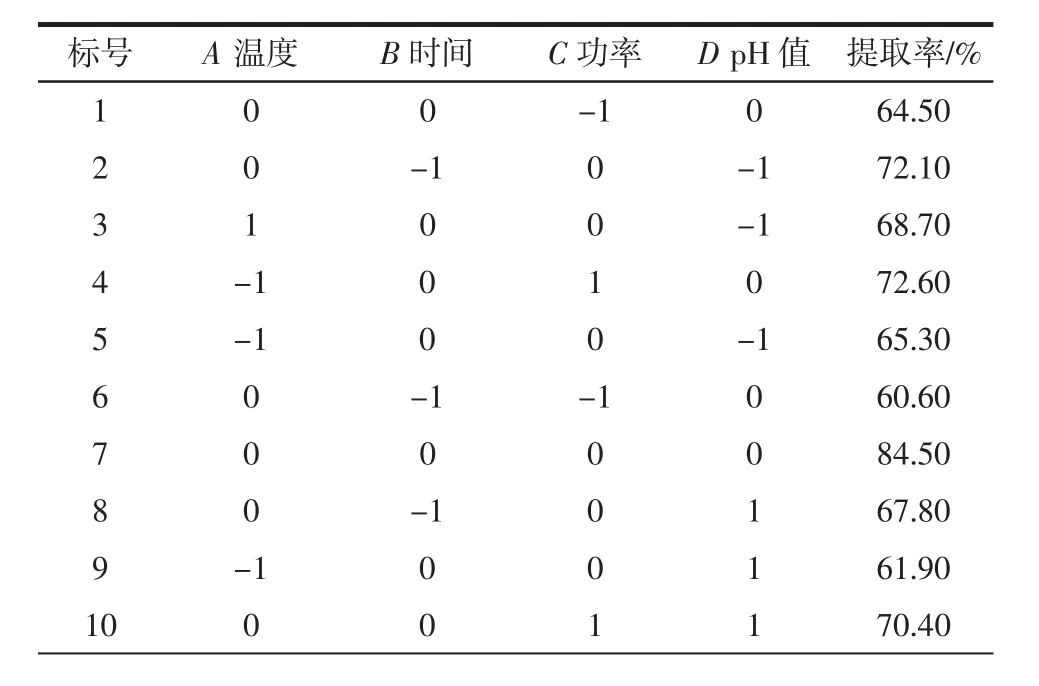
表2 Box-Behnken试验设计以及蛋白提取率的实测值Table 2 Box-Behnken test design and the measured value of protein extraction rate
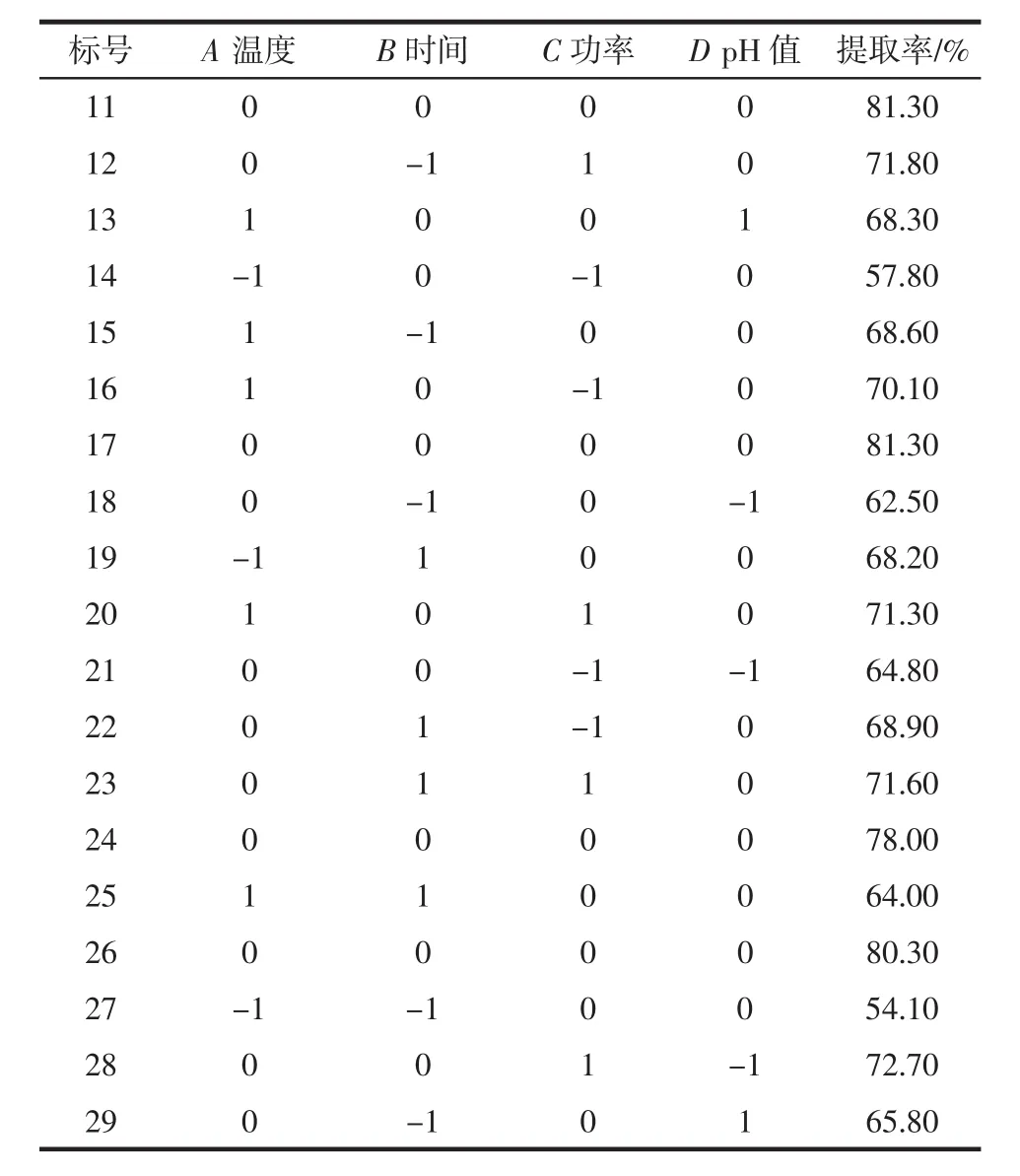
续表2 Box-Behnken试验设计以及蛋白提取率的实测值Continue table 2 Box-Behnken test design and the measured value of protein extraction rate
2.2.2 模型拟合
通过Design Expert软件对表2中的数据进行多元回归拟合分析,由此得出青稞蛋白质提取率的二次项回归方程:提取率=81.08+2.59A+2.43B+3.64C-0.62D-4.68AB-3.40AC+0.75AD-2.13BC-1.90BD-0.50CD-8.53A2-7.89B2-5.25C2-6.79D2。
2.2.3 方差分析
二项式回归模型系数的显著性详细结果如表3所示。
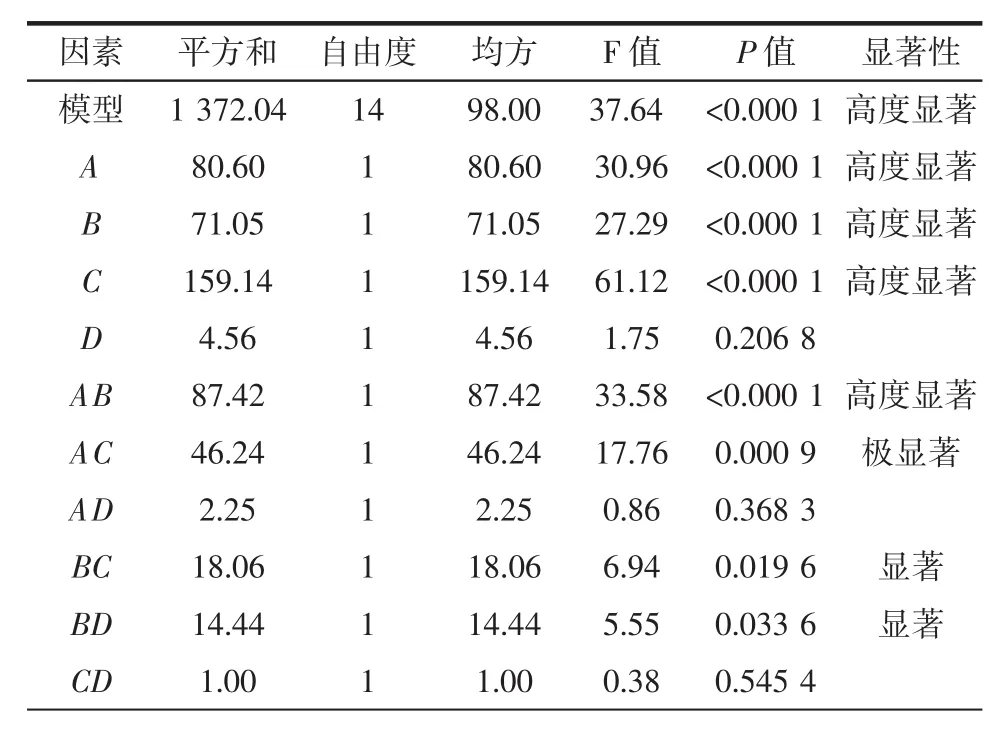
表3 回归模型的方差分析及显著性检验Table 3 Vriance analysis and significance test of regression model
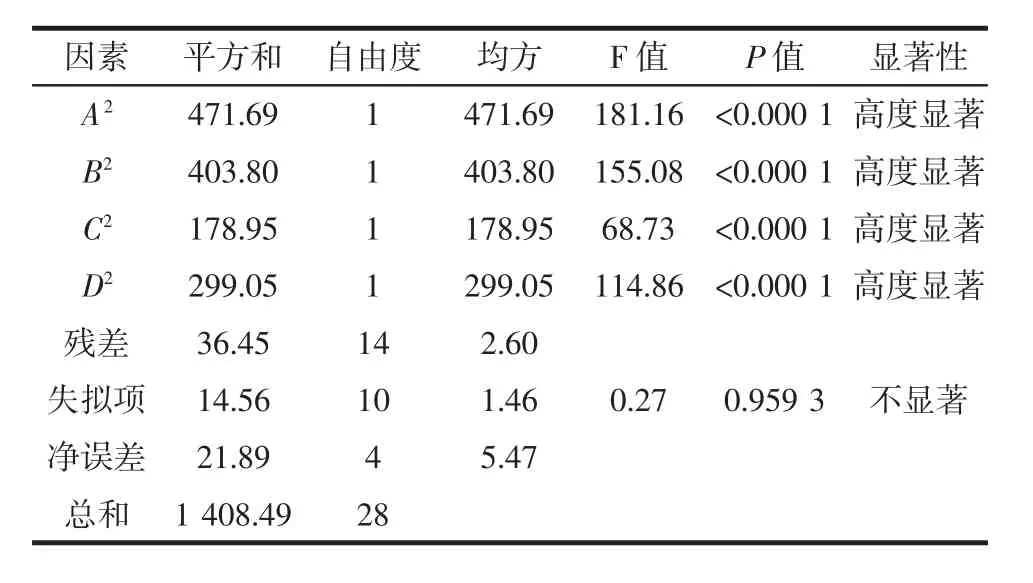
续表3 回归模型的方差分析及显著性检验Continue table 3 Vriance analysis and significance test of regression model
由表 3 可知,F 模型=37.64,(P<0.000 1)模型极显著,失拟检验 F=0.959 3,(P>0.05)结果不显著,说明回归模型的拟合度较好,模型与试验误差小。模型相关系数(R2=0.974 1)较高,说明模型拟合程度良好,误差较小,可以采用回归方程替代真实试验对不同微波辅助碱溶酸沉提取条件下的青稞蛋白质提取率进行预测。由表3可知,一次项中A、B和C均影响高度显著;交互项中AB影响高度显著,AC极显著,BC和BD影响显著;二次项中,A2、B2、C2和 D2均影响高度显著,说明各因素之间有较为复杂的二次关系。通过软件分析,青稞蛋白质提取率最佳条件为:微波功率465.49 W,pH 6.93,温度40.29℃,时间9.10 min,在此条件下蛋白质提取率为81.86%。考虑到实际的可操作性,调整试验条件为:微波功率460 W,pH 7.0,温度40℃,时间9 min,经试验验证,此最优条件下蛋白质提取率为81.94%,与预测值的相对误差在0.97%左右,证明应用该模型在实践中进行提取效果预测是可行的。
2.2.4 两因素间的交互作用
通过Design-Expert 8.0.6设计软件得到响应面和等高线图见图5。根据响应面试验的设计原理及分析,三维响应面图的弯曲度越大,表示2个因素间的作用越显著,由此能有效反映出各因素之间的交互作用对响应值提取率的影响[13]。
比较6组三维响应面图可以看出,随着4个因素在一定范围的增大,青稞蛋白质的提取率先升高后降低。同时三维响应面图弯曲度越大,表示两因素间越显著,等高线图圆形表示两因素相互作用不显著,椭圆形表示相互作用显著,表明相关因素对青稞蛋白质提取率的影响较大[14]。A、B和C对青稞蛋白质的提取率有显著性影响,A和B、A和C、B和C、B和D的交互作用对青稞蛋白质的提取率也有显著性影响,A和D、C和D对青稞蛋白质提取率的影响不显著。
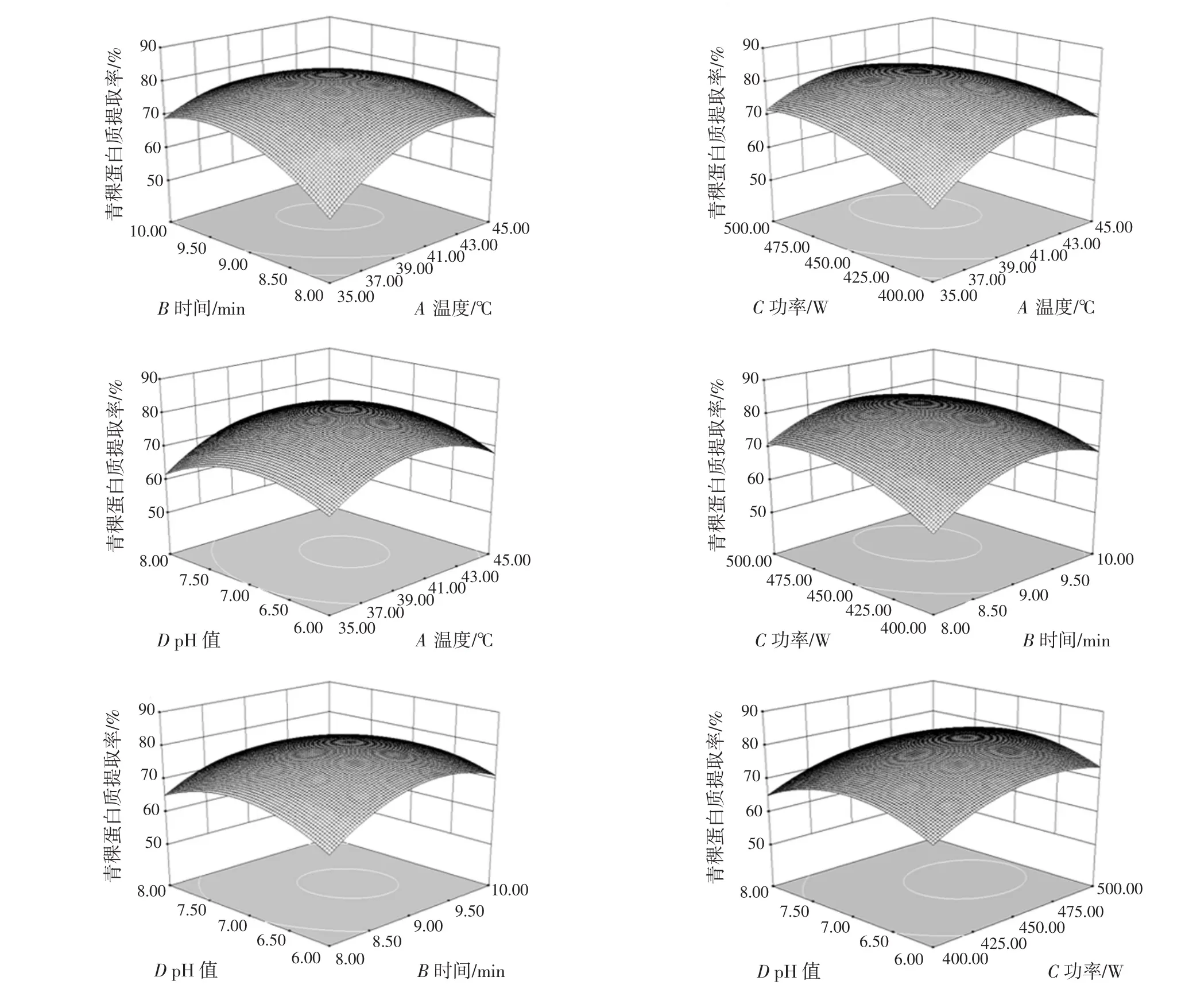
图5 两因素相互作用对青稞蛋白质提取率影响的响应面Fig.5 Response surface of the interaction of two factors on protein extraction rate of highland barley
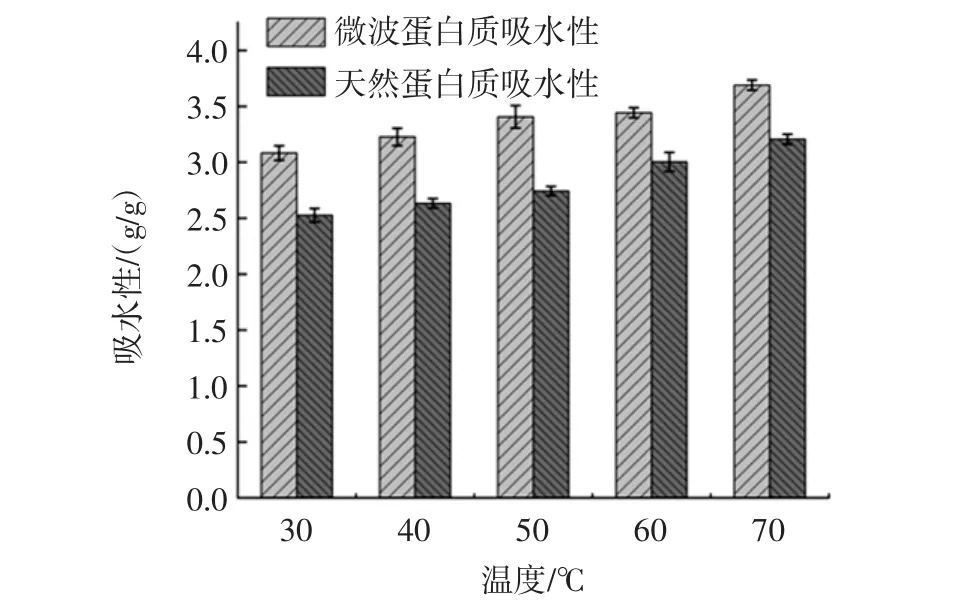
图6 温度对青稞蛋白质吸水性的影响Fig.6 Effect of temperature on water absorption of highland barley protein
2.3 青稞蛋白质功能性质的分析
2.3.1 温度对青稞蛋白质吸水性的影响
分别选取温度 30、40、50、60、70 ℃,测定青稞蛋白质的吸水性,分析微波与未微波提取出来的青稞蛋白质的吸水性随温度的变化情况,结果如图6所示。
在不同的温度条件下,青稞蛋白质的吸水性不同,随着温度的升高,青稞蛋白质吸水性缓慢升高。当温度升高时,经过微波处理,蛋白质的分子构象轻微改变,分子的立体结构伸展,埋藏在球状分子内部的亲水基暴露,促进了蛋白质分子和水分子的相互作用,提高了蛋白质的吸水性。
2.3.2 温度对青稞蛋白质吸油性的影响
分别选取温度 30、40、50、60、70 ℃,测定青稞蛋白质的吸油性,分析微波与未微波提取出来的青稞蛋白质的吸油性随温度的变化情况,结果如图7所示。
随着温度的升高,青稞蛋白质的吸油性缓慢增加,在30℃~50℃的时候变化明显,50℃~70℃变化不大,而经过微波处理的青稞蛋白质吸油性略高于未经微波处理的。可能是由于微波处理使得分子内部的亲油基暴露,但是随着温度的升高,蛋白质分子间发生了热变性反应,分子构象发生了轻微改变,导致吸油基团暴露截留了油分子,促进了蛋白质分子间的相互结合,减弱了蛋白质与油的相互作用。
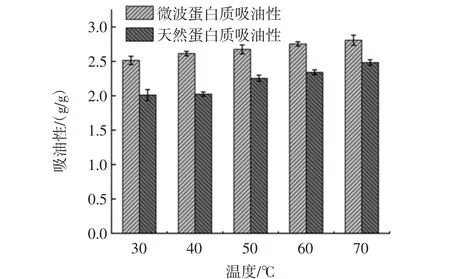
图7 温度对青稞蛋白质吸油性的影响Fig.7 Effect of temperature on oil absorption of highland barley protein
2.3.3 pH值对青稞蛋白质溶解性的影响
分别选取 pH 4、5、6、7、8,测定青稞蛋白质的溶解性,分析微波与未微波提取出的青稞蛋白质的溶解性随pH值的变化,结果如图8所示。
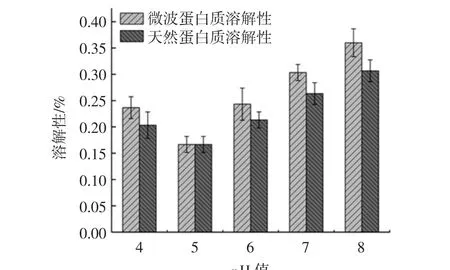
图8 pH值对青稞蛋白质溶解性的影响Fig.8 Effect of pH on the solubility of highland barley protein
青稞蛋白质的溶解性呈现出先降低后升高的趋势,在等电点附近,溶解性最差,随着碱性的逐渐增强,青稞蛋白质的溶解性逐渐增强。微波处理提取出来的青稞蛋白质溶解性略高于未经过微波处理的,但是二者的变化趋势相似,微波处理提高了青稞蛋白质的溶解性,溶解性的提高可能归因于它们较小的分子以及新暴露的可电离氨基酸和羧基,从而增加了水解产物的亲水性[15]。
2.3.4 pH值对青稞蛋白质起泡性和泡沫稳定性的影响
分别选取 pH 4、5、6、7、8,测定青稞蛋白质的起泡性和泡沫稳定性,分析微波与未微波提取出的青稞蛋白质的起泡性和泡沫稳定性随pH值的变化,结果如图9所示。
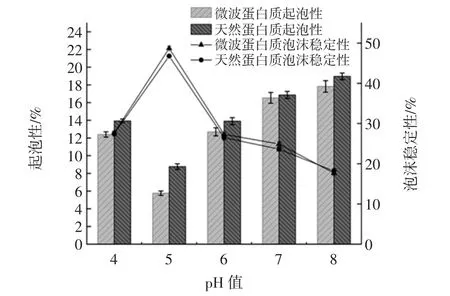
图9 pH值对青稞蛋白质起泡性和泡沫稳定性的影响Fig.9 Effect of pH on the foaming properties and foam stability of highland barley protein
pH值对青稞蛋白质的起泡性和泡沫稳定性有显著性影响,在pH值为5左右时,起泡性最差,是因为起泡性与蛋白质溶解度相吻合,肽不能迅速移动到界面[16],而泡沫稳定性最好;随着pH值的增加,青稞蛋白质的起泡性逐渐增强,泡沫稳定性降低,可能因为增加电荷密度和增加碱度会增强静电排斥力,从而阻止泡沫粒子的快速聚集[17]。微波与未微波提取出的青稞蛋白质起泡性和泡沫稳定性差异不大,经过微波处理,蛋白质的排斥作用形成了黏性膜,较小的肽比较大的肽能够将更多的空气吸收到溶液中,但它们的强度不足以提供稳定的泡沫[18]。
2.3.5 pH值对青稞蛋白质乳化活性和乳化稳定性的影响
分别选取 pH 4、5、6、7、8,测定青稞蛋白质的乳化活性和乳化稳定性,分析微波与未微波提取出的青稞蛋白质的乳化活性和乳化稳定性随pH值的变化,结果如图10所示。

图10 pH值对青稞蛋白质乳化活性和乳化稳定性的影响Fig.10 Effect of pH on the emulsification activity and emulsification stability of highland barley protein
随着pH值的升高,青稞蛋白质的乳化活性呈现出先降低后升高的趋势,可能是因为脂肪小球周围形成带点层,引起相互排斥,延迟了液滴的聚集;乳化稳定性呈现出先降低后升高的趋势,由于多肽的低分子量,两亲性不足以表现出较好的性质,在等电点附近,青稞蛋白质的乳化活性和乳化稳定性均最差,随着碱性逐渐增强,青稞蛋白质的乳化性和乳化稳定性明显升高[19]。经过微波处理与未经微波处理的乳化活性和乳化稳定性差异性不显著。
2.4 青稞蛋白质的热特性分析
经过DSC处理,得到了青稞蛋白质的热变性温度与焓值,如表4所示。

表4 青稞蛋白质的变性温度和焓变值Table 4 Changes of denaturation temperature and enthalpy of highland barley protein
从表4中可以看出,微波辅助法提取出来的蛋白质与天然蛋白质的热变性温度Tm=(88.37±0.019)℃,变性热焓 △H=(96.61±0.056)J/g,天然的蛋白质与经过微波辅助提取出的青稞蛋白质无显著性差异。
2.5 青稞蛋白质的红外吸收光谱分析
经过傅里叶红外光谱的测定,得到的结果如图11所示。
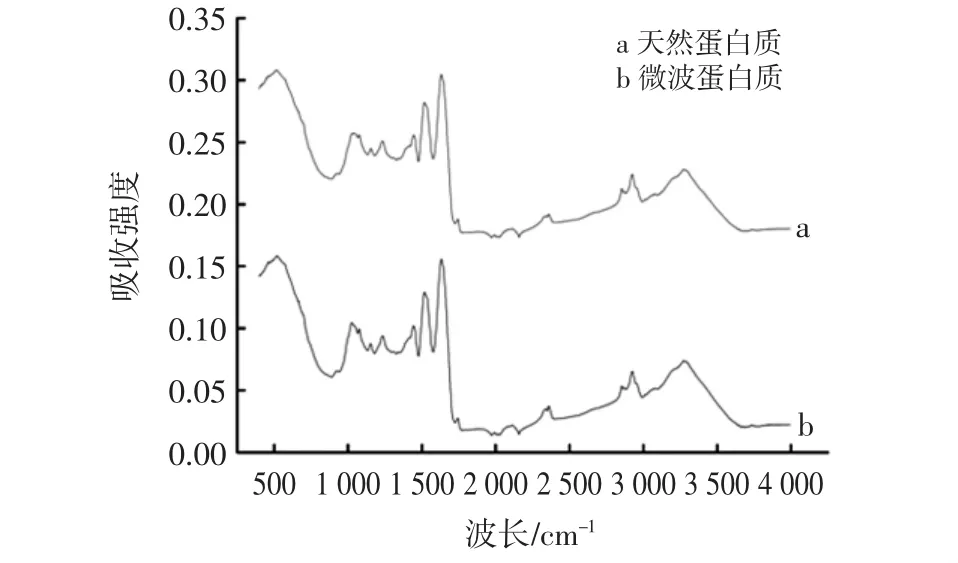
图11 青稞蛋白质的红外光谱吸收图Fig.11 Infrared spectrum absorption of highland barley proteinz
一般情况下,蛋白质和多肽在红外区都有着若干特征吸收谱带,如波数1 700 cm-1~1 600 cm-1范围所对应的酰胺Ⅰ带,1 550 cm-1~1 530 cm-1范围的酰胺Ⅱ带和1 300 cm-1~1 260 cm-1范围的酰胺Ⅲ带[20];由图11可以看出:经过微波辅助提取出的青稞蛋白质在1 634.8 cm-1处的吸收峰主要应为酰胺Ⅰ区吸收谱带;1 578.4 cm-1处的吸收峰主要为酰胺Ⅱ区的吸收谱带;1 234.4 cm-1处吸收峰应为酰胺Ⅲ区吸收谱带,与未微波提取出的青稞蛋白质无差异。这与一般蛋白质的酰胺Ⅲ区吸收谱带(1 300 cm-1~1 260 cm-1)略有不同,可能与青稞蛋白质自身性质有关。
3 结论
通过单因素试验及响应面结果得知,影响微波辅助提取青稞蛋白质主要因素为pH值,微波功率,其次是微波温度,影响最小的因素是微波时间,最优工艺条件下提取率达到81.94%。与天然的青稞蛋白质对比,经过微波处理提取出的青稞蛋白质吸水性提高了15.5%,吸油性提高了13.6%,溶解性提高了25.0%,起泡性降低了6.0%。微波处理对青稞蛋白质的二级结构影响较小。

