SDE葫芦巴叶挥发性提取物GC-MS分析与抗氧化活性研究
李建芳,周枫,张阳阳,陈利军,刘坤峰
(1.信阳农林学院食品学院,河南信阳464000;2.河南省豫南特色食物资源综合利用工程技术研究中心,河南信阳464000;3.信阳农林学院农学院,河南信阳464000;4.江南大学食品学院,江苏无锡214122)
葫芦巴(Trigonellafoenum-graecum L.)系豆科蝶形花亚科一年生草本植物[1]。已从胡芦巴中分离和研究了多种有效成分,主要包括生物碱、皂苷和黄酮类化合物,这些成分已被证实其潜在的药用价值[2]。除了其已知的药用价值,如胃兴奋剂、抗糖尿病和半乳糖(乳糖诱导)效应外,最新的研究已经确定了低胆固醇血症、抗脂血症、抗氧化剂、护肝、抗炎、抗菌、抗真菌、抗溃疡、抗结石、抗癌药和其他杂酚的药物作用[3]。这些研究大多使用了种子粉末或不同形式的提取物,而对其叶子挥发性成分研究的很少。因此,对葫芦巴叶挥发性成分的提取、组分分析及其生物活性的研究很有必要。
早在1985年,P.Girardon等采用顶空萃取法和常压水蒸汽蒸馏法从葫芦巴种子中获得挥发性物质,共鉴定出39种成分[4]。近年来,国内外对葫芦巴挥发油也相继开展了大量研究。如陈灵等采用顶空固相微萃取法(headspace solid-phase microextractio,HS-SPME)结合气相色谱-质谱联用法(gas chromatography-mass spectrometer,GC-MS)分析3个产地葫芦巴种子的挥发性成分,共鉴定出31种化学成分,其中仅有惕各醛、惕各醇、正己醛、正己醇、2-正戊基呋喃等5种成分相同[5];刘世巍等分别采用超声-索氏抽提组合法和超临界萃取法从宁夏产葫芦巴种子中提取挥发油,利用GC-MS分析其化学成分,共鉴出26种化合物,包括胺类、酸类、醇类、酯类、酮类。其中,正丁基-烃基甲苯含量最高,达到66.04%[6]。RiadhMebazaa等在不同条件下采用溶剂萃取和静态顶空固相微萃取两种方法提取葫芦巴中的挥发性物质,结合气相色谱-质谱联用技术,对提取的挥发物进行了定性鉴别,共鉴定出67种化合物,其中一些首次在葫芦巴种子中报道(如吡嗪、2,5-二甲基-4-羟基-3(2H)-呋喃酮、荜澄茄油烯醇)[7]。以上这些研究主要针对葫芦巴种子,且研究发现,不同方法、不同产地、不同部位萃取获得的葫芦巴挥发性提取物化学成分具有明显的差异性。
植物挥发性物质提取的方法有水蒸气蒸馏法(hydro-distillation,HD)、同时蒸馏萃取法(simultaneous distillation extraction,SDE)、有机溶剂萃取法(solvent extraction,SE)、超声波辅助萃取法(ultrasound-assisted extraction,UAE)、超临界 CO2萃取法(supercritical carbon dioxide extraction,SFE-CO2)、微波萃取法(microwave-assisted extraction,MAE)等,不同提取方法得到的挥发油成分不同,且表现出的生物活性也不同。近年来,植物性挥发性物质的提取主要采用水蒸气蒸馏法,提取工艺过于单一,且提取温度高、提取时间长、系统开放,易造成热不稳定或易氧化成分的破坏及挥发损失,对部分组分有破坏作用[8]。而同时蒸馏萃取法是将水蒸气蒸馏与溶剂萃取二合为一,从而减少试验步骤,缩短萃取时间,节省萃取溶剂,并简化设备[9]。
本研究采用乙醚-水蒸汽同时蒸馏萃取,配合气质联用技术(gas chromatography-mass spectrometer,GCMS)系统分析了葫芦巴叶中挥发性成分,并研究其抗氧化活性,旨在更好地开发和利用葫芦巴提供参考。
1 材料与方法
1.1 原料
葫芦巴叶(干燥):印度MDH。
1.2 化学试剂
无水乙醚、二氯甲烷、磷酸氢二钠、铁氰化钾、三氯化铁、无水乙醇、三氯乙酸、邻苯三酚、硫酸亚铁、过氧化氢、水杨酸、过硫酸钾(均为分析纯):天津凯通化学试剂有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO):合肥博美生物科技有限责任公司;三羟甲基氨基甲烷盐酸盐缓冲液[tris(hydroxymethyl)aminomethane-HCl,Tris-HCl]:上海恪敏生物科技有限公司;1,1-二苯基-2-三硝基苯肼 [1,1-diphenyl-2-picrylhydrazyl radical 2,2-diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl,DPPH]:北京博奥拓达科技有限公司;维生素C:北京索莱宝科技有限公司;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸) 二铵盐 [2,2'-azinobis-(3-ethylbenzthiazoline-6-sulphonate,ABTS]:上海如吉生物科技发展有限公司。
1.3 主要仪器与设备
同时蒸馏萃取装置(见图1);RE-52CS旋转蒸发仪:上海圣科仪器设备有限公司;HDM-1000 B恒温电热套:常州荣华仪器制造有限公司;Agilent 6850/5975气相色谱-质谱联用仪:美国安捷伦科技有限公司;YLJYE-100水浴锅:上海梅香仪器有限公司;JCS-6102 B电子分析天平:哈尔滨众汇衡器有限公司;TU-1901分光光度计:北京普析通用仪器有限公司;TGL-16C离心机:上海安亭科学仪器厂。

图1 同时蒸馏装置示意图Fig.1 Diagram of a simultaneous distillation and extraction unit
1.4 方法
1.4.1 提取方法
蒸馏萃取装置的一端连接盛有50 g样品加入一定量的蒸馏水在1 000 mL圆底烧瓶中,另一端接用250 mL的圆底烧瓶里面装40 mL乙醚,样品那一端用恒温电热套加热,乙醚端用60℃水浴锅加热,蒸馏萃取2 h。萃取完成后,把U型管中的混合液也倒入盛有乙醚端,取下加入无水硫酸钠干燥萃取液,冷冻过滤,滤液在40℃下旋转蒸发浓缩,得挥发性物质[10-11],平行3次,合并3次试验所得样品。
1.4.2 挥发性成分得率的计算方法将得到的挥发性提取物按照式(1)计算其得率。
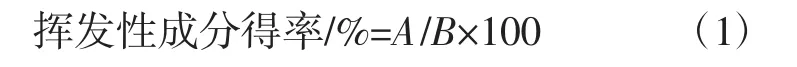
式中:A为提取得到的挥发性成分质量,g;B为葫芦巴样品的质量,g。
1.4.3 GC-MS成分分析方法
将提取得到的挥发性成分用无水乙醚进行稀释,吸取5 μL稀释后的精油分别进行GC-MS成分分析。
色谱条件:色谱柱,DB-5(60m×0.25mm×0.25μm);载气He;进样量1.0L;分流比 20∶1;柱流速 0.8mL/min;程序升温为,初始温度50℃,保持3 min,以10℃/min至260℃,保持10 min。
质谱条件:EI电离能量70 eV,离子源温度230℃,溶剂延迟5 min,扫描离子质量范围35 amu~550 amu,质谱库NIST06,传输线温度280℃,进样口温度260℃。用色谱峰面积归一化法计算各色谱峰的相对含量。利用Nist14谱库对采集到的质谱图进行检索。
1.4.4 抗氧化能力测定
挥发性成分的稀释与准备[12]:精确称取20 mg的葫芦巴叶挥发性提取物,加入一定量的DMSO,稀释成不同质量浓度。
1.4.4.1 总还原力的测定
取2.5 mL不同稀释度的样品提取液加入到装有2.5 mL磷酸缓冲液(0.2 mol/L,pH 6.6)的试管中,再加入2.5 mL的铁氰化钾溶液(1%)混合均匀反应后,50℃水浴20 min后,加入2.5 mL的三氯乙酸(1%),在4 000 r/min转速下离心10 min,取上清液5 mL,与4 mL的蒸馏水和0.5 mL的三氯化铁溶液(0.1%)混合,反应10 min后,在700 nm处测吸光度[12-13]。用相同浓度的抗坏血酸水溶液作为阳性对照,每组平行3次。
1.4.4.2 DPPH的清除作用
在3 mL DPPH无水乙醇溶液(0.1 mmol/L)中,加入1 mL不同质量浓度的挥发性样液,立即混匀,在室温条件下避光放置30 min后,于517nm处测定吸光值(A);以无水乙醇代替挥发性样液,测定吸光值(A0)[14]。用相同浓度的抗坏血酸水溶液作为阳性对照。每组平行3次。
DPPH自由基清除率的计算公式如下:

1.4.4.3 超氧阴离子自由基的清除作用
将1 mL不同质量浓度的挥发性样液分别与3 mL Tris-HCl(50 mmol/L,pH 8.2)混合,25℃恒温10 min,加入1 mL 25℃预热的邻苯三酚(6 mmol/L),迅速摇匀,于320 nm处测定吸光值(A)(每隔30 s测定一次),以无水乙醇代替挥发性样品,测定吸光值(A0)[15]。用相同浓度的抗坏血酸水溶液作为阳性对照。每组平行3次。
超氧阴离子自由基清除率计算公式如下:
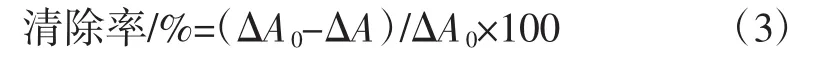
式中:ΔA0为邻苯三酚的自氧化速率,即未加样液时每分钟增加的吸光值;ΔA为加入样液后邻苯三酚的自氧化速率,即加入样液后每分钟增加的吸光值。
1.4.4.4 ABTS+自由基的清除作用
将 ABTS储备液(7.4 mmol/L)和过硫酸钾(2.6 mmol/L)按体积比1∶1混合,25℃下避光静置12 h,置于4℃下备用。取挥发性样液1 mL于试管中,加入4.5 mL的ABTS储备液(用无水乙醇将储备液稀释至734 nm处吸光值为0.7±0.02),立即混匀,室温下避光6 min,于734 nm处测定吸光值(A);以无水乙醇代替挥发性样液,测定吸光值(A0)[15]。用相同浓度的抗坏血酸水溶液作为阳性对照。每组平行3次。
ABTS+自由基清除率计算公式如下:
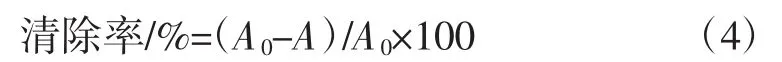
2 结果与分析
2.1 挥发性提取物得率与形态
按1.4.1萃取得到葫芦巴叶挥发性提取物的提取率为(0.373±0.098)%,25℃条件下葫芦巴叶挥发性提取物(见图2)为液态,呈淡黄色,具有特殊的芳香气味,持久性强,且带有刺激性。这可能是SDE萃取过程中有机溶剂(乙醚)的作用使挥发性提取物气味变得不纯正的缘故。
2.2 GC-MS成分分析结果
将SDE法萃取得到的挥发油按1.4.3在色谱和质谱条件下进行GC-MS分析,得总离子流(total ion current,TIC)色谱图见图3。采用1.4.3中GC-MS定性分析方法,对挥发油进行化学成分鉴定,采用色谱峰面积归一化法计算各化学成分的相对百分含量见表1,并对其进行化学成分分类见图4。

图2 SDE葫芦巴叶挥发性提取物Fig.2 Volatile chemical constituents from the leaf of Trigonella foenum-graecum L.by SDE
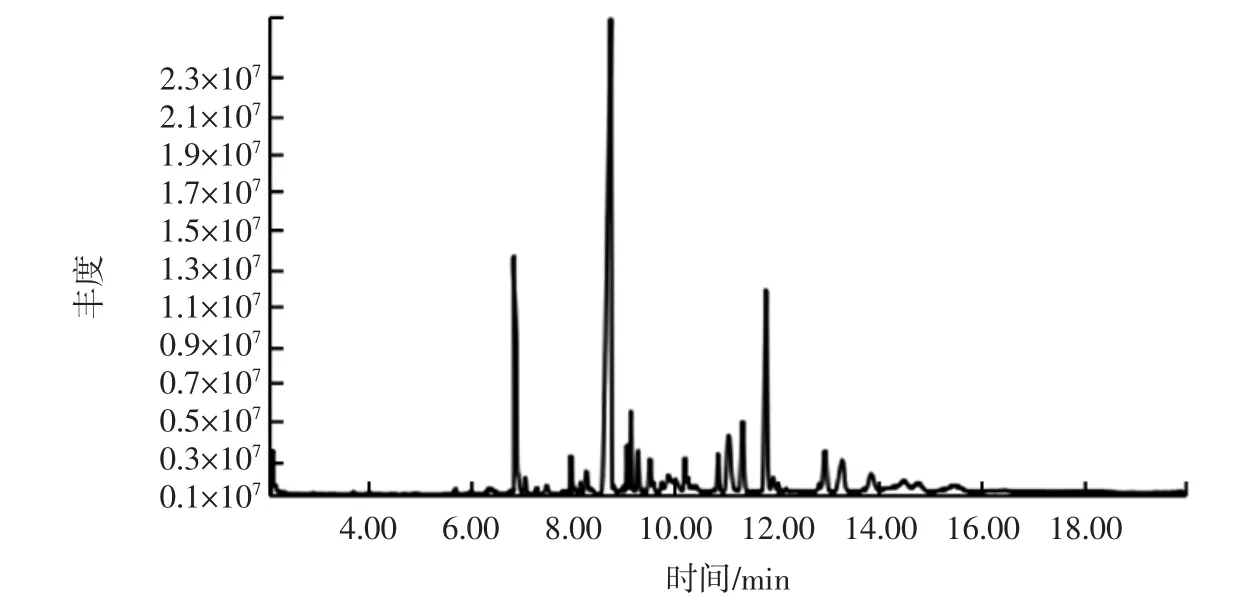
图3 葫芦巴叶挥发性成分的GC-MS总离子图Fig.3 Total ion flow diagram of volatile chemical constituents from the leaf of Trigonella foenum-graecum L.by GC-MS

表1 SDE葫芦巴叶挥发性成分Table 1 Volatile components in the leaf of Trigonella foenum-graecum L.
GC-MS结果显示,葫芦巴叶SDE挥发性中共检出25个色谱峰,鉴定出23种物质,占总量的96.497%。
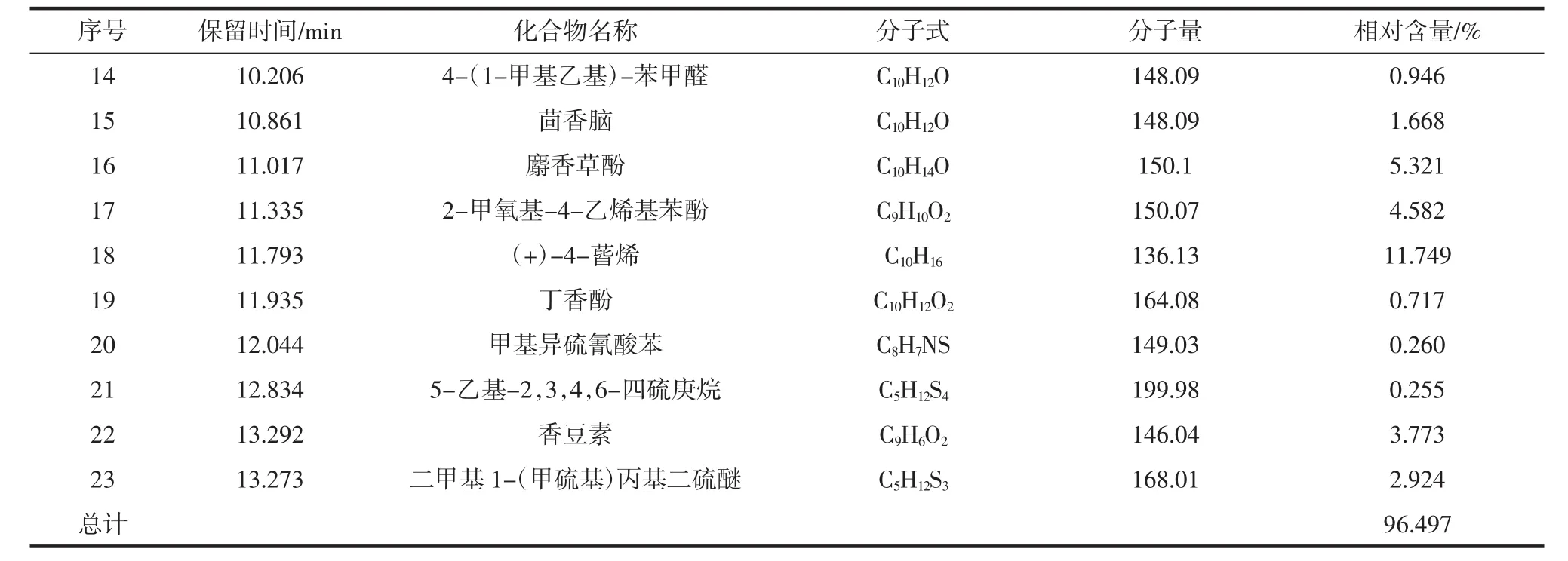
续表1 SDE葫芦巴叶挥发性成分Continue table 1 Volatile components in the leaf of Trigonella foenum-graecum L.

图4 葫芦巴叶挥发性成分的化学分类分布Fig.4 Chemincal class distribution of volatile components in the leaf of Trigonella foenum-graecum L.
由图4可以看出,其主要包括腈类、萜烯类、醇类、醛类、酚类、酯类、硫醚类、烷类等。其中,腈类1种(苄基腈),占42.914%,占比最大;其次为萜烯类3种,占 17.19%,包括(+)-4-蒈烯(11.749%)、香豆素(3.773%)和茴香脑(1.668%);醇类 5种,占 15.183%,包括桉叶醇(8.774%)、芳樟醇(1.903%)、苯乙醇(1.197%)、松油烯-4-醇(1.779%)和松油醇(1.530%);酚类3种,占10.62%,包括麝香草酚(5.321%)、2-甲氧基-4-乙烯基苯酚(4.584%)、丁香酚(0.717%);硫醚类4种,占7.010%,包括(Z)-仲丁基二硫醚、€-仲丁基二硫代二硫醚、二甲基1-(甲硫基)丙基二硫醚和二(1-甲基丙基)二硫化物;醛类3种,占1.829%,包括苯甲醛、苯乙醛、4-(1-甲基乙基)-苯甲醛;酯类1种(2-降冰片酯),占 0.575%;烷类 1种(5-乙基-2,3,4,6-四硫庚烷),占 0.255%;异硫氰酸类 1 种,(异硫氰酸甲基)-苯,占0.26%;其他1种,占0.661%。由表1可以看出,SDE挥发油中相对含量最高的化学成分是苄基腈(42.914%),其次为(+)-4-蒈烯(11.749%)、桉叶醇(8.774%)、麝香草酚(5.321%)、2-甲氧基-4-乙烯基苯酚(4.584%)和香豆素(3.773%)等。
本研究首次采用溶剂-蒸馏同时蒸馏法萃取葫芦巴叶中挥发性成分,与前人[16-17]对葫芦巴种子的研究结果有很大差异。
本研究从葫芦巴叶子中检出(+)-4-蒈烯(11.749%)、桉叶醇(8.774%)、麝香草酚(5.321%)、2-甲氧基-4-乙烯基苯酚(4.582%)和香豆素(3.773%),相对含量较高,这些物质已证实具有一定的生物活性,尤其表现出较强的抗氧化和抑菌活性[18-21]。
本研究首次在葫芦巴叶中发现含量极高的苄基腈(42.914%)。有研究报道,桔花精油[22]和茉莉精油中含有苄基氰;Huguette Agnaniet等在对五倍子精油和高斯核果木精油化学成的研究中发现,在提取挥发油过程中沸腾1 h后,仍含有29%的异硫氰酸苄酯,而蒸馏结束时其含量仅低于2%;且随着蒸馏时间的延长,苄基腈生成量越多[23]。苄基腈可能是氰化物离子与异硫氰酸苄酯反应生成的,异硫氰酸酯衍生物通常存在于十字花科植物中[24]。且在本研究中发现葫芦巴叶挥发性成分中存在有异硫氰酸类物质。因此,在本研究中鉴定出苄基腈是无疑的。
2.3 抗氧化活性的测定
2.3.1 总还原力
不同质量浓度的挥发性提取物和阳性对照的总还原力如图5所示。
由图5可知,葫芦巴叶挥发性提取物及对照组的总还原力随着浓度的增大而增强,呈剂量依赖效应,说明在一定浓度范围内,葫芦巴叶挥发性提取物的质量浓度越大则总还原力越强,但其剂量效应性关系显著低于VC。葫芦巴叶挥发性提取物在所试浓度范围(0.063 mg/mL~2.000 mg/mL)内吸光值从(0.192±0.019)升至 (0.338±0.012),而 VC(0.316±0.022)~(0.622±0.016)的变化更明显。一般情况下,吸光值越大,说明其还原力越大,抗氧化性则越强[25]。由图5可以看出,在相同浓度下挥发性提取物的总还原力明显小于VC。这说明葫芦巴叶挥发性提取物具有一定的氧化作用,但低于VC。
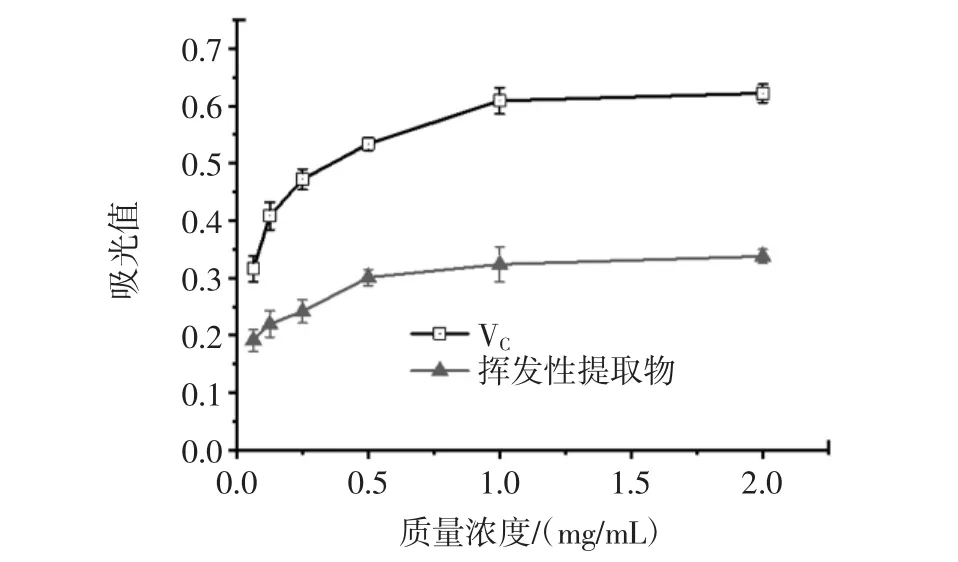
图5 挥发性提取物的总还原力Fig.5 The total reducing power of the volatile extracts
2.3.2 对DPPH自由基的清除作用
DPPH是很稳定的氮中心的自由基,其弧对电子在517 nm波长附近有强吸收,当有自由基清除剂存在时,弧对电子被配对,吸收消失或减弱。因此,通过测定吸收减弱的程度,来评价抗氧化剂的抗氧化活性。不同质量浓度的葫芦巴叶挥发性提取物和阳性对照对DPPH自由基清除率见图6。

图6 挥发性提取物的DPPH自由基清除率Fig.6 The clearance of DPPH free radical of the volatile extracts
由图6可知,葫芦巴叶挥发性提取物对DPPH自由基具有一定的清除作用,且随着样品质量浓度的增加其清除作用增强,两者呈明显的量效关系。葫芦巴叶挥发性提取物在所试浓度范围(0.25 mg/mL~8.00 mg/mL)内对DPPH自由基的清除率从(3.088±0.995)%升至(46.065±1.723)%,而VC(5.623±1.082)%~(91.311±2.506)%的变化更为明显。在质量浓度为8.0%时,葫芦巴叶挥发性提取物对DPPH自由基的清除率为(46.065±1.723)%,而 VC可达到(91.311±2.506)%,葫芦巴叶挥发性提取物对DPPH自由基的清除率远低于VC。
2.3.3 超氧阴离子自由基的清除作用
不同质量浓度的葫芦巴叶挥发性提取物和阳性对照对超氧阴离子自由基的清除率见图7。
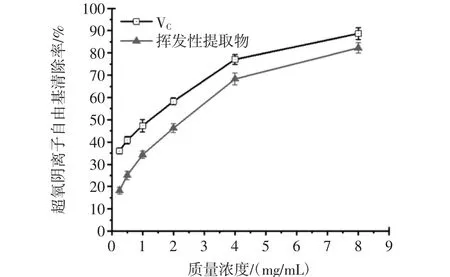
图7 挥发性提取物超氧阴离子自由基的清除作用Fig.7 The cleanance of super oxide anion free radical scavenging of the volatile extracts
由图7可以看出,葫芦巴叶挥发性提取物随着质量浓度的增大而增大,具有明显的量效关系。葫芦巴叶挥发性提取物在所试浓度范围(0.25 mg/mL~8.00 mg/mL)内对超氧阴离子自由基的清除率从(18.162±1.532)%升至(82.239±2.304)%,与VC(36.020±1.341)%~(88.670±2.595)%相比,其变化更为明显。由图8可以看出,当质量浓度为8.0 mg/mL时,挥发性提取物对超氧阴离子自由基的清除率可达到(82.239±2.304)%,VC为(88.670±2.595)%。两者清除超氧阴离子自由基的能力趋于近似。
2.3.4 ABTS+自由基的清除作用
不同质量浓度的葫芦巴叶挥发性提取物和阳性对照对ABTS+自由基的清除率见图8。

图8 挥发性提取物的ABTS+的清除作用Fig.8 The cleavance of ABTS+free radical scavenging
由图8可以看出,葫芦巴叶挥发性提取物随着质量浓度的增大而增大,具有明显的量效关系。葫芦巴叶挥发性提取物在所试浓度范围(0.016 mg/mL~0.500 mg/mL)内对 ABTS+自由基的清除率从(40.892±0.973)%升至(91.239±2.565)%,与VC[(68.033±1.163)%~(95.015±1.595)%]相比,其变化更为明显。由图8可以看出,当质量浓度为0.125 mg/mL时,挥发性提取物对ABTS+自由基的清除率趋于平缓,约为90%;而VC对ABTS+自由基的清除率在其质量浓度为0.063 mg/mL时达到最大值,随着浓度的增加几乎无显著变化。
3 结论
同时蒸馏萃取法提取得到的葫芦巴叶挥发性物质为液态,呈淡黄色,得率为0.37%,具有浓郁的芳香气味且略带刺激性。GC-MS分析结果显示,同时蒸馏萃取法共检出25种物质,主要包括腈类、萜烯类、醇类、醛类、酚类、醚类等。其中,腈类有1种,占总含量的42.914%,占比最大;含量最多的为苄基腈(42.914%),其次为(+)-4-蒈烯(11.749%)、桉叶醇(8.774%)和麝香草酚(5.321%)等。大部分为分子质量200以下的小分子物质。
葫芦巴叶挥发性物质总还原力、对DPPH自由基、超氧阴离子自由基(O2-·)、ABTS+自由基的清除能力与质量浓度均呈量效关系,但总体上,其抗氧化能力较阳性对照VC小。

