中药复方鹿角胶丸防治绝经后骨质疏松症的机制研究
于冬冬 赵丹阳 杨芳 杨鸫祥 杨关林*
1.辽宁中医药大学,辽宁 沈阳 110847 2.沈阳市第一人民医院,辽宁 沈阳 110041 3.辽宁中医药大学附属医院,辽宁 沈阳 110032
绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)发病机理复杂,常规药物长期服用依从性差,新药价格昂贵,难以普及[1]。中医治疗PMOP历史悠久,更能从整体上把握,从而辨证施治,拥有更广阔的前景。
PMOP主要是由于雌激素的撤退导致的骨量的减少、骨的脆性增加,其发病机制与成骨和破骨的不平衡密切相关,即成骨细胞的成骨分化能力减退,破骨细胞的活性增强[2]。因此,促进骨形成的同时抑制骨吸收仍然是目前防治PMOP的重点所在[3]。
《太平圣惠方》中的鹿角胶丸具有防治骨质疏松症的药理学作用[4]。方中鹿角胶平补肾气,杜仲、牛膝、菟丝子补益肾精,肉桂健补脾胃,滋养后天生化之源,熟地以养血,共起填精益气之功效,但鹿角胶丸对PMOP是否具有防治作用目前还没有研究。本研究旨在探讨鹿角胶丸对PMOP的防治效果及潜在机制,为临床应用中药防治PMOP提供实验依据。
1 材料和方法
1.1 材料
1.1.1实验动物:健康SPF 级雌性SD 大鼠80只,3个月月龄,体质量(300±10) g,购自辽宁长生生物技术有限公司[许可证号 SCXK(辽)2015-0001]。
1.1.2药物及试剂:(1)实验药物。中药复方鹿角胶丸均在辽宁中医药大学附属医院购买,组成:由鹿角胶3 g,附子10 g,肉桂5 g,杜仲10 g,山茱萸10 g,菟丝子12 g,熟地黄10 g,肉苁蓉10 g,五味子5 g,牛膝10 g,巴戟天5 g。将药制备为水煎剂,生药量为1 g/mL。仙灵骨葆胶囊(贵州同济堂制药,国药准字号:Z20025337);福善美(阿仑膦酸钠,默沙东公司,进口药品注册证号H20130241)。(2)实验试剂。苏木素伊红(HE)染色试剂盒(碧云天公司,中国);Human β-CTX ELISA检测试剂盒(PHICON Biotech公司,中国);Human P1NP ELISA检测试剂盒(PHICON Biotech公司,中国);SABC免疫组化染色试剂盒(武汉博士德,武汉);DAB 显色试剂盒(武汉博士德,武汉);Runx 2(Abcom,美国);Cathepsin K(Abcom,美国)。
1.1.3实验仪器:Micro CT(比利时,Bruker SkyScan 1174);小动物辐照仪(美国,X-RAD 320);显微镜(日本,OLYMPUS);AMR-100酶标仪(中国,杭州奥盛仪器)。
1.2 方法
1.2.1动物分组、造模、给药:(1)分组。用电子天平先称量大鼠的体重范围,按随机数字表法分为8组,各组10只。A组:正常组(Control组);B组:假手术组(Sham);C组:模型空白组(去卵巢组,OVX组);D组:中药复方组:高、中、低3个剂量组(鹿角胶丸组,LJJW-H、LJJW-M、LJJW-L 组);E组:中药对照组(仙灵骨葆组,XLGB组);F组:西药对照组(福善美组,FSM组)。(2)去卵巢大鼠模型(ovariectomized rat model,OVX)的建立、取血清及骨组织。动物的饲养、OVX模型的建立按照课题组前期的实验方法[5]。末次灌胃后,经24 h禁食,将大鼠麻醉成功后,逐步显露腹主动脉及其分叉,缓慢抽吸腹主动脉内血液注入采血管内,离心取上清液,分装1.5 mL EP管内,冻存备用。剔出双侧股骨,医用纱布包裹,外包锡纸,-70 ℃冰箱冻存,待测骨密度。(3)给药剂量与方法。大鼠等效剂量按成人用药量的6.3倍计算(成人体质量按70 kg计算)。给药容积:1 mL/100 g体质量。Control、Sham、OVX组给予等体积的0.9%氯化钠溶液;中药复方组予鹿角胶丸水煎剂;中药对照组用仙灵骨葆胶囊水溶液;西药对照组用福善美水溶液,调成1 g/mL的药物溶液。造模开始后给药,每日上午、下午各灌胃给药1次,连续9周。每周称大鼠体质量1次,根据其变化调整给药剂量。
1.2.2DEXA、Micro-CT、HE染色检测骨密度及骨结构:(1)使用DEXA骨密度检测仪及系统自带骨密度分析软件测定大鼠的全身、脊柱及下肢的BMD (g/cm2);(2)将股骨标本置于10%福尔马林中固定24 h 后进行micro-CT 扫描。对所有扫描图片进行3D重建,并使用系统分析软件计算松质骨的骨体积分数(BV/TV)、结构模式指数(structural mode index,SMI)、骨小梁数量(Tb.N)及BMD(Tb.Sp)[6];(3)骨组织脱钙、石蜡包埋、切片、脱蜡,苏木素染色液染色,伊红复染,二甲苯透明、中性树胶封片,常温晾干,显微镜下拍片并保存。
1.2.3ELISA法检测骨代谢指标:β-CTX、PINP试剂盒,放置恢复室温,按照说明书进行分组加样,37 ℃温育箱中避光、缓慢水平均匀摇晃、温浴60 min,孔内均加满洗涤液,放置30 min后弃掉。加试剂盒内A、B液,轻轻摇晃混匀显色,加入终止液50 μL,终止试剂反应。最后测定吸光度,450 nm波长测量吸光度(OD值)。绘制标准曲线的回归方程,计算出β-CTX、PINP的浓度。
1.2.4骨组织免疫组化、Western Blot测定相关蛋白表达:(1)骨组织切片脱蜡、抗原修复、血清封闭、一抗孵育过夜、二抗标记,DAB显色液,显微镜下观察,阳性信号为棕黄色或棕褐色,苏木素复染、固定封片及检测;(2)提取骨组织蛋白、上样、转膜、封闭、一抗孵育过夜、辣根过氧化物酶(HRP)标记二抗孵育、ECL发光成像,Image J软件测定平均灰度值。
1.3 统计学分析
采用SPSS 13.0软件进行统计分析,数据以均数±标准差表示,组间比较采用ANOVA方法,若满足正态分布,但不满足方差齐性条件,采用配对t检验;若数据不符合正态分布,采用秩和检验。P<0.05为差异有统计学意义。
2 实验结果
2.1 大鼠BMD检测结果
双能X线检测各组大鼠的骨密度(图1 A),结果显示,Control、Sham组的骨密度为(0.25±0.01) g/cm2、(0.26±0.01) g/cm2(Control组图中未显示),OVX组骨密度为(0.18±0.01) g/cm2,鹿角胶丸低剂量组、中剂量组、高剂量组分别是(0.20±0.01) g/cm2、(0.23±0.02) g/cm2、(0.21±0.02) g/cm2(图中显示LJJW-M组),XLGB组为(0.21±0.01) g/cm2,FSM组为(0.22±0.03) g/cm2(图中未显示)。相比于Sham组,OVX组大鼠的BMD明显降低(P<0.05)(图1B)。相对于OVX组,LJJW-H、LJJW-M、LJJW-L、XLGB、FSM组的骨密度均有改善,说明各个处理组均有提高绝经后大鼠骨密度的药理学作用,但作用效果不尽相同,其中以LJJW-M组的骨密度提高最明显(P<0.05),其次是FSM组(P<0.05),LJJW-H和XLGB组的提高骨密度的效果相似,LJJW-L的骨密度改善效果最差,结果提示鹿角胶丸具有提高去卵巢大鼠BMD的药效学作用。

图1 鹿角胶丸提高OVX大鼠的骨密度Fig.1 Improvement of bone mineral density in OVX rats with deer horn glue pill注:与OVX相比,※P<0.05;与Sham组相比,△P<0.05。
2.2 HE染色结果
HE染色检测各组骨组织结构的改变,Sham组大鼠骨小梁结构完整、无断裂,骨小梁形态排列紧密、所占骨面积的比例大,骨髓腔比例相对小(图2)。OVX组骨小梁形态破坏明显、出现明显断裂,骨小梁排列紊乱,髓腔空洞较多,骨小梁面积百分比(Tb.Ar%)明显下降(P<0.05,与Sham组比较)。相对于模型OVX组,LJJW-H、LJJW-M、LJJW-L、XLGB、FSM组骨小梁含量明显增多、增宽,骨小梁断裂明显减少,排列略整齐,髓腔减小。但是仍未有达到正常组及Sham组的标准。各药物处理组中以其中LJJW-M组表现尤为明显(P<0.05,与OVX组比较)。

图2 HE染色检测各组大鼠骨组织结构的改变Fig.2 HE staining to detect the changes of bone tissue structure in each group注:与OVX相比,※P<0.05;与Sham组相比,△P<0.05。
2.3 大鼠血清β-CTX、PINP含量的改变
2.3.1ELISA法测定大鼠血清中PINP含量:OVX组血清中PINP含量降低(P<0.05,与Sham组相比),表明大鼠骨代谢处于骨形成抑制的状态(图3)。LJJW各处理组的PINP值都高于OVX组,尤其以LJJW-M组升高的最明显(P<0.01,与OVX组相比)。XLGB组亦能升高血清中PINP值(P<0.05,与OVX组相比)。FSM组对血清中的PINP值影响不明显。
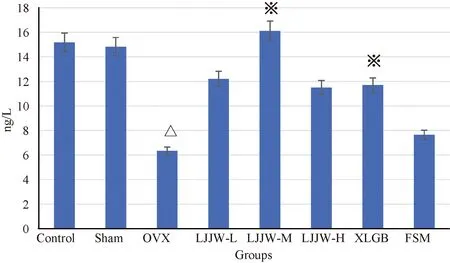
图3 中药复方鹿角胶丸提高OVX大鼠的PINP值Fig.3 Improvement of PINP value in OVX rats with deer horn glue pill注:与OVX相比,※P<0.05;与Sham组相比,△P<0.05。
2.3.2ELISA法测定大鼠血清中β-CTX含量:与Sham组相比,OVX组血清中β-CTX含量升高(P<0.05),LJJW各处理组的β-CTX值都低于Sham组(图4)。与OVX组相比,P<0.05。

图4 中药复方鹿角胶丸降低OVX大鼠的β-CTX值Fig.4 Reduction of β-CTX in OVX rats with deer horn glue pill注:与OVX相比,※P<0.05;与Sham组相比,△P<0.05。
2.4 Micro-CT检测结果
Micro-CT检测大鼠股骨结构的改变(图5)。与Sham组相比,OVX组股骨Micro CT 指标的BMD、BV/TV和Tb.N分别降低了68.08%、71.89%和61.54%,而SMI上升39. 34%。LJJW-M给药组明显改善骨小梁的情况,骨小梁的数量明显增多,破坏减少,相对于模型组来说,XLGB组的骨密度及骨小梁的情况也有所改善,但是改善的幅度及效果不如中药处理组。与OVX相比,BMD值LJJW-M组P<0.01,XLGB组P<0.05。Tb.N值LJJW-M组P<0.05,XLGB组P<0.05。
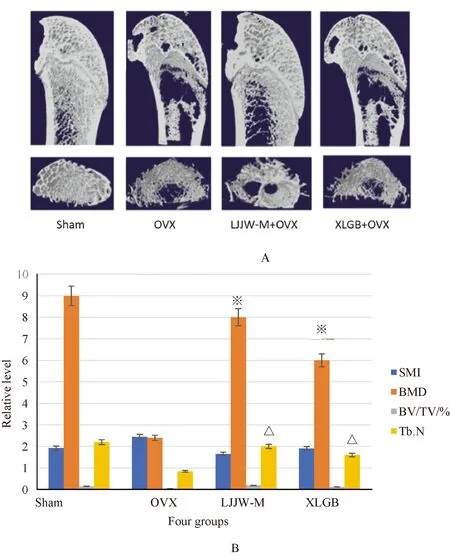
图5 中药复方鹿角胶丸改善骨结构Fig.5 Deer horn glue pill improves bone structure注:*:与OVX相比,LJJW-M组P<0.01,XLGB组P<0.05;△:与OVX相比,LJJW-M组P<0.05,XLGB组P<0.05。
2.5 Western blot 检测结果
2.5.1成骨相关蛋白Runx 2的表达:OVX大鼠予鹿角胶丸中药复方(LJJW-M)干预12周后,OVX组Runx 2的表达明显降低(P<0.05,与Sham组相比较)(图6),而LJW-M处理组的Runx 2表达相对升高(P<0.05,与OVX组相比较),但是没有恢复到对照组的水平,而XLGB组的Runx 2的表达与LJJW-M相似(P<0.05,与OVX组相比较)。

图6 中药复方鹿角胶丸促进Runx 2蛋白表达Fig.6 Promotion of the expression of Runx 2 protein with deer horn glue pill注:*:与OVX相比,LJJW-M组P<0.05,XLGB组P<0.05;△:与Sham相比,P<0.05。
2.5.2破骨相关蛋白Cathepsin K的表达:OVX大鼠予鹿角胶丸中药复方(LJJW-M)干预12周后,与Sham组相比,OVX组的Cathepsin K表达明显升高(P<0.01,与Sham组相比较)(图7)。而LJW-M处理组的表达相对减低(P<0.01,与OVX组相比较),甚至低于普通的水平,而FSM组的Runx2的表达与LJJW-M相似(P<0.05,与OVX组相比较)。

图7 鹿角胶丸抑制Cathepsin K蛋白表达Fig.7 Prohibition of the expression of Cathepsin K protein with deer horn glue pill注:*:与OVX相比,LJJW-M组P<0.01,XLGB组P<0.05;△:与Sham相比,P<0.01。
2.6 免疫组化检测结果
免疫组织化学法进一步检测成骨相关通路蛋白Runx2的表达。结果显示,对照组松质内骨细胞内有一定的Runx 2的蛋白表达(棕色颗粒,箭头所示)(图8)。与Sham组比较,OVX组的Runx 2的蛋白表达明显减少,鹿角胶丸中药复方(LJJW-M)处理OVX大鼠一定时间(12周)后,Runx2的表达相对增多(P<0.01,与OVX组相比较),但是没有恢复到对照组的水平,而XLGB组的Runx2的表达亦增加,但表达低于LJJW-M处理组(P<0.05,与OVX组相比较)。

图8 鹿角胶丸促进Runx 2蛋白表达Fig.8 Promotion of the expression of Runx 2 protein with deer horn glue pill注:与OVX相比,*P<0.01;与OVX相比,△P<0.05。
3 讨论
PMOP主要是由于雌激素的撤退导致的骨量的减少、骨的脆性增加、骨折风险性增加的一种疾病,随着人口的老龄化,该病的发病率及致残致死率也在逐年提升[1-2]。
《黄帝内经》中记载:“肾者,主骨生髓”“肾主藏精”,补肾填精仍是治疗PMOP的主要治则。研究发现,在应用鹿角胶丸对骨质疏松模型大鼠干预的研究中,与对照组相比较鹿角胶丸能够明显增加骨密度,促进骨形成,抑制抑制骨吸收[4]。鹿角粉制成的颗粒具有补钙,温肾阳,强筋骨等功效[7]。
本研究对鹿角胶丸防治PMOP的药理学作用及其潜在机制进行进一步研究发现,鹿角胶丸能够提OVX大鼠骨密度,其中以LJJW-M组的骨密度提高最明显,结果提示鹿角胶丸具有提高去卵巢大鼠BMD的药效学作用。随后,应用Micro-CT、HE染色检测各组骨组织结构的改变,模型组骨小梁形态破坏明显、出现明显断裂,骨小梁排列紊乱,髓腔空洞较多。LJJW-M处理组骨小梁含量明显增多、增宽,骨小梁断裂明显减少,排列略整齐,髓腔减小,LJJW-M组提高OVX大鼠BMD、BV/TV 和Tb.N,降低SMI值,说明鹿角胶丸具有改善骨结构、增加骨强度的药理学作用。
PMOP发生的过程中,血清中的相关股形成及骨吸收的检测标记也随之发生改变[8],LJJW各处理组的β-CTX值都低于Sham组,尤其以LJJW-M组降低的最明显,说明鹿角胶丸能够降低OVX大鼠血清中β-CTX水平、抑制骨吸收。模型组血清中PINP含量降低,LJJW各处理后PINP升高,说明LJJW能够提高血清中PINP、促进骨形成。
Runx 2是骨形成重要的通路调节蛋白[9],OVX组的Runx2表达明显降低,而LJW-M处理组的Runx 2表达相对升高,但是没有恢复到正常水平。Cathepsin K是破骨细胞吸收活性的重要调节蛋白[10], Cathepsin K的表达在OVX组明显升高,而LJW-M能够抑制其表达,甚至低于对照水平。说明鹿角胶丸可能通过对成骨及破骨的双重调节,进而达到防治PMOP的目的。
本研究从动物体内的角度探讨鹿角胶丸对PMOP的防治效果及潜在的作用机制,发现鹿角胶丸具有防治PMOP的药理学作用的同时,且可能通过调节成骨及破骨的双重作用完成的,本研究丰富了中医防治PMOP的科学内涵,并为该药应用于临床防治PMOP提供实验依据。

