染色体微阵列分析技术在先天性心脏病胎儿产前遗传学诊断中的应用价值*
马 威,魏 波,张慧萍
宁夏医科大学总医院产前诊断中心(银川750004)
先天性心脏病(Congenital heart disease,CHD)是目前最常见的出生缺陷疾病,占各种主要先天性疾病的1/3左右[1-2]。CHD是导致新生儿非感染性死亡的重要原因之一,尽管随着心脏外科技术的不断发展,大部分CHD经手术可获得良好的治疗效果。但在一些遗传综合征,CHD仅作为其表型之一,即使外科手术可以纠正心脏解剖异常,但患者术后仍无法获得满意的生活质量[3]。因此,通过遗传学诊断,了解CHD的遗传学病因具有重要的临床意义。染色体微阵列分析(Chromosome microarray analysis,CMA)技术是一种高分辨率、高通量并且可以在全基因组水平检测染色体不平衡拷贝数变异(Copy number variation,CNV)的技术[4-5]。目前CMA以其高分辨率的检测能力被迅速地应用于产前遗传诊断,本研究通过应用高分辨率基因芯片对76例CHD胎儿进行全基因组分析,以探讨CMA在CHD胎儿产前遗传诊断中的应用价值。
资料与方法
1 一般资料 选取2018年4月至2019年12月就诊于宁夏医科大学总医院产前诊断中心的孕妇76例。病例纳入标准:均经超声提示CHD胎儿;均为单胎妊娠;均进行产前遗传咨询并自愿进行侵入性产前诊断(核型分析+CMA检测);本研究取得患者知情同意并签署知情同意书。排除标准:有病毒感染史或明显致畸物质接触史者;只进行常规染色体核型分析或CMA检测之一者。根据上述标准共纳入76例孕妇,年龄21~36岁,平均(29.14±7.20)岁;孕周17~28周,平均(22.58±5.93)周。
2 研究方法
2.1 超声检查:采用飞利浦IU22、GEE8超声仪,探头频率2.5~6 MHz,所有孕妇常规进行超声检查,怀疑胎儿患有CHD时,对孕妇进行胎儿超声心动图检查,按照胎儿心脏检查标准规范进行系统扫查。
2.2 样本采集:对孕周17~28周的孕妇行超声定位下羊膜腔穿刺术,抽取羊水25~30 ml,其中20 ml用于细胞培养染色体核型分析,其余5~10 ml用于CMA检测。对孕周24周以上的孕妇在超声引导下抽取脐带血3 ml,其中1.5 ml用于细胞培养及染色体核型分析,其余1.5 ml用于CMA检测。
2.3 染色体制片及核型分析:于无菌操作条件下将抽取的羊水或脐血加入到无菌离心管内,离心收集羊水或脐血细胞,采用贴壁细胞培养法培养10~14 d,见细胞生长良好加入秋水仙碱,收集羊水或脐血细胞,常规制片,G显带后玻片置于GSL-120自动染色体扫描仪进行扫描分析。
2.4 CMA检测:采集的羊水或脐血样本均采用DNA提取试剂盒(德国Qiagen公司)提取基因组DNA。根据Cyto Scan HD芯片(美国Affymetrix公司)检测流程,依次进行基因组DNA消化、连接、扩增、纯化、片段化、标记、杂交、洗涤及扫描,应用ChAS软件进行数据分析。1 M芯片所检测到的>1 kb的片段缺失或重复,定义为CNV,结果判读参照DGV、ISCA、OMIM、ECIPHER等数据库。
3 统计学方法 使用SPSS 20.0统计学软件进行数据统计分析,计数资料采用率表示,用χ2检验;所有检验均采取双侧检验,检验水平α=0.05。
结 果
1 76例CHD胎儿超声检查情况 76例CHD胎儿超声提示的心脏畸形包括:房(室)间隔缺损、主动脉缩窄、肺动脉闭锁、三尖瓣异常、永存左上腔静脉、心内膜垫缺失、心包积液、法洛四联症。其中单一心脏畸形、多发心脏畸形和合并心外畸形的比例见表1。

表1 76例胎儿CHD表型分类
2 染色体核型分析结果 76例CHD胎儿共检出11例(14.47%)染色体核型异常,其中21-三体综合征3例,18-三体综合征4例,标记染色体(47,XY,+mar)2例,臂间倒位[46,XY,inv(9)(p11q13)]1例,平衡易位[46,XX,t(3;7)(p21;q23)]1例。
3 CMA检测结果 76例CHD胎儿受检样本CMA共检出15例(19.74%)异常,均为已知的致病性异常,其分布情况见表2。

表2 CMA检测异常情况
4 CMA检测结果与染色体核型分析结果比较 CMA和染色体核型分析对不同心脏畸形CHD胎儿致病性异常检出率比较均无统计学差异(P>0.05),见表3。染色体核型分析致病性异常的检出率为14.47%,CMA致病性异常的检出率为19.74%,相较染色体核型分析,CMA能够将致病性异常的检出率提高5.26%(4/76),但两者比较差异无统计学意义。CMA对合并心外畸形组致病性CNV检出率显著高于单一心脏畸形组(χ2=0.610,P=0.017)。
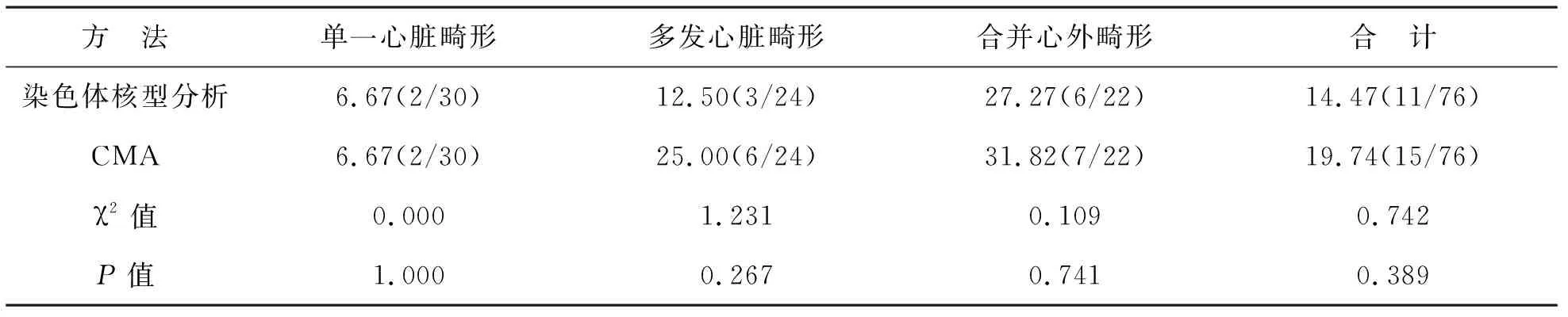
表3 CMA检测结果与染色体核型分析致病性异常检出情况比较 [%(例)]
讨 论
临床常见的CHD包括房室间隔缺损、永存左上腔静脉、心包积液、肺动脉狭窄、法洛四联症、动脉导管未闭、二尖瓣闭锁不全、三尖瓣反流、血管环等[6]。是目前最常见的先天畸形,也是目前婴幼儿死亡的首要原因。CHD的发病原因尚不明确,目前的观点主要认为是遗传因素、环境因素及两者共同作用有关[7-8]。有研究表明,约40% CHD是由遗传因素导致的,主要包括染色体畸变、单基因病、多基因遗传缺陷等。通过运用超声检查可发现胎儿心脏发育异常以及有可能提示胎儿异常的“软指标”,进而提示胎儿染色体变异[9]。出生缺陷的防治应以预防为主,产前超声筛查胎儿心脏结构畸形,进而应用细胞遗传学及分子遗传学诊断胎儿的病因及发病机制,有助于完善围产期监测和诊疗措施,改善先心病患儿的预后,降低病死率。
目前胎儿染色体核型分析技术仍然是产前细胞学诊断的金标准,尽管G显带核型分析分辨率不断提升,但对于5 Mb及以下的微缺失和微重复,染色体核型分析仍无法检出。CMA技术又被称为“分子核型分析”,据探针类型不同可将CMA分为基于微阵列的比较基因组杂交(aCGH)技术和单核苷酸多态性微阵列(SNP array)技术,CMA能够在全基因组水平进行扫描,可检测亚显微水平的缺失和重复,即CNV[9-10]。有研究[11-12]指出,在一些伴有明显异常超声表现的胎儿,其染色体核型分析结果并无异常,但CMA可以发现约10%具有临床意义的CNV。
本研究中所采用SNP array技术平台,应用CytoScan 750K芯片,能准确检测出100 kb以上CNV。本研究中收集的76例CHD胎儿羊水、脐血样本,采用CMA技术检测均获得检测结果,而在染色体核型分析过程中,2例(2.63%)因细胞培养失败未获得检测结果,染色体核型分析需要经过羊水、脐血细胞培养,存在培养失败的风险,而CMA则无需这一步骤。本研究中CMA共检出15例(19.74%)异常,且均为已知的致病性异常,Zhu等[13]在115例CHD胎儿中检出21例(18.26%)的致病性CNV,和本研究较为接近。本研究中CMA未发现假阳性结果,相比染色体核型分析能够将致病性异常的检出率提高5.26%(4/76)。田雨等[14]研究中CMA将染色体异常检出率提高了3.53%,略低于本研究结果,考虑与不同研究样本构成差异及检验人员操作因素相关。在染色体核型分析检出的11例异常胎儿中,除外21-三体综合征3例和18-三体综合征4例,余4例CHD胎儿经染色体核型分析均无法对其致病性及临床预后进行综合判断,而CMA则能明确染色体来源、片段大小及其致病性[15]。本研究中2例额外小标记染色体均经CMA确诊为22q11.1微重复1例,1例平衡易位经CMA检测为致病性亚显微结构缺失。由此可见,CMA技术能弥补染色体核型分析在染色体亚显微改变检测方面的不足,对遗传咨询中CHD胎儿预后的评估更为有利。本次研究中,合并心外畸形组致病性CNV检出率(31.82%,7/22)显著高于单一心脏结构畸形组(6.67%,2/30),提示对于合并心外畸形的CHD胎儿CMA检测尤为必要。
综上所述,CMA在CHD胎儿遗传学诊断中具有重要的应用价值,相较于核型分析,该技术能够将遗传学病因检出率额外提高5.26%,对于核型分析正常的CHD胎儿进一步行CMA检测有助于正确评估胎儿预后。

