湖北荆门地区2698例女性HPV感染情况及基因分型调查研究
周 成,柴艳梅,陈 蓉,黄文峰
湖北省荆门市第二人民医院(荆门 448000)
宫颈癌是妇科常见的恶性肿瘤,发病率较高,在全球女性恶性肿瘤病死率中排第2位,每年新增病例超过50万例,其中发展中国家占比超过80%[1]。研究表明人乳头状瘤病毒(Human papillomavirus,HPV)的持续性感染与宫颈病变密切相关[2]。HPV是一类特异感染人类上皮、黏膜的微小共价双链环状DNA病毒[3],至今发现有200多种,其中约40种与生殖道感染相关,根据其致病性的强弱,可分为高危型HPV和低危型HPV两种[4]。其中高危型HPV持续感染是宫颈癌发生的必要条件[5],因此高危型HPV的检测,是宫颈癌初期筛查的重要手段。本研究通过对荆门市第二人民医院就诊患者HPV感染情况、型别分布以及感染情况与年龄的相关性进行分析,为荆门地区宫颈癌筛查及预防工作提供参考。
对象与方法
1 研究对象 收集2017年1月至2019年6月在荆门市第二人民医院妇科门诊、住院和体检的2698例女性的宫颈脱落细胞标本进行回顾性分析。病例纳入标准:①年龄17岁以上;②已婚或有性生活史1年以上。排除标准:①妊娠期及哺乳期妇女;②有宫颈锥切及子宫切除史;③有免疫性疾病及口服免疫抑制剂史;④检查前3 d有阴道用药或阴道冲洗,24 h内有性生活等;⑤心功能不全及肝、肾功能障碍者;⑥高血压、糖尿病等慢性疾病者;⑦恶性肿瘤者等。患者年龄17~85岁,平均(40.9±10.2)岁。本研究获得荆门市第二人民医院伦理委员会批准。
2 研究方法 对所有的宫颈脱落细胞标本采用医用核酸分子杂交系统HHM-2及配套的HPV21分型检测试剂盒(PCR+膜杂交法)(潮州凯普生物化学有限公司)进行HPV分型检测,具体操作严格按照说明书进行,包括扩增试剂准备、样本DNA提取、PCR扩增、导流杂交和酶标显色。宫颈液基细胞学检查方法(TCT)诊断标准采用2001年TBS(The 2001 Bethesda System)分级系统进行细胞学诊断[6]。
3 观察指标及评价标准 以各个型别HPV阳性例数占检测总例数的百分比为各型别HPV的感染率。HPV型别及高低危划分参考2015年CFDA发布的《人乳头瘤病毒(HPV)核酸检测及基因分型试剂技术审查指导原则》。本研究包含15种高危型HPV:16、18、31、33、35、39、45、51、52、53、56、58、59、66、68;6种低危型HPV:6、11、42、43、44、CP8304(81)。以划分的每个年龄段内HPV阳性总例数占检测总例数的百分比统计不同年龄段HPV感染的阳性率。阳性结果成立条件:杂交膜条上的Biotin对照显色、同时HPV杂交点也显色,检测结果阳性点为清晰可见的蓝紫色圆点。任何一种HPV亚型阳性为HPV感染,两种或以上HPV亚型阳性为多重感染,多重感染重复计算。
4 统计学方法 运用PEMS 3.0统计学软件进行统计分析,计数资料采用百分率(%)表示,比较采用χ2检验,以P<0.05为差异有统计学意义。
结 果
1 HPV感染率及基因型分布情况 2698例标本HPV总阳性率为27.58%(744/2698),高危型HPV感染率为23.98%(647/2698),低危型HPV感染率为3.60%(97/2698)。高危型HPV阳性人群以52型、16型、58型、39型、53型、51型最多,占总例数百分比依次为4.74%(128/2698)、4.04%(109/2698)、3.48%(94/2698)、2.22%(60/2698)、1.96%(53/2698)、1.67%(45/2698),6种型别占总例数的百分比为18.12%(489/2698)。见表1。
2 不同年龄段HPV感染情况 将2698例标本按年龄分为≤25岁、26~35岁、36~45岁、46~55岁、>55岁5个组。各年龄段HPV阳性率依次为28.35%(36/127)、18.96%(142/749)、18.42%(165/896)、22.40%(164/732)、31.44%(61/194)。≤25岁组HPV阳性率高于26~35岁、36~45岁组,且差异有统计学意义(χ2=5.991,P<0.05;χ2=6.949,P<0.01),但与46~55岁、>55岁组阳性率之间比较无统计学差异(χ2=2.139,P>0.05;χ2=0.349,P>0.05)。 26~35岁组HPV阳性率与36~45岁、46~55岁比较无统计学差异(χ2=0.079,P>0.05;χ2=2.681,P>0.05),但显著低于>55岁组HPV阳性率(χ2=14.221,P<0.01)。36~45岁、46~55岁、>55岁HPV阳性率随年龄增长呈递增趋势,且两两之间比较均具有统计学差异(均P<0.05)。见表2。

表1 宫颈感染HPV基因型分布
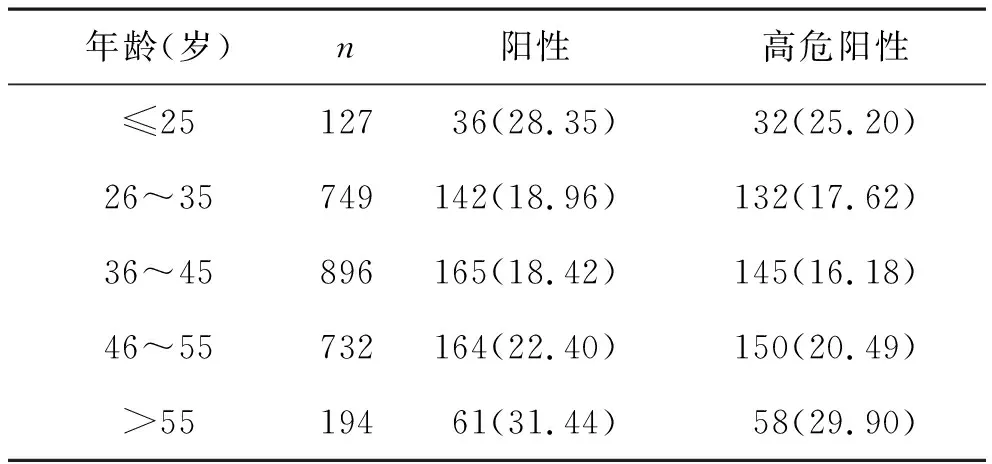
表2 不同年龄段HPV感染率[例(%)]
3 不同程度宫颈病变HPV亚型感染情况 在744例HPV阳性患者中,正常/炎症组、ASCUS/LSIL组、HSIL/宫颈癌组分别为519例、194例、31例。ASCUS/LSIL组高危HPV感染率为87.32%,HSIL/宫颈癌组的高危HPV感染率为93.55%,两组比较,差异有统计学意义(χ2=4.328,P<0.05)。正常/炎症组前3位HPV基因型依次为HPV-52、58、16;ASCUS/LSIL组前3位HPV基因型依次为HPV-16、52、58:HSIL/宫颈癌组前3位HPV基因型依次为HPV-16、18、52、58。HSIL/宫颈癌组的HPV-16感染率高于ASCUS/LSIL组,差异有统计学意义(χ2=4.146,P<0.01)。见表3。
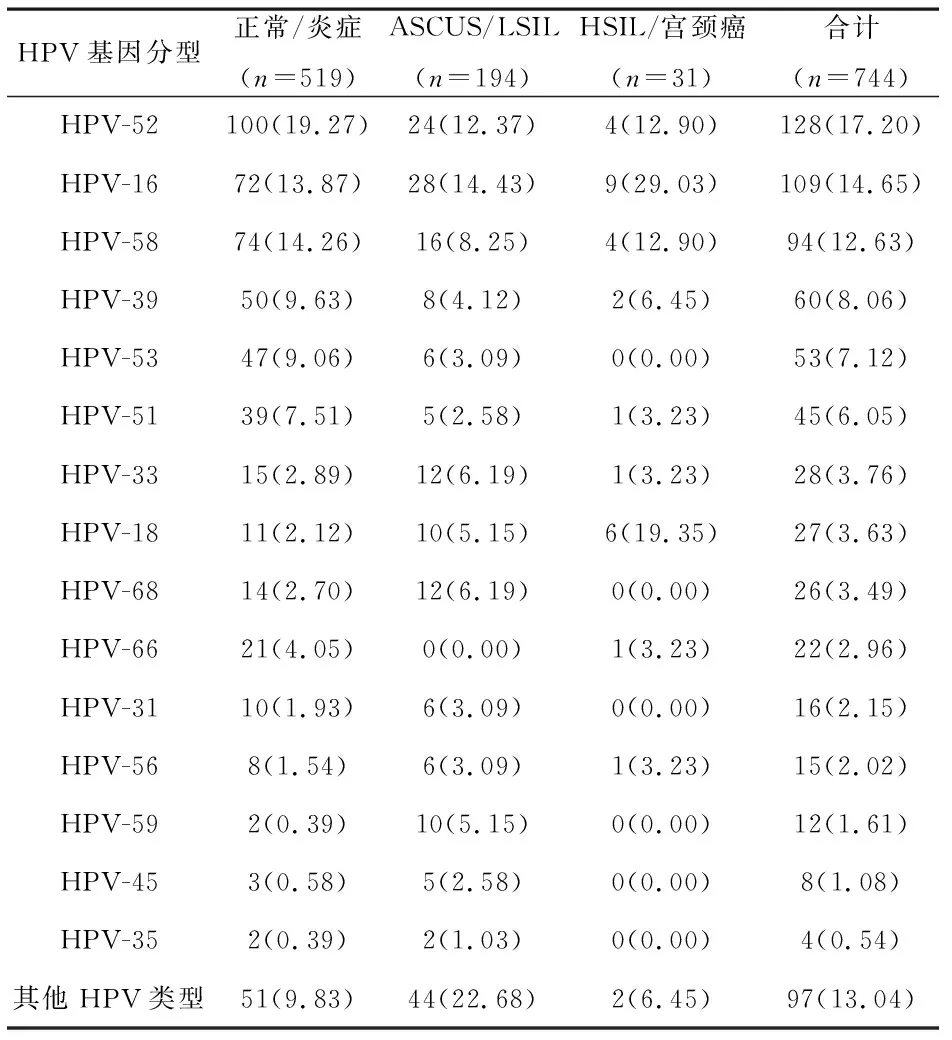
表3 不同程度宫颈病变HPV亚型感染情况[例(%)]
讨 论
宫颈癌是严重危害妇女健康的第二大常见癌症,我国宫颈癌的发病率以每年2%~3%的速度递增[7]。目前已有至少15种HPV基因型被确认为宫颈癌的高危型别[8],HPV分型作为宫颈癌前病变早期筛查的检测技术是有效降低宫颈癌发病率的措施。HPV的感染率和型别呈现较为明显的地域性差异[9]。2015年以来,湖北省各地区HPV感染率和型别的相关研究结果显示,武汉地区阳性率为17.47%(1732/9915),主要型别为52型、16型、58型[10];襄阳地区阳性率为28.80%(714/2479),主要型别为45型、58型[11];十堰地区阳性率为9.17%(783/8543),主要型别52型、16型、58型[12];黄石地区阳性率为43.92%(1163/2648),主要型别为52型、16型、58型[13];秭归地区阳性率为12.60%(373/2960),主要型别为16型、52型、6型[14]。本次研究结果显示荆门地区HPV阳性率为27.58%,排在前3位的为52型、16型、58型与武汉、十堰、黄石地区的型别一致,与襄阳的45型、58型以及秭归地区的16型、52型、6型存在差异[11-14]。HPV的感染可能受地域、文化、经济等多个因素的影响。仅针对高危型16型及18型的二价疫苗和针对高危型16型、18型及低危型6型、11型的四价疫苗能否有效预防荆门地区大部分人群的感染,仍有待考察,对于52型和58型的高感染率不能忽视,这在荆门地区HPV疫苗的引进选择上具有重要的参考意义。
HPV感染在不同年龄段人群中存在差异[15]。荆门地区HPV感染率和年龄曲线呈“U”型,以>55岁年龄组感染率最高,为31.44%,≤25岁次之为28.35%。这与李霓等[16]2008年关于中国妇女HPV感染的年龄分布特点,中国地区HPV感染各年龄组感染率均保持较高水平,尤其中年组(36~55岁)的研究结论有出入。这一结果与近期十堰地区[12]、黔北地区[17]、滇东北地区[18]HPV感染率的年龄分布特点相同。造成HPV感染率和年龄曲线发生变化的原因值得进一步研究,但荆门地区HPV感染率和年龄曲线呈“U”型特点的原因可能为:≤25岁的年轻女性可能因为更频繁的性接触,不良生活习惯如大量饮酒、长期熬夜、口服避孕药等,使免疫系统减弱而使体内HPV复制增加[19],26~35岁与36~45岁之间的女性HPV感染率最低,主要是由于该群体机体免疫好,自我保健意识较强有关,而46~55岁和>55岁大龄女性可能随着年龄增长,尤其绝经后免疫能力降低[20],缺乏雌激素保护,抑制和清除病毒的能力持续减弱[21],导致HPV持续感染。因此结果提示,荆门地区应该加强≤25岁人群的HPV检测和>55岁人群的宫颈癌筛查。
综上所述,荆门地区女性HPV感染的常见亚型依次为52型、16型、58型、39型、53型、51型,≤25岁和>55岁年龄段女性较易感。建议在荆门地区年轻女性中积极开展HPV检测,倡导女性定期做好宫颈癌筛查。

