纤维蛋白原是影响HBV相关慢加急性肝衰竭近期预后的独立危险因素
江丽萍 陈阮琴 陈明胜
肝衰竭由多种诱发因素引起,在我国常见的诱因是未经治疗的HBV感染,而在欧洲是过量饮酒。肝功能衰竭的临床表现通常为凝血功能障碍、黄疸、腹水和肝性脑病,其特点是短期病死率高和肝功能急剧恶化[1]。据日本学者研究报道,未进行肝移植的ACLF患者的病死率为50%~80%[2]。HBV相关慢加急性肝衰竭也是我国肝病最常见的死亡原因。目前,尚无完善的预后指标可用于预测病死率[3]。肝脏在凝血调节中起着关键作用。凝血功能异常的程度取决于肝功能损伤的严重程度,而肝病的临床表现与凝血功能损伤的严重程度密切相关。本研究比较HBV-ACLF患者血栓弹力图及凝血指标在预测患者近期(90 d)预后方面的价值。同时收集相关临床及实验室指标,采用多因素logistic回归分析,评价各个因素在HBV相关慢加急性肝衰竭近期预后中的作用。
资料与方法
一、研究对象
选取福建医科大孟超肝胆医院2017年5月至2019年1月间收治HBV相关慢加急性肝衰竭(ACLF)患者进行回顾性分析。共有117例患者入选,其中男性101例,女性16例。根据3个月随访结束时的预后,分为生存组及死亡组。本研究通过福建医科大学孟超肝胆医院医学伦理委员会批准(2019-067-01)。
纳入标准:①年龄≥18岁且≤65岁患者;②HBV-ACLF诊断符合我国2018年制定的《肝衰竭诊治指南》[4]中的诊断标准,患者血清总胆红素>10×正常值上限或每日上升≥17.1 μmol/L;且凝血酶原国际比值(INR)> 1.5。
排除标准:合并其他嗜肝病毒感染,合并自身免疫性、酒精性、药物性、脂肪性等其他因素导致的肝损伤,合并其他严重的基础疾病。
二、方法
收集两组患者一般资料,包括性别、年龄,实验室检查指标:血常规[白细胞计数(WBC)、血小板计数(PLT)、中性粒细胞比例(NEUT%)、血红蛋白(Hb)]、凝血功能[凝血酶原时间(PT)、凝血酶原活动度(PTA)、INR、纤维蛋白原(Fg)、抗凝血酶 III(AT-III)、D-二聚体(D-D)]、血栓弹力图[凝血因子活性(R值)、纤维蛋白原功能(K值)、纤维蛋白原功能(Angle角)等]、肝功能指标[丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总胆红素(TBil)、白蛋白(Alb)]、血肌酐(Scr)、HBV DNA载量等。
三、统计学方法
结 果
一、 死亡组与生存组一般情况比较
117例HBV-ACLF患者在90 d的随访期间死亡49例,存活68例。死亡组男性比例(83.7%),生存组男性比例(88.2%);死亡组年龄(43.4±9.1)岁,生存组年龄(42.8±9.8)岁,差异均无统计学意义(均P>0.05)。
二、死亡组与生存组TEG参数、凝血及其他检验指标的单因素分析
死亡组的AT-III、Alb、WBC、Hb、CHOL与生存组比较差异均无统计学意义(均P>0.05)。死亡组R值、K值、PT、INR、D-D、TBil、AST、Scr、NEUT水平均明显高于生存组,而CI值、MA值、Angle角、PTA、Fg、PLT水平均低于生存组(均P<0.05)。死亡组HBV DNA≥1×106拷贝/mL的比例明显高于生存组(P<0.05)。见表1。
三、HBV-ACLF近期预后的独立危险因素分析
以HBV-ACLF患者90 d是否死亡作为应变量,将差异有统计学意义的PT、D-D、TBil、AST、Scr、NEUT%、CI值、Fg及PLT作为自变量,进行多因素logistic回归分析,结果发现TBil、Fg是HBV-ACLF患者短期死亡的独立危险因素(P<0.05)。见表2。
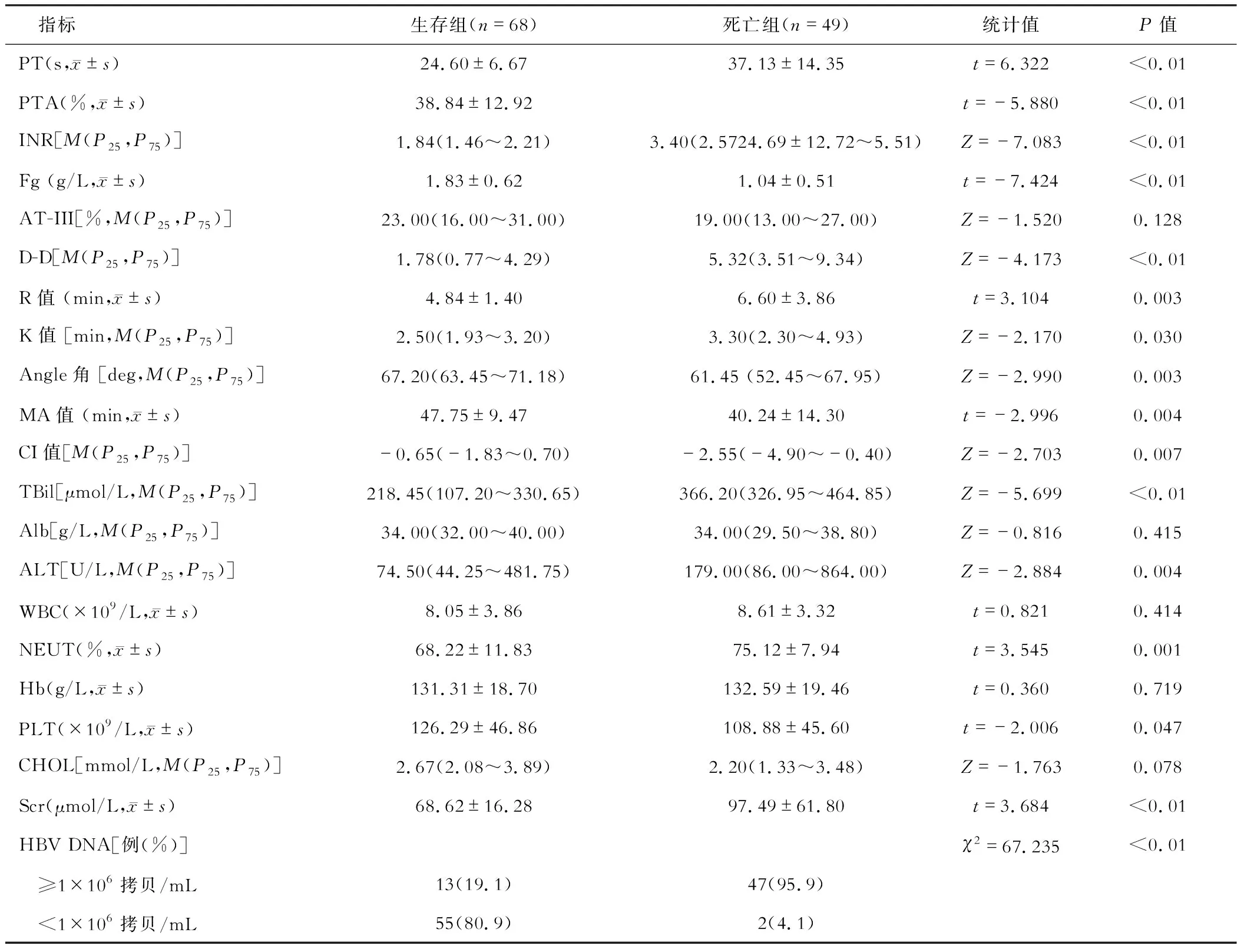
表1 死亡组与生存组TEG参数、凝血及肝功能等临床指标的单因素分析

表2 多因素 Logistic 回归分析结果
四、TBil和Fg对HBV-ACLF患者死亡的预测价值比较
应用ROC曲线对多因素 Logistic 回归分析结果有意义的指标进行HBV-ACLF 患者预后的判断能力的评价。TBil及Fg评估HBV-ACLF患者90 d生存率的AUC分别为0.810(95%CI:0.733~0.886)和0.851(95%CI:0.777~0.925)。
讨 论
ACLF是指慢性肝病的基础上,在急性损伤因素的作用下,短期(2~4周)内肝脏功能急剧恶化并出现肝衰竭,预后极差[4]。肝脏在凝血调节中起着关键作用,肝脏实质细胞产生凝血和纤溶系统中的大部分因子和抑制剂,在很大程度上有助于清除循环中激活的凝血或纤溶酶,从而防止出血和不适当的凝血激活[5, 6]。目前临床评估凝血功能常用的指标有PT、PTA、INR、部分活化凝血酶时间(APTT)、Fg等,这些指标反映的是凝血过程中某一阶段的异常。而TEG可反映凝血块由初步形成至溶解全貌,即反映血块形成的速度、最终强度和稳定性,可全面地分析血液凝固及溶解的全过程。
本研究单因素分析显示,死亡组R值、K值、PT、INR、D-D、TBil、AST、Scr、NEUT%、HBV DNA水平均明显高于生存组,而CI值、MA值、Angle角、PTA、Fg、PLT水平均低于生存组,表明这些指标可能是影响ACLF近期预后的因素。与生存组相比,死亡组TEG参数中R值、K值较高,CI值、MA值、Angle角较低,常规评估凝血指标中PT、INR、D-D较高,PTA、Fg、PLT较低,提示肝脏损伤越重,凝血功能越差或纤容越亢进,病情越重,患者预后越差。卢振和王瑜芬[7]对肝病到肝衰竭的不同病变阶段凝血指标的比较发现随肝脏受损加重,凝血指标PT、APTT、TT逐渐延长,D-D逐渐升高。江晓燕等[8]研究显示,ACLF患者死亡组R 值、K 值、PT、INR均明显高于生存组,CI值、α-角、PTA等水平均低于生存组,与本研究结果一致。另外,死亡组AST、TBil、NEUT%、Scr、HBV DNA水平均明显高于生存组,提示肝脏破坏严重程度、排泄功能越差或伴有感染、出现肾功能损伤、HBV载量越高,预后越差。李晨[9]研究结果显示,TBil、肝肾综合征、HBV DNA是ACLF患者预后独立危险因素,与本文结果一致。多因素logistic回归分析结果发现,仅TBil、Fg是HBV-ACLF患者短期死亡的独立危险因素。TBil反映肝脏疾病的严重程度,也是终末期肝病模型的重要组成部分,对临床判断ACLF患者病情较为重要。
Fg是一种可溶性血浆糖蛋白,由两个相同的亚基组成,每个亚基含有三条多肽链(Aα、Bβ和γ),并在肝脏中合成,Fg为止血和凝血提供了支持框架,在维持原发性和继发性凝血方面起着关键作用[10,11]。Cong等[12]观察到肝硬化患者的血浆纤维蛋白原浓度随着肝硬化的加重而进行性降低,提示肝硬化的严重程度与凝血变化密切相关。Shao等[13]发现低纤维蛋白原水平可以作为ACLF患者短期病死率(28 d内)的独立预测因子。值得注意的是,亚洲的多项研究确定了与ACLF近期不良结局相关的几种因素,包括先前存在的肝硬化,PT延长,胆红素升高,血清铁蛋白升高,白蛋白低,血小板计数低以及脑病或腹水的存在[14, 15]。
综上所述,低纤维蛋白原为影响ACLF近期预后的独立危险因素,由于样本量小和采用回顾性研究方法,需要更多研究进一步证实。

