质子对二价铁化合物空气稳定性的研究
张露超,李杰明,陈 浩,陈庆聪,李 波
(华北科技学院 环境工程学院,北京 东燕郊 065201)
0 引言
金属配位聚合物的设计和合成,特别是那些具有有趣的拓扑结构和潜在的技术应用的设计和合成,最近得到了很多关注[1-5]。近年来,新型金属有机骨架材料因其独特的结构和优异的性能而受到越来越多的关注。具有新型拓扑结构和信息存储潜力的Fe(II)配位化合物[6-7]因其从低自旋(LS,S=0)到高自旋(HS,S=2)过渡态的优点而受到越来越多的关注。然而,Fe(II)离子的致命弱点是,它们在空气中很容易被氧化成三价,因此,S=0到S=2的转变过程是不可能的。如今,获得在空气中稳定的Fe(II)复合物仍然是一个挑战[8-10]。
在此,我们报告了一种新型的在氧气中稳定的铁(II)化合物,它是通过添加苯甲醛来增加的还原能力,采用抗氧化方法合成的。将原料铁氰化物还原为亚铁氰化物,同时将苯甲醛氧化为苯甲酸。在富含氢离子的酸性环境中,水分子通过氢键相互作用,容易形成水合氢离子,其与还原出的亚铁氰化物形成类似于鱼网的阴离子层。带有足够电子和多余氢原子的阴离子层保护了空气中的Fe(II)离子不被氧化。DFT计算也证明了这一假设的正确性。这样,我们成功地获得了空气稳定的化合物[FeII(CN)6][(CH3)4N]2(H3O)2,其具有鱼和鱼网状的骨架结构。
铁氰化物、苯甲醛、四甲基溴化铵在DMF和水溶剂的混合物发生反应,形成深绿色的片状晶体。我们对该化合物进行X射线单晶衍射分析。另外,对磁性的研究表明二价铁是抗磁的(S=0)。 之后我们还将从计算化学角度上对其有趣的空气稳定特性进行讨论。
1 实验部分
1.1 材料和方法
用于合成的所有化学药品和溶剂均为试剂级,无进一步纯化。起始原料为K3Fe(CN)6、四甲基铵溴化物和苯甲醛。
1.2 [FeII(CN)6][(CH3)4N]2(H3O)2的合成
将K3Fe(CN)6(0.2 mmol)和四甲基溴化铵(0.6 mmol)混合并将其溶于蒸馏水(10 mL)中,然后将苯甲醛(0.2 mmol)的N,N-二甲基甲酰胺(DMF)(5 mL)溶液加入其中,得到深棕色溶液。然后将混合物过滤,并将随后的溶液静置几天后得到深绿色板状晶体。产率:45.7 mg(57%)。C14H30Fe1N8O2(398.31):计算得出。C42.18,H 7.53,N 28.12实测值:C 42.22,H 7.48,N 28.20. IR (cm-1):3551(s),3478(s),3414(s),3234(w),2170(s),2064(s),1637(s),1617(s),1485(s),1384(s)。
1.3 物理测量
1.3.1 X射线晶体学
单晶X射线数据在牛津衍射Gemini R Ultra石墨单色Mo靶检测器衍射仪(λ=0.71073Å)在298(2)K下测得。数据通过ω扫描技术收集。所有数据均为因洛伦兹极化效应而获得。使用CrysAlis软件建立索引以获取晶胞参数。结构是用(SHELXS-97)直接法求解,并在F2上通过最小全矩阵精炼正方形(SHELXL-97)。
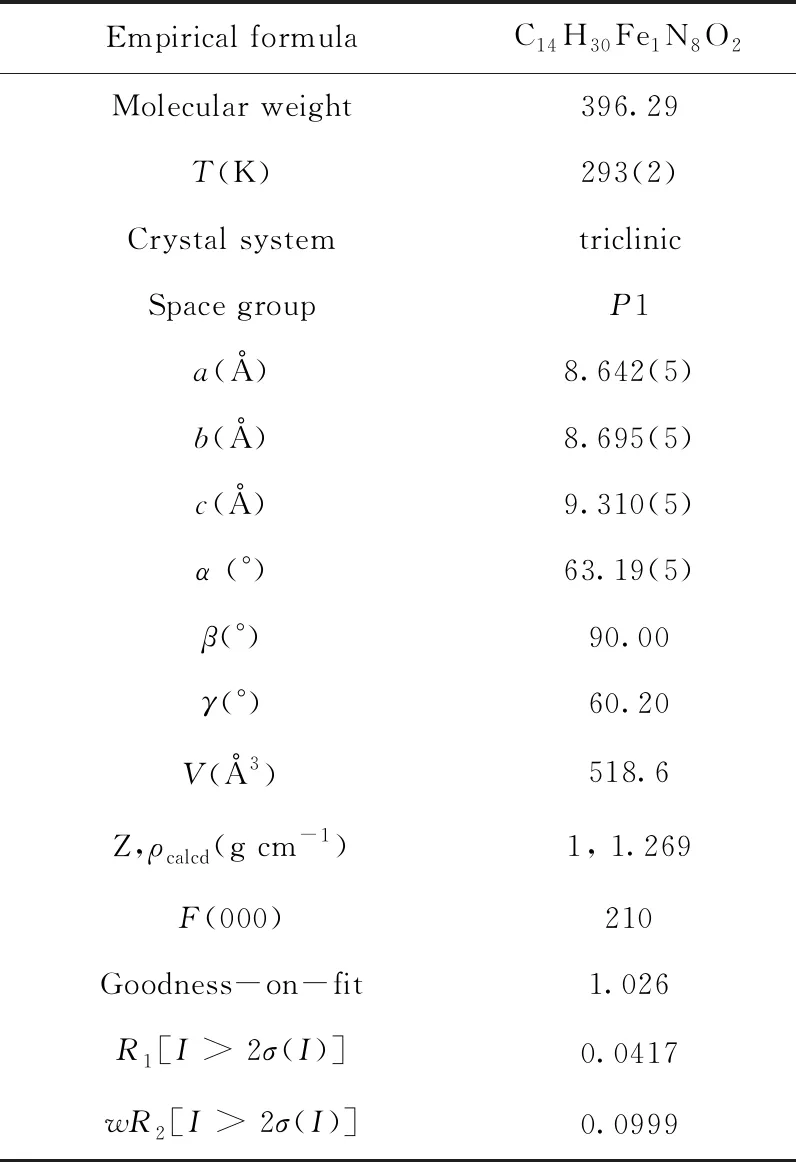
表1 该化合物的晶体学数据和结构参数
1.3.2 元素分析
CHN元素分析是在Perkin-Elmer 2400 CHN元素分析仪上进行的。此外,化合物的金属含量采用耦合等离子体在Leeman Prodigy光谱仪上进行。
1.3.3 磁测量
利用Quantum Design SQUID MPMS XL-7仪器对该化合物的多晶样品进行了直流磁测量。
1.4 DFT计算方法
所有计算均使用高斯16程序进行[11]。从晶体结构获得几何碎片,而无进一步优化。使用密度泛函理论(DFT)B3LYP方法与LANL2DZ基组相结合,计算包括前线分子轨道能量的电子性质。这个该方法包括推荐用于金属化合物的一些相对论效应,并且具有已成功用于许多其他过渡金属化合物。
2 结果与讨论
该化合物结晶于三斜P1空间群中。结晶学数据和结构参数列于表1。该化合物的分子结构由一个[FeII(CN)6]4-阴离子,两个[(CH3)4N]+阳离子和两个H3O+阳离子。每个[(FeⅡ(CN)6]4-阴离子有六个H3O+阳离子,并且每个H3O+阳离子周围环绕着三个[FeⅡ(CN)6]4-阴离子组成一个网络超分子层结构。图1为该化合物的分子结构图。图2为该化合物的阴离子结构图。其展示出渔网状的超分子层,其包含[FeII(CN)6]4-阴离子和H3O+阳离子。
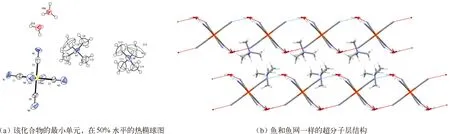
图1 分子结构图
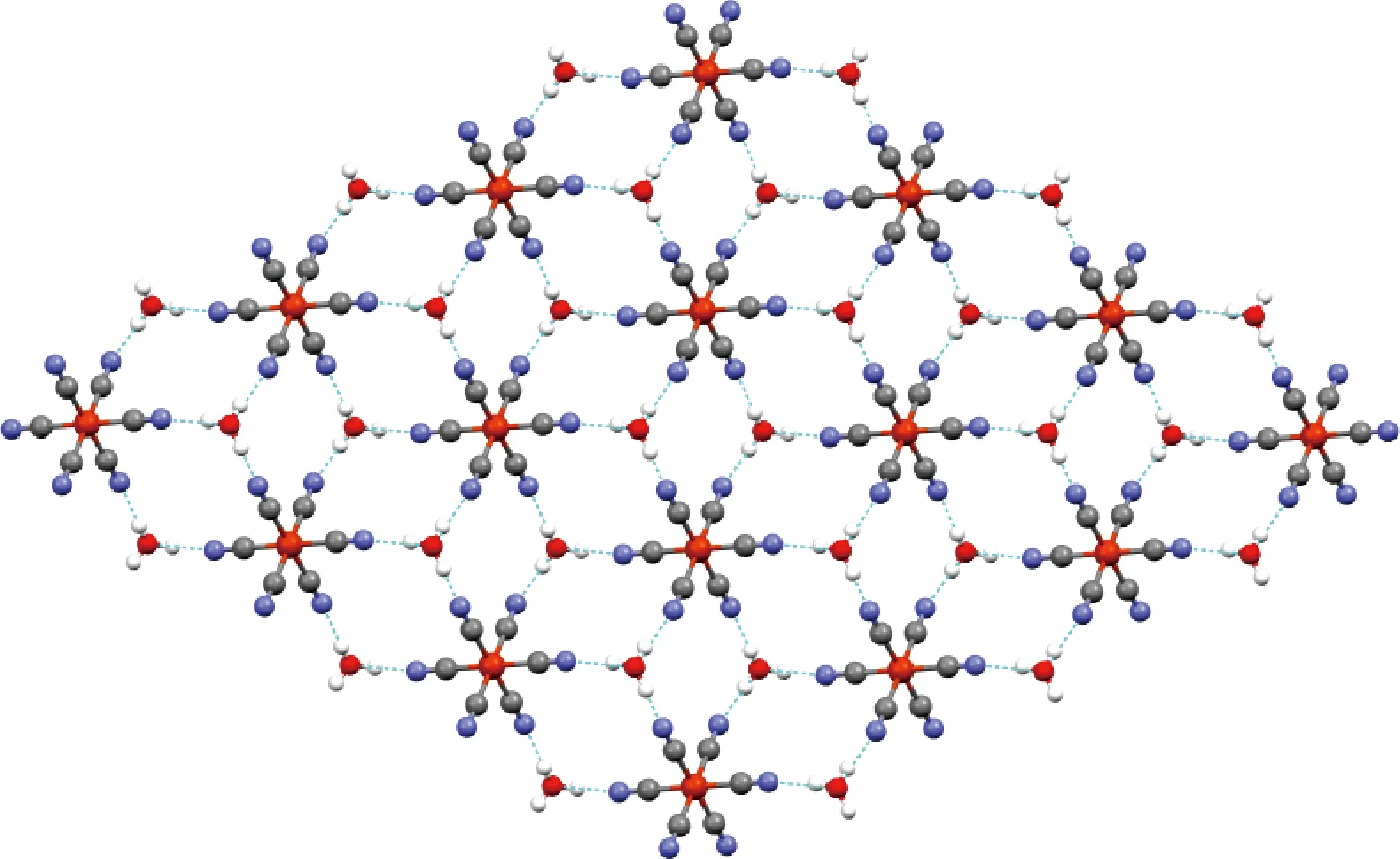
图2 阴离子结构图
该化合物的变温直流磁化是将多晶样品放入1000 Oe磁场下测量的,证实了Fe(II)的存在。实验磁化率表明了该化合物是抗磁性二价铁(S=0)的化合物。图3为在50~300 K的1 kOe磁场作用下,多晶样品的M与T的关系图。
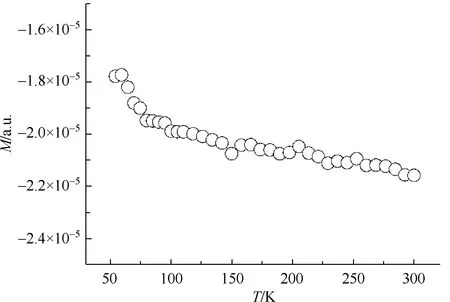
图3 磁性测量数据图
为了定量分析FeII离子在其邻近的水合氢离子的作用下是如何形成稳定的FeII离子,我们采用了基于B3LYP方法和LANL2DZ基组的理论计算方法。计算得到的 [FeII(CN)6]4-阴离子的总能量( -679.960766 Hartree表2 ) 和 [FeⅢ(CN)6]3-阴离子 ( -680.100856 Hartree )表明,在六氰基体系中FeⅢ更稳定。尽管如此,我们将六个相邻H3O+离子引入 [FeII(CN)6]4-离子和[FeIII(CN)6]3-离子,形成超分子片段 [FeII(CN)6(H3O)6]2+和 [FeIII(CN)6(H3O)6]3+离子。使得总能量变成为 -1141.580386 Hartree ( [FeII(CN)6(H3O)6]2+) 和 -1141.070055 Hartree([FeIII(CN)6(H3O)6]3+) (分别列于表2)。这表明由于邻近的水合氢离子的诱导效应,[FeII(CN)6]4+离子在六水合氢离子变得更加稳定。从DFT计算的结果我们可以看出,在六个CN-的静电场之下,FeIII离子要比FeII离子稳定0.14 Hartree;而在每个氰基周围再加上H3O+离子之后,的FeII离子要比FeIII离子稳定0.51 Hartree。这进一步证明了质子的存在对于二价铁在空气中的稳定性起到至关重要的作用。

表2 [FeII(CN)6]4-、[FeIII(CN)6]3-、[FeII(CN)6(H3O)6]2+和[FeIII(CN)6(H3O)6]3+离子的总能量 Hartree
3 结论
(1) 使用DFT方法对该化合物进行的详细研究表明,水合氢离子的存在使二价铁离子变得稳定,不容易被氧化。
(2) 使用苯甲醛可以自发地将三价铁离子还原成二价铁离子,这可能提供一种制备基于二价铁离子稳定化合物有效的方法,为实验家和理论家提供了灵感和实验支持。
(3) 该类化合物的研究证明了氢离子的存在能够有效避免了二价铁离子的氧化,为稳定的基于二价铁离子化合物的合成提供了可行的方法。
(4) 基于二价铁离子的自旋交叉化合物对空气十分敏感,极易在空气中被氧化,丧失自旋交叉能力,这大大阻碍了该类化合物的基础研究和商业应用;而本次研究表明,自旋交叉化合物在酸性条件下可能会增加其空气稳定性,这为今后自旋交叉化合物的应用提供了实验和理论方面的支撑依据。

