氙、异氟烷和氧化亚氮对神经胶质瘤细胞凋亡和β淀粉样蛋白含量的影响*
赵 艳 吴新民
既往基础研究提示,麻醉和(或)手术可能促发术后认知功能障碍(postoperative cognitive dysfunction,POCD)或阿尔茨海默病(Alzheimer’s disease,AD)[1,2],几种麻醉剂可诱发细胞凋亡和β淀粉样蛋白(amyloid-β protein,Aβ)水平升高,而Aβ是AD患者脑中老年斑的主要成分,在AD发病机制中起关键作用[3]。同时,神经炎症被认为是AD和POCD发病机制之一,手术和(或)麻醉可能与神经炎症有关[2,4]。氙是稀有惰性气体,具有麻醉和神经保护作用[5],对AD神经病理发病机制的影响尚不清楚。异氟烷曾广泛用于临床麻醉,有报道异氟烷的神经毒性作用[1,3]。氧化亚氮[6]俗称笑气,是最古老的麻醉气体,沿用至今。细胞是生物体基本单位,本研究旨在从微观细胞和分子水平探讨新型稀有麻醉剂氙对细胞凋亡和Aβ的影响,并与颇具争议的异氟烷和最古老的麻醉剂氧化亚氮比较,为麻醉药如何减轻神经细胞创伤寻找可能的方法,并为预防POCD和AD提供实验依据。
1 材料与方法
1.1 细胞培养
细胞系:由哈佛大学医学院麻省总医院谢仲淙教授研究组实验室赠送。H4人神经胶质瘤细胞(H4)和稳定转染了表达人全长淀粉样前蛋白的H4人神经胶质瘤细胞(H4 human neuroglioma cells stably transfected to express human full-length amyloid precursor protein,H4-APP)。培养液:含9%胎牛血清的高糖杜伯克改良的鹰牌介质(dulbecco’s modified eagle’s medium,DMEM)细胞培养液,加入青霉素100 U/ml,链霉素100 μg/ml和L-谷氨酰胺2 mmol/L;H4-APP细胞培养液中另加G418硫酸氢盐200 μg/ml(Sigma公司,英国)。细胞处理:将H4和H4-APP细胞置于细颈瓶中,储存于含5% CO2和95%空气的37 ℃湿润恒温箱里,隔天更换培养液,直至细胞长满细颈瓶底部。再将细胞以1×106密度种植于直径60 mm有3 ml细胞培养液的培养皿中,其余细胞置于新的细颈瓶或储存于液氮中。培养皿中的细胞适应一晚,第2天将培养液更换为2 ml新的培养液后立即进行麻醉气体暴露实验。实验分组及方法参考文献[3,7~15]。
1.2 麻醉气体暴露实验
将上述细胞培养皿置于实验用封闭筒中,通过麻醉机将氙、异氟烷或氧化亚氮输入封闭筒中,采用气体监护仪(Datex-Ohmeda, GE healthcare, Bradford, UK; 氙监护仪a 439XE monitor, Air Products, London, UK)监测氧、CO2和麻醉气体浓度,细胞暴露于以下一种气体中2 h:对照组[21%氧、5% CO2和平衡氮气,H4 Naive细胞(H4对照组)和H4-APP 细胞(H4-APP对照组)]、2%异氟烷[21%氧和5% CO2,H4-APP 细胞(Iso组)]、74%氧化亚氮[21%氧和5% CO2,H4-APP 细胞(N2O组)]、70%氙[25%氧和5% CO2,H4-APP 细胞(Xe组)]。接触气体2 h后,细胞和培养液在恒温箱中孵育24 h。
1.3 培养液中分泌的Aβ42含量测定
Aβ是由淀粉样前体蛋白(amyloid precursor protein,APP)水解而来,由细胞分泌,在细胞基质沉淀聚积后有很强的神经毒性作用。人体内Aβ最常见的亚型是Aβ40和Aβ42,其中Aβ42具有更强的神经毒性,且更易聚集,形成Aβ 沉淀的核心,引发神经毒性作用[16,17]。收集条件细胞培养液,4 ℃ 14 000×g离心10 min,取上清液,按照ELISA试剂盒(Invitrogen公司,美国)说明步骤,检测人Aβ42含量(n=4)[15]。
1.4 细胞中B细胞淋巴瘤-2(B-cell lymphoma-2,Bcl-2)、Bcl-2相关的X蛋白(Bcl-2 associated x,Bax)、核因子-κB(nuclear factor-κB,NF-κB)和裂解的半胱氨酸天冬氨酸蛋白酶-3(cleaved caspase-3)表达测定
冰上裂解细胞,收集匀浆,4 ℃ 14 000×g 离心30 min,上清液行蛋白定量测定,取50 μg蛋白上样,4%~12% NuPAGE中电泳,电转移至PVDF膜。5%脱脂奶粉室温封闭3 h。分别加入Bcl-2抗体(1∶1000,Abcam公司,英国)、Bax抗体、裂解的caspase-3抗体或磷酸化NF-κB p65抗体(1∶1000, Cell Signaling公司,美国),4 ℃孵育过夜。TBST洗涤PVDF膜,加入羊抗兔二抗(1∶1000,Abcam公司,英国),室温孵育1 h,TBST洗涤3次,ECL化学法发光、显影(Syngene公司,英国)。以各目的蛋白条带灰度值与内参α-tubulin条带灰度值的比值反映蛋白表达,并以相对于H4细胞对照组(相对数值设为1)的差异倍数表示(n=4)。计算Bcl-2/Bax。
1.5 H4细胞的活力分析
采用 3-(4, 5-二甲基噻唑-2)-2, 5-二苯基四氮唑溴盐[3-(4, 5-dimethylthiazol-2-yl)-2, 5-diphenyltetrazolium bromide,MTT][18,19](Merck KGaA公司,德国)法。使用最低限度基本培养基(minimum essential medium, MEM)(Gibco公司,英国)将MTT稀释为0.5 mg/ml,吸除细胞培养液,将600 μl MTT溶液加入含有细胞的24孔板每孔中,置于含5% CO2和 95% 空气的37 ℃湿润恒温箱中孵育2 h,吸除上清液,留下甲瓒晶体溶解于1 ml DMSO(Sigma公司,英国)中。使用吸光分析仪(Dynex Technologies公司,英国)的分光光度法,波长595 nm,检测甲瓒产物吸光度(n=6),吸光度数值越大,说明细胞活力越强[18,19]。
1.6 统计学处理
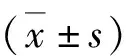
2 结果
与H4对照组相比,70%氙处理2 h使H4-APP细胞Bcl-2表达上调,2%异氟烷、74%氧化亚氮或70%氙处理2 h使H4-APP细胞Bax表达下调;70%氙或2%异氟烷处理2 h使H4-APP细胞Bcl-2/Bax增高(P<0.05),见表1和图1、2。
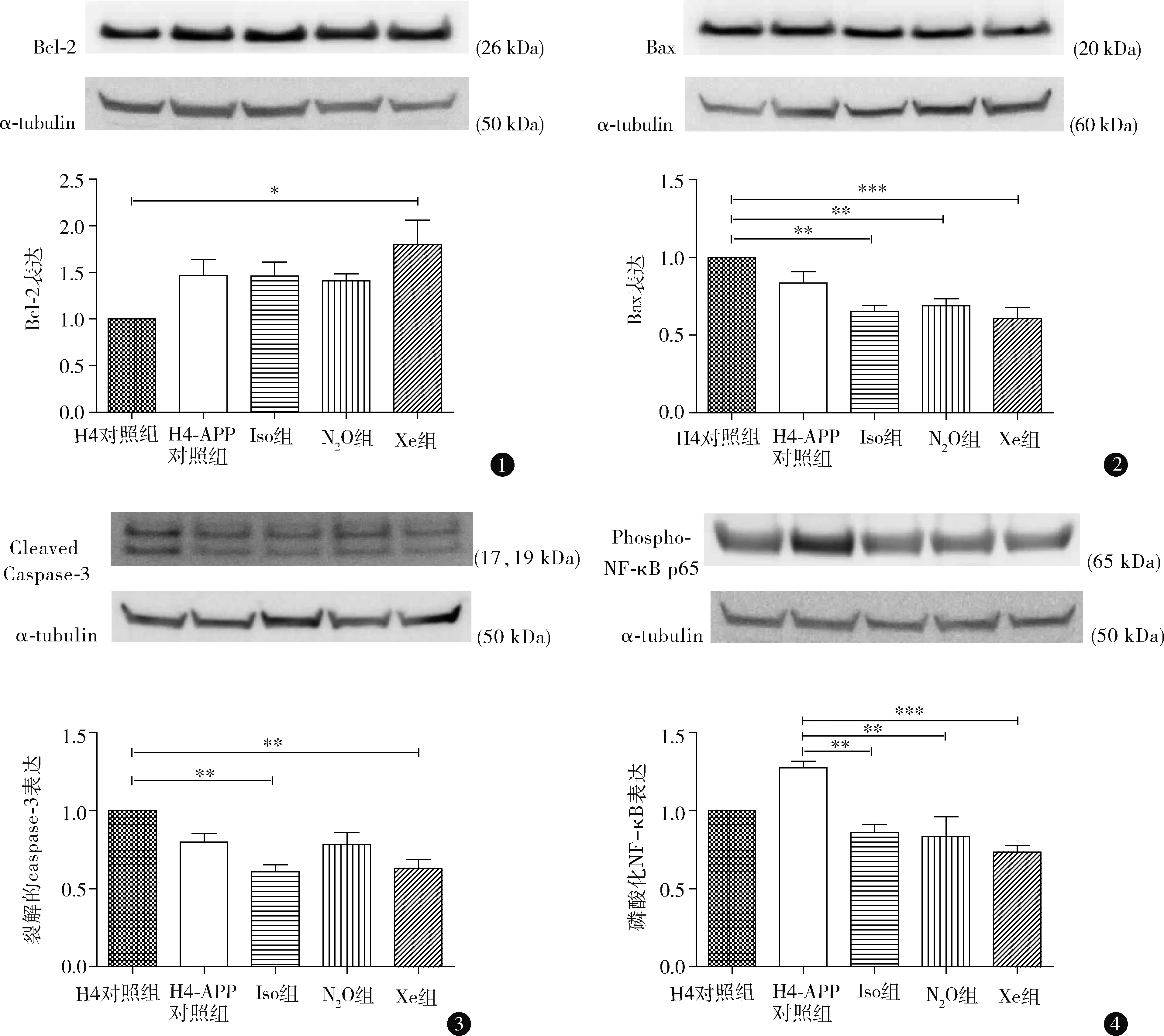
图1 5组细胞接触气体后24 h时Bcl-2的表达(Western blot,相对于H4对照组的差异倍数),与H4对照组比较,*P<0.05 图2 5组细胞接触气体后24 h时Bax的表达(Western blot,相对于H4对照组的差异倍数),与H4对照组比较,**P<0.01,***P=0.001 图3 5组细胞接触气体后24 h时裂解的Caspase-3的表达(Western blot,相对于H4对照组的差异倍数),与H4对照组比较,**P<0.01 图4 5组细胞接触气体后24 h时磷酸化NF-κB的表达(Western blot,相对于H4对照组的差异倍数),与H4-APP对照组比较,**P<0.01,***P<0.001
70%氙或2%异氟烷处理2 h使H4-APP细胞裂解的caspase-3表达下调并增强H4-APP细胞活力(P<0.05),见表1、2和图3。与H4-APP对照组比较,70%氙、2%异氟烷或74%氧化亚氮处理2 h使H4-APP细胞NF-κB表达下调(P<0.05),见表1和图4。
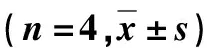
表1 5组细胞接触气体后24 h Bcl-2、Bax、裂解的caspase-3、NF-κB的表达(Western blot,相对于H4对照组的差异倍数)和Bcl-2/Bax的比较
与H4细胞相比,所有H4-APP细胞(无论是否接触麻醉气体)均产生较多的Aβ(P<0.05);与H4-APP对照组比较,70%氙、2%异氟烷或74%氧化亚氮暴露2 h未使H4-APP细胞产生Aβ增加(P>0.05),见表2。
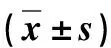
表2 5组细胞接触气体后24 h时细胞活力(相对于H4对照组的差异倍数,n=6)和条件培养液中人Aβ42含量(n=4)的比较
3 讨论
本实验选择氙、异氟烷和氧化亚氮浓度的依据:马大青研究组[7,8]前期工作表明70%氙(相当于1个最低肺泡有效浓度)麻醉具有神经保护作用,另一研究组也采用70%氙麻醉[9],是氙临床麻醉常用浓度。异氟烷临床常用浓度为1%~2.5%,谢仲淙等[3,10~12]采用与本实验相同或不同细胞系所用异氟烷浓度为2%。氧化亚氮临床相关浓度为50%~75%,谢仲淙和马大青等采用70%氧化亚氮加低浓度异氟烷或75%氧化亚氮麻醉[8,13,14],本实验密切监测气体浓度,氧化亚氮组实际浓度是:74%氧化亚氮,21%氧气和5% CO2(总浓度100%,CO2浓度各组一致)。据此,本实验选择3种吸入麻醉药浓度。
麻醉气体接触时间的确定:谢仲淙研究组基于细胞的研究,麻醉药接触时间一般为6 h[3,11~13],基于小鼠的研究接触异氟烷2 h[10]。马大青等研究氙的接触时间为2 h[8]。采用与谢仲淙等研究相同的细胞系接触2%异氟烷2 h结果如何尚无研究报道。异氟烷可表现为神经保护和神经毒性双重作用,取决于异氟烷接触浓度和持续时间[20]。岳云研究组报道随着麻醉时程延长(4 h与2 h比较),老年大鼠认知功能损害更为明显[21]。因此,本实验确定麻醉药接触时间为2 h。
在不同实验条件下,麻醉药可呈现神经保护[22~24]或神经毒性双重作用[25~27]。与既往报道[5,28]一致,本实验结果表明,氙处理2 h上调抗凋亡蛋白Bcl-2表达,下调促凋亡蛋白Bax表达,Bcl-2/Bax增高,并抑制caspase-3激活,从而发挥抗凋亡作用。但Brosnan等[29]研究显示,1或2 MAC(而不是0.75 MAC)氙处理6 h导致大鼠海马切片神经元凋亡,1 MAC(而不是2 MAC)异氟烷和七氟烷处理6 h增加神经元凋亡;而异氟烷0.75 MAC 2 h预处理海马切片减少1 MAC氙、异氟烷和七氟烷接触后的神经元凋亡。可见,不同麻醉药浓度、处理时间和是否预处理等效果不同[30]。
本研究结果表明,短时间接触氙或异氟烷可能通过Bcl-2/Bax信号通路和抑制caspase-3激活防御细胞凋亡。本实验对象H4为肿瘤细胞,抑制肿瘤细胞凋亡现象的启示是,如果在临床上,对于此类手术患者术后肿瘤复发,可能存在潜在的风险;对于神经胶质瘤手术患者,如何更好地选择麻醉药物?本研究提供初步实验依据,但是从体外细胞实验到临床实际还有很远的距离,需要大量临床研究来检验。
本实验显示短时间接触氙、异氟烷或氧化亚氮可通过下调NF-κB表达抑制神经炎症。既往研究证实[31~33]神经炎症在AD和POCD中的作用,以及缓解炎症的神经保护效果[34]。对临床麻醉的提示是,临床浓度氙、异氟烷或氧化亚氮在一定条件下可能减轻或减少AD和POCD的发生和发展,但尚需深入的临床研究验证。本实验中,与H4细胞相比,H4-APP细胞无论是否接触麻醉气体均产生较多的Aβ,说明细胞内在特性比麻醉药对Aβ生成的影响更大,提示基因特征在AD发病机制中的关键作用。
本研究中,与H4 Naive细胞相比,所有H4-APP细胞(无论是否接触麻醉气体)均产生较多的Aβ(P<0.05),似应促进H4-APP细胞凋亡,但结果并非如此。可能的解释是,虽然H4-APP细胞各组Aβ42水平较H4 Naive细胞对照组显著升高,但是同时各组Aβ42水平绝对值均较低(平均15~18 pg/ml)。既往研究[35,36]显示Aβ浓度足够高而且作用时间足够长后,才会导致细胞凋亡和神经毒性(例如认知功能障碍)。本实验中,H4-APP细胞所产生的Aβ有限浓度和较短作用时间,还未达到促进H4-APP细胞凋亡的程度,提示临床患者AD和POCD的发生是一个逐渐积累和演变的过程。
本实验初步观察在特定条件下(H4人神经胶质瘤细胞系接触麻醉气体2 h)氙、异氟烷和氧化亚氮对凋亡、神经炎症和Aβ的影响,在不同研究条件下,麻醉药与AD和POCD相关神经病理发病机制之间的关系是复杂多变的。今后应进一步探讨氙不同浓度和接触时间的影响,观察其他吸入麻醉药、静脉麻醉药的作用,特别是开展临床研究以探究麻醉/手术与POCD和AD之间的联系,寻找POCD和AD可能的防治措施,造福于人类。
综上所述,短时间接触氙或异氟烷可能与Bcl-2/Bax信号通路和抑制caspase-3激活防御细胞凋亡有关;临床浓度氙、异氟烷或氧化亚氮通过下调NF-κB表达减轻炎症,对Aβ生成无影响;H4-APP细胞比H4细胞产生Aβ多。提示在一定条件下麻醉药的神经保护作用以及基因特征在AD发病机制中的关键作用。
致谢:本课题为赵艳在北京大学第三医院麻醉科工作期间所获中华医学会麻醉学分会留学基金项目。本实验在英国伦敦帝国理工学院马大青教授研究组实验室完成,实验用细胞由哈佛大学医学院麻省总医院谢仲淙教授研究组实验室赠送,特表感谢!

