基于自发呈报系统的异烟肼与解热镇痛药联用的肝损害风险对比
戴志莲,朱立勤,岳志华,周畅
(1.天津医科大学一中心临床学院,天津300192;2.天津市海河医院药剂科,天津300350;3.天津市第一中心医院药剂科,天津300192;4.国家药典委员会,北京100061)
异烟肼(isoniazide,INH)是一线抗结核药物,可单药用于潜伏性结核感染[1],也可联合用于结核全程治疗甚至高剂量用于耐多药结核病[2]。结核病患者多有发热症状,因此INH 经常与对乙酰氨基酚(acetaminophen,APAP)和洛索洛芬(loxoprofen,LOX)等解热镇痛药(NSAIDs)联合应用。
自发呈报系统(spontaneous reporting system,SRS)是一个由医务人员、患者或药品企业等自发呈报的系统,是目前监测药物安全信号最重要的数据来源之一[3]。美国食品药品监督管理局(food and drug a dministration,FDA)药品不良反应自发呈报系统(adverse events reporting system,AERS),简称FAERS,因其数据量大且对公众开放,成为药品不良事件信号挖掘最广泛的数据库之一[4]。本研究基于FAERS 对INH 分别联合APAP 和LOX 发生肝损害风险进行数据挖掘,旨在为结核治疗安全用药提供参考。
1 资料与方法
1.1 研究资料 本研究纳入FAERS 从2007年第1 季度-2016年第4 季度的10年药品不良反应(adverse drug reaction,ADR)报告。FAERS 数据库包含递交给FDA 的不良反应报告、用药错误报告和导致不良事件的产品质量投诉,其数据量大,信息丰富,可用于分析[5]。
1.2 研究方法
1.2.1 研究分组及数据提取 本研究将纳入的药品不良反应报告分为两组。对照组(单用INH)和观察组(INH 联合LOX、INH 联合APAP)。研究检索FAERS 数据库中包含所有INH、LOX 和APAP 的病例报告,包括怀疑药品、存在相互作用药品或伴随使用药品的病例报告。
药名检索词分别是:异烟肼为“isoniazid、inh、rimifon”,对乙酰氨基酚为“acetominophen、paracetamol”,洛索洛芬为“loxoprofen、loxonin”。肝损害不良事件的检索词参照药事管理标准医学术语集(medical dictionary for regulatory activities,MedDRA)的42 条首选语对肝损害事件进行定义[6]。
1.2.2 ADR 信号检测方法 目前用于ADR 信号检测的数据挖掘方法主要包括报告比值比(reporting odds ratio,ROR)法、综合标准法、贝叶斯可信传播神经网络法、伽马泊松缩量估计法、多项伽马泊松缩量估计法。本研究采用荷兰药物警戒中心提出的ROR 法,该法具有计算简单、灵敏度较高,且随着报告数的增加灵敏度升高,ROR 信号检测结果可以估计相对危险度,且减少了结果偏倚性[7]。
1.2.3 联合用药ADR 信号挖掘方法 国内外对联合用药导致的ADR 检测方法可以分为频数法、回归法、贝叶斯法和基线模型。本研究采用Logistic 回归法,该方法通过分层处理,可有效控制混杂因素,结果稳定性高[7]。本研究运用Logistic 回归模型,分别将年龄、性别、报告年份、单用INH、INH 与APAP乘积项以及INH 与LOX 乘积作为协变量,研究这些因素对引起肝损害的影响。比值比(odds ratio,OR),也叫优势比,指的是存在暴露因素时不良反应发生与不发生的概率比与不存在暴露因素时事件发生与不发生的概率比的比值。在Logistic 回归中,OR值大于1[95%置信区间(CI)下限大于1]表示该因素可能是危险因素;OR 值小于1(95%CI 上限小于1)表示该因素可能是一个保护因素。
1.3 统计学处理 采用Microsoft Office Excel 2007进行数据整理,IBM SPSS Statistics 20.0 进行统计分析。正态分布计量资料用±s 表示,3 组间均数比较采用方差分析,分类资料用例数(百分比)表示,采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 人口学统计结果 经剔除重复及低质量数据(缺失年龄、性别和报告年份,视为低质量数据),最终本研究纳入17930例事件报告,INH 组16324例,INH 联合LOX 组514例,INH 联合APAP 组1092例,观察组和对照组性别和年龄分布情况如表1 所示。各组间性别分布差异有统计学意义(P<0.05),各组间年龄分段及平均年龄差异有统计学意义(P<0.001)。
2.2 各组肝损害不良事件的发生风险分析 观察组之间的肝损害不良事件发生危险风险如表2 所示。INH+LOX 组发生肝损害事件374例,发生其他不良事件140例。INH+APAP 组发生肝损害事件991例,发生其他不良事件101例。
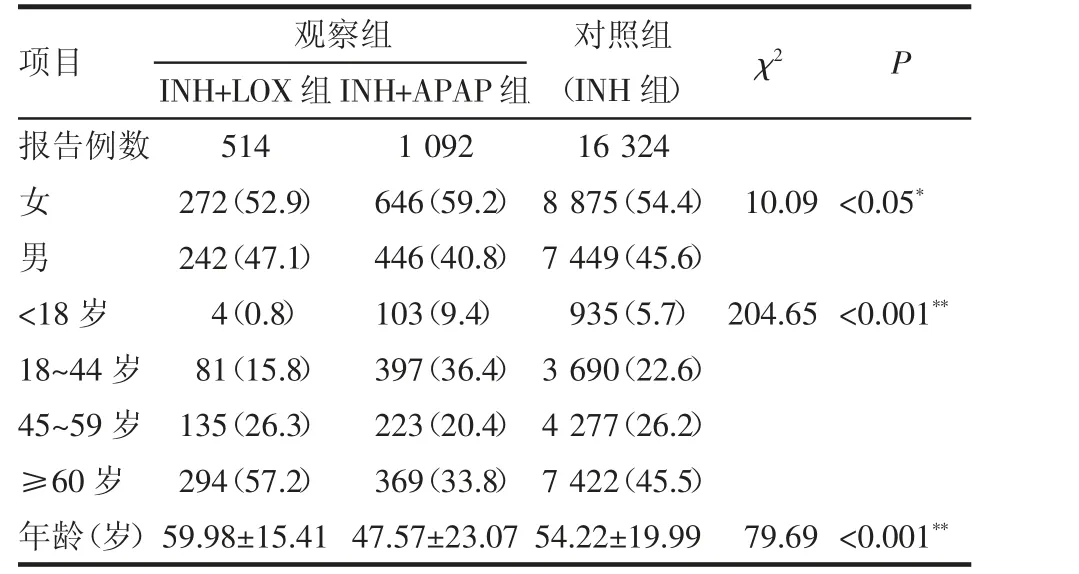
表1 观察组和对照组的人口学特征[n(%)]Tab 1 The demographic characteristics in index groups and reference group[n(%)]

表2 观察组和对照组肝损害事件发生率的报告RORTab 2 ROR concerning the occurrence of liver injury in index and reference groups
各组ROR 的OR 值和95%CI 间如表2 所示,组间肝损害发生风险差异有统计学意义(P<0.001)。经过报告年龄、性别和报告年份校正后,INH+LOX 联合用药组与单用INH 组相比发生肝损害事件的风险是28.057(95%CI:22.783~34.553),INH+APAP 联合用药组的风险是92.551(95%CI:74.283~115.312)。年龄的OR 值是0.988(95%CI:0.986~0.991,P<0.001);女性的OR 值是0.714(95%CI:0.647~0.789,P<0.001);报告年份的OR 值是0.990(95%CI:0.970~1.010,P>0.05)。
3 讨论
ROR 法被广泛的使用于评估药物的安全性,ROR 值95%CI 下限≥2 时,表明是一个显著的安全信号[8]。此次研究显示校正后INH+LOX 发生肝损害事件的风险是28.06(22.78~34.55),INH+APAP 风险是92.55(74.28~115.31),说明INH 联合APAP 以及INH联合LOX 存在显著肝脏安全信号,另外也表明INH+APAP 肝损害风险显著高于INH+LOX。
年龄是肝损害发生的保护因素[OR=0.988(0.986~0.991)],随着年龄的增大,发生肝损害风险减少。女性是保护因素[OR=0.714(0.647~0.789)],女性发生肝损害风险更小。报告有随时间减少的趋势[OR=0.990(0.970~1.010)],但因为95% CI 跨越1,说明报告时间对肝损害事件发生无显著影响。
结核病治疗中常出现肝损伤,主要机制为药物及其代谢物对肝脏的直接肝毒性和特异性肝毒性作用[9-10]。抗结核治疗中的肝损害可能由于INH、利福平或吡嗪酰胺引起,但更可能由INH 导致[11]。INH引起的肝损伤发生率为0.5%~4%,单用INH 1个月可致28%的患者氨基转移酶显著升高,用药6个月该比例增长为41%[12]。Lapeyre-Mestre 等[13]对NSAIDs引起肝损害风险分析显示,法国APAP 发生肝损害的风险为2.32(2.23~2.42),西班牙为1.32(1.07~1.62)。兰茜等[14]对2013年北京地区NSAIDs 分析显示,APAP 和LOX 无肝损害风险信号。目前国内外尚无结核药联合NSAIDs 肝损害风险的评价性研究,本研究结果显示,使用INH 治疗的患者加用NSAIDs时,应尽量避免使用APAP 及含该成分的复方制剂,可选择LOX,减少肝损害发生风险。
INH 和APAP 连用肝损害风险增加,考虑可能跟肝细胞色素酶P450(CYP)相关[12]:CYP2E1 含量虽然仅为CYP 总数的5%~10%,但是参与多种导致肝损伤的药物代谢,如氟烷、INH 和APAP 等。当INH 与APAP 联用时,INH 诱导CYP2E1 活性[12,15],促进具有肝毒性的中间代谢产物乙酰苯醌亚胺(NAPQI)[16]和乙酰肼[17]产生,加重对肝脏损害;另外因为CPY2E1 的作用,服用INH 会导致一个较窄APAP 敏感的易感窗口期,可能不超过24 h[18]。虽然APAP 的肝毒性常具有剂量依赖性,但在这个易感窗口期,可能少量的APAP 也能引起明显肝损害甚至肝衰竭的发生。本研究仅对两种NSAIDs 进行了初步探索,INH 与其他NSAIDs 连用的肝损害风险还有待进一步研究。

