对虾急性肝胰腺坏死致病菌HY3鉴定及耐药分析
余达勇,陈碧秀,钟永军,粱秀燕,何昕蔚,夏海洋,鲍佳伟
( 1.台州学院 生物制药研究所,浙江 台州 318000; 2.台州学院 生命科学学院,浙江 台州 318000;3.浙江宏野海产品有限公司,浙江 临海 317000 )
急性肝胰腺坏死病是目前威胁凡纳滨对虾(Litopenaeusvannamei)养殖产业的重要细菌性病害。早期该病主要发生于对虾的育苗期,因而也被称为早期死亡综合征。患急性肝胰腺坏死病的对虾一般具有体色发白,虾壳变软,摄食明显减少,肝胰腺颜色暗淡苍白或糜烂发红,空肠空胃等特征[1]。自2009年发现以来,已给中国[2]、泰国[3]、墨西哥[4]和菲律宾[5]等国的凡纳滨对虾养殖产业造成了巨大的经济损失。研究表明,凡纳滨对虾急性肝胰腺坏死病致病菌含有致死性毒因子PirVP(包含毒性蛋白PirA和PirB)[6],其作用于肝胰腺而使上皮细胞脱落,进而造成肝胰腺功能丧失。已有的报道显示,致死性毒因子PirVP主要发现于弧菌中[6],包括副溶血弧菌(Vibrioparahaemolyticus)[7-9]、哈维氏弧菌(V.harveyi)[10]、坎氏弧菌(V.campbellii)[2],在其他少见的弧菌中也有发现[11-12]。毒性基因pirA和pirB多见于质粒上,常见的为69 kb大小质粒pVA1[6],也见有183 kb大小质粒[13]。
PCR检测是常用的对虾急性肝胰腺坏死病致病菌快速检测方法。Flegel等[14]首次报道了检测急性肝胰腺坏死病致病性副溶血弧菌的AP1引物和AP2引物。Sirikharin等[15]针对pirA基因开发了AP3检测引物,灵敏度和准确度较之前的引物有明显提高。Dangtip等[16]利用巢式PCR的方法开发了AP4检测引物,灵敏度较AP3引物提高了约100倍。在致病菌株的分类上,贾丹等[17]发现分子伴侣蛋白groEL比16S rRNA基因更有优势。孙明玉等[9]利用副溶血弧菌的7个管家基因dnaE、gyrB、recA、dtdS、pntA、pyrC及tnaA对12株急性肝胰腺坏死病致病菌进行多位点序列分型(MLST)。Machado等[18-19]开发了基于fur基因的弧菌科属种分类鉴定方法,克服了16S rRNA基因序列在弧菌科属种分类鉴定中区分度低的问题。
台州是浙江省海水养殖凡纳滨对虾的重要产区。台州本地的海水养殖凡纳滨对虾产业也正面临着急性肝胰腺坏死病的威胁,但至今未见台州急性肝胰腺坏死病致病菌株及其药敏特性的详细研究报道。基于此,笔者自台州本地凡纳滨对虾养殖场分离对虾急性肝胰腺坏死病致病菌株,并对致病菌株进行分子鉴定、药敏性研究和渔用消毒剂的杀菌试验,以期为台州凡纳滨对虾急性肝胰腺坏死病的防治提供技术支撑和理论参考。
1 材料与方法
1.1 培养基与主要试剂
弧菌检测培养基(硫代硫酸盐柠檬酸盐胆盐蔗糖培养基,青岛高科园海博生物技术有限公司);Taq DNA聚合酶[宝日医生物技术(北京)有限公司];胰蛋白胨大豆肉汤培养基,药敏纸片(杭州微生物试剂有限公司);Mueller-Hinton琼脂(杭州百思生物技术有限公司);柱式细菌基因组DNA抽提试剂盒[生工生物工程(上海)股份有限公司];海水晶(台州市盐业有限公司);新洁尔灭、过氧乙酸(山东瑞泰奇洗涤消毒科技有限公司);二氧化氯(仙桃市湖滨渔跃水产药业有限公司)。其他试剂均购自国药集团化学试剂有限公司或生工生物工程(上海)股份有限公司。
1.2 弧菌分离与培养
于2018年在对虾养殖场采集发病凡纳滨对虾,用接种环蘸取病虾的肝胰腺部位,划线于弧菌检测琼脂平板上,30 ℃培养24 h。次日,自弧菌检测琼脂平板上随机挑取绿色单菌落10个,划线于3%氯化钠的LB平板上,进行单菌落纯化,反复划线纯化单菌落4次,将纯化的10个单菌落于-80 ℃甘油管冻存。
1.3 PCR检测
用柱式细菌基因组抽提试剂盒抽提细菌基因组,以基因组DNA为模板,分别用表1中的引物进行PCR,PCR扩增产物经1%琼脂糖凝胶电泳分离,再用凝胶成像系统检测,并送生工生物工程(上海)股份有限公司测序。
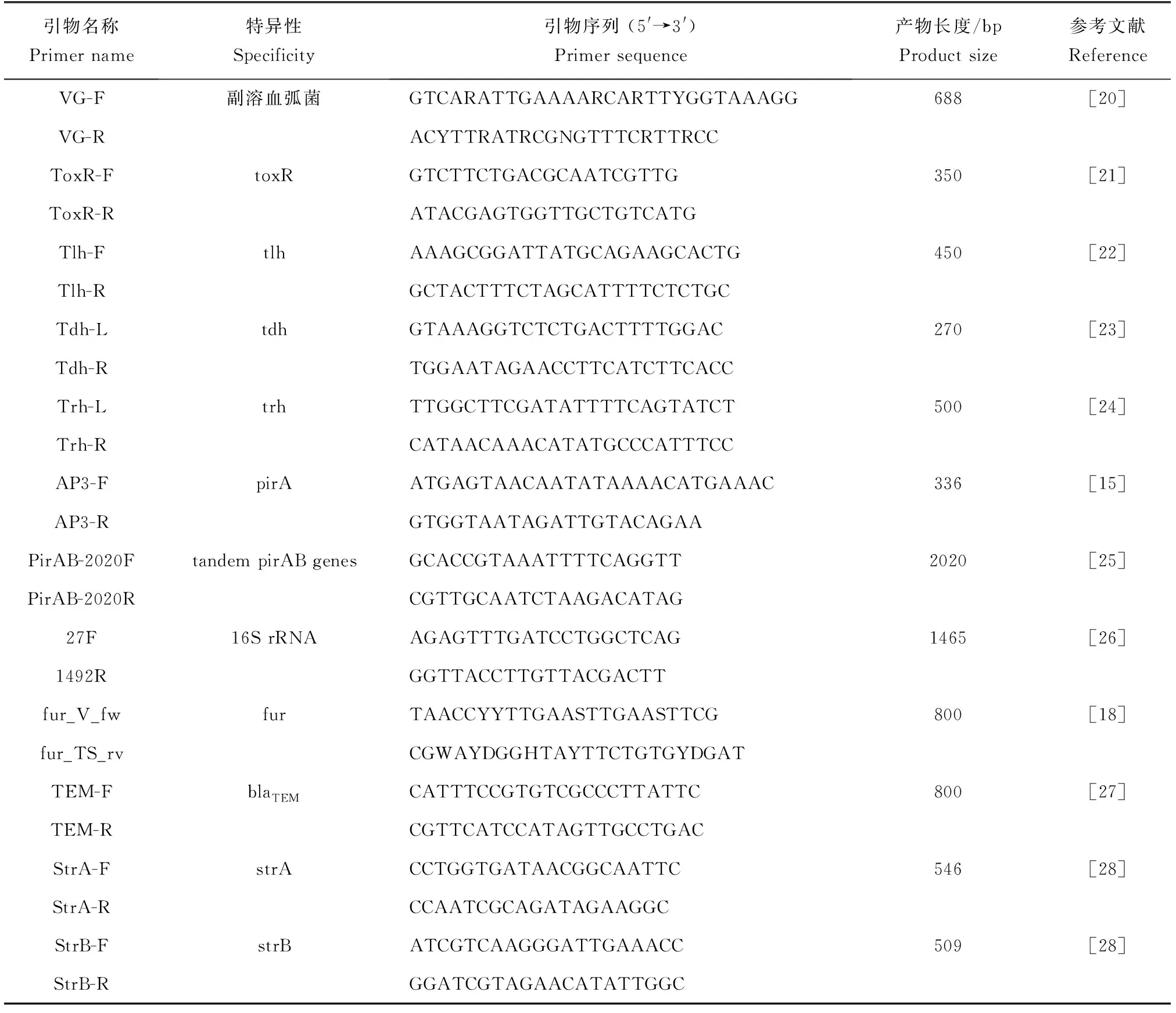
表1 引物序列Tab.1 Primer sequences used in the experiment
1.4 对虾攻毒试验
病原菌株的毒性鉴定参考文献[29]的浸泡攻毒方法,略有调整:由附近养殖场采集健康的凡纳滨对虾(约1 g),在人工海水(每千克海水晶兑33 L蒸馏水)中适应4~5 d。每组15尾对虾,设置3个平行组;试验组浸泡于病菌600 mm光密度值(OD600)=1的人工海水中,对照组浸泡于无病菌的人工海水中,浸泡15 min。将浸泡后的对虾取出,试验组转入病原菌OD600=0.01的3 L海水中,对照组转入3 L的无病原菌人工海水中。试验持续7 d,水温控制在25 ℃,每日正常投喂、吸污、换水,记录对虾死亡情况,死亡对虾及时捞出,最后统计对虾累积死亡率。
1.5 药敏试验
用纸片琼脂扩散法进行药敏试验:自新鲜胰蛋白胨大豆肉汤平板上挑取单菌落,接种于胰蛋白胨大豆肉汤培养基中, 37 ℃,200 r/min恒温振荡培养过夜;以1∶100(V/V)的比例转接至新鲜的胰蛋白胨大豆肉汤培养基中,37 ℃,200 r/min继续振荡培养5 h后,待菌液的OD600达到2时,取100 μL菌液,均匀涂布于3%氯化钠的Mueller-Hinton琼脂平板上,超净工作台静置15 min,贴上药敏纸片,置于37 ℃培养箱中培养24 h。培养结束后测量并记录抑菌圈直径,每种抗生素做3个平行。用大肠杆菌(Escherichiacoli)ATCC25922作为质控菌(特别说明的除外),受试菌株对21种抗生素的药敏性参照美国临床和实验室标准协会的方法和标准。
1.6 渔用消毒剂杀菌试验
将30 ℃、200 r/min恒温摇床振荡过夜培养的菌液加入到100 mL人工海水中,使人工海水中菌株HY3菌液的终密度约为1×106cfu/mL,每批次试验采用同一批新鲜HY3菌液进行;再分别加入消毒剂稀释液,30 ℃培养箱中静置孵育2 h后,适当稀释并涂布营养平板;30 ℃培养24~48 h后计数,取平均值,计算消毒剂的杀菌效果。每种消毒剂设1/5A、A和10A这3个剂量(A为渔业常规使用剂量),每个梯度设3个平行组。根据产品有效含量进行换算,次氯酸钙、二氧化氯、高锰酸钾、新洁尔灭和过氧乙酸的质量浓度值A分别为1.0、0.3、10.0、1.0、1.0 mg/L。
2 结 果
2.1 急性肝胰腺坏死病致病菌分离及分子鉴定
自台州凡纳滨对虾养殖场分离到10株在弧菌检测琼脂平板上呈绿色单菌落,分别抽取基因组后利用AP3-F/AP3-R检测致病基因,其中6株有阳性条带,16S rRNA测序显示,这6株高度相似,均可能为急性肝胰腺坏死病致病菌,选择其中编号为HY3菌株进行后续试验。HY3菌株在弧菌检测琼脂平板上呈圆形、表面光滑的绿色菌落。用引物VG-F/VG-R进行PCR,扩增出约700 bp的特异性条带(图1)并送测序,测序结果表明,菌株HY3为弧菌属细菌;分别用引物ToxR-F/ToxR-R、Tlh-F/Tlh-R和AP3-F/AP3-R进行PCR,依次扩增出约350、450、340 bp特异性条带(图1),菌株HY3含有toxR、tlh基因和pirA基因;再用引物Tdh-L/Tdh-R和Trh-L/Trh-R进行PCR,未扩增出预期条带(图1)。为进一步分析菌株HY3的pirA、pirB基因序列特征,用引物PirAB-2020F/PirAB-2020R扩增pirA、pirB基因及其部分上下游序列,测序结果显示,菌株HY3的pirA和pirB基因序列与相关报道的结果一致(GenBank登陆号MH718270)。

图1 菌株HY3 PCR分析Fig.1 PCR analysis of strain HY3M.DNA分子量标准; 1~6分别为引物VG-F/R、ToxR-F/R、Trh-F/R、Tlh-F/R、Tdh-F/R、AP3-F/R的PCR扩增条带.M.DNA marker; Lanes 1—6.PCR products by primers VG-F/R, ToxR-F/R, Trh-F/R, Tlh-F/R, Tdh-F/R and AP3-F/R, respectively.
为确定菌株HY3的分类地位,用引物27F/1492R对菌株HY3的16S rRNA基因序列进行分析并构建系统进化树,结果显示,菌株HY3与副溶血弧菌聚为一支(图2)。进一步,用引物fur_V_fw/fur_TS_rv对菌株HY3的fur基因进行序列分析并构建系统进化树,结果显示,菌株HY3与副溶血弧菌聚为一支(图3)。结合菌株HY3在弧菌检测琼脂平板上的菌落特征,最后鉴定菌株HY3为副溶血弧菌。
2.2 回接感染试验
采用浸泡攻毒方法对副溶血弧菌HY3的致病性进行试验。典型的结果见图4a,与未接种的对照组相比,接种副溶血弧菌HY3的凡纳滨对虾表现出空肠、空胃,肝胰腺发黄或发白症状。统计累积死亡率显示,浸泡攻毒处理组的对虾累积死亡率随着试验时间的延长而增多,感染后第3 d对虾累积死亡率超过50%,在第7 d时对虾的累积死亡率接近100%,而对照组在试验过程中未发生死亡现象(图4b)。

图2 基于16S rRNA 基因序列构建的菌株HY3与相近典型菌株的系统进化树Fig.2 Phylogenetic tree of strain HY3 and other related typical strains based on 16S rRNA sequences系统进化树采用邻接法构建;分支数表示1000次Bootstrap重抽样分析的支持百分比;图例0.001为遗传距离.The phylogenetic tree is generated using the neighbor-joining method; the number of branches indicates the percentage of support for 1 000 bootstrap resampling analysis; the legend 0.001 is the genetic distance.

图3 基于fur基因序列构建的菌株HY3与相近菌株的系统进化树Fig.3 Phylogenetic tree of strain HY3 and other related strains based on the fur gene sequences系统进化树采用邻接法构建;分支数表示1000次Bootstrap重抽样分析的支持百分比;图例0.02为遗传距离.The phylogenetic tree is generated using the neighbor-joining method; the number of branches indicates the percentage of support for 1000 bootstrap resampling analysis; the legend 0.02 is the genetic distance.

图4 凡纳滨对虾感染副溶血弧菌HY3的死亡率Fig.4 Mortalities of Pacific white shrimp L. vannamei infected with V. parahaemolyticus HY3a.感染副溶血弧菌HY3后的凡纳滨对虾特征; b.感染副溶血弧菌HY3后的累积死亡率.a.characteristics of Pacific white shrimp L. vannamei infected with V. parahaemolyticus HY3; b.cumulative mortality of Pacific white shrimp L. vannamei infected with V. parahaemolyticus HY3.
2.3 药敏分析
用药敏纸片法对21种抗生素进行药敏试验,结果显示,副溶血弧菌HY3对不同抗生素的敏感性不同。其中,副溶血弧菌HY3对头孢他啶、头孢哌酮、头孢吡肟、头孢曲松、头孢噻肟、头孢替坦、萘啶酸、诺氟沙星、环丙沙星、亚胺培南、美罗培南、庆大霉素、妥布霉素、氯霉素、四环素、呋喃妥因、氨苄西林/舒巴坦表现为敏感;对卡那霉素、丁胺卡那表现为中度敏感;而对链霉素、氨苄西林表现为耐药(表2)。

表2 副溶血弧菌HY3的药敏分析Tab.2 Drug susceptibility of V. parahaemolyticus HY3
2.4 抗生素抗性基因检测
为探究副溶血弧菌HY3对链霉素和氨苄西林的耐药机制,用抗生素抗性基因检测引物TEM-F/TEM-R、StrA-F/StrA-R和StrB-F/StrB-R分别对副溶血弧菌HY3基因组进行扩增(图5)。引物TEM-F/TEM-R、StrA-F/StrA-R和StrB-F/StrB-R分别扩增出大小约为800、500、500 bp特异条带,与预期的条带大小一致。将PCR扩增条带进行测序,结果进一步证实,副溶血弧菌HY3含有抗生素抗性基因blaTEM、strA-strB。

图5 抗生素抗性基因PCR凝胶电泳检测结果Fig.5 Electrophoresis analysis of PCR product of antibiotic resistance genes M.DNA 分子量标准; 1~3分别为引物TEM-F/R、StrA-F/R、StrB-F/R的PCR扩增条带.M.DNA marker; lanes 1—3.PCR products by primers TEM-F/R, StrA-F/R and StrB-F/R, respectively.
2.5 渔用消毒剂杀菌试验
对次氯酸钙、新洁尔灭、过氧乙酸、二氧化氯和高锰酸钾这5种常用的渔用消毒剂进行杀菌试验。结果显示,消毒剂的种类和剂量对副溶血弧菌HY3的杀菌效果影响很大(表3)。在常用剂量下的杀菌效果为高锰酸钾>过氧乙酸>次氯酸钙>新洁尔灭>二氧化氯,其中,质量浓度10 mg/L高锰酸钾溶液处理2 h的杀菌率达到99.99%。

表3 5种消毒剂对副溶血弧菌HY3的杀菌试验Tab.3 Efficacy of five disinfectants onV. parahaemolyticus HY3 killing
3 讨 论
3.1 对虾急性肝胰腺坏死病菌的致病基因
自台州养殖凡纳滨对虾养殖场中分离到的急性肝胰腺坏死病致病菌被鉴定为副溶血弧菌,这与报道的副溶血弧菌是常见的急性肝胰腺坏死病致病菌相符。由于副溶血弧菌有携带人类临床致病基因tdh(耐热性溶血毒素)和trh(耐热性溶血毒素相关的溶血毒素)的风险,因而对副溶血弧菌HY3进行了tdh和trh的PCR检测,结果表明,副溶血弧菌HY3不含人类临床致病基因tdh和trh。类似的,Joshi等[3]报道了从泰国分离的急性肝胰腺坏死病致病性副溶血弧菌菌株和Soto-Rodriguez等[7]报道了从墨西哥分离的急性肝胰腺坏死病致病性副溶血弧菌菌株也均不携带tdh和trh基因。因此可以认为,急性肝胰腺坏死病致病性副溶血弧菌导致人虾共患疾病的可能性很小[1]。
3.2 对虾急性肝胰腺坏死病菌的耐药性
急性肝胰腺坏死病致病性副溶血弧菌的耐药性问题已经引起了人们的重视。贾丹等[17]研究发现,急性肝胰腺坏死病致病性副溶血弧菌菌株20160303005-1对庆大霉素、环丙沙星和头孢他啶等16种药物敏感,对阿莫西林、替卡西林、头孢呋辛、头孢噻吩和复方新诺明表现为耐药。Lai等[30]对7株急性肝胰腺坏死病相关副溶血弧菌进行药敏试验,结果显示,这些副溶血弧菌普遍对氨苄西林、链霉素、磺胺甲恶唑、磷霉素和二环霉素具有抗药性。Dong等[31]对急性肝胰腺坏死病致病菌株Vp2S01进行了药敏试验,结果显示,菌株Vp2S01只对氟苯尼考敏感,而对氨苄西林、链霉素和四环素等14种抗生素耐药。Han等[32]研究发现,急性肝胰腺坏死病致病菌性副溶血弧菌对较高质量浓度(≥5 μg/mL)的四环素耐药,并检测到了tetB抗性基因。在本试验中,副溶血弧菌HY3对氨苄西林和链霉素耐药,并检测到了相应的抗性基因blaTEM和strA-strB。由此可见,不同地区分离的急性肝胰腺坏死病致病菌株的耐药性不尽相同,实际防治过程中需要针对性地用药,才能起到良好的防治效果。考虑到抗生素的大量使用或滥用与耐药性间的相关性,在实际的对虾养殖过程中,应尽量减少抗生素药剂的使用。甄晓然等[33]自海洋滩涂沉积物中分离到1株普罗威登斯菌(Providenciasp.),其对急性肝胰腺坏死病致病性副溶血弧菌具有高效拮抗作用,为对虾急性肝胰腺坏死病的防控提供了新的思路。
3.3 渔用消毒剂的防治应用
对养殖海水进行定期消毒是常见的防治手段,二氧化氯、漂白粉、过氧乙酸等是常见的渔用消毒剂。张继平等[34]认为,稳定性二氧化氯可应用于凡纳滨对虾的疾病防治。刘志轩等[35]研究了4种消毒剂对急性肝胰腺坏死病致病性弧菌的杀灭作用,发现杀菌能力依次为聚六亚甲基胍>双氧水>二氧化氯>聚维酮碘。本试验结果显示,高锰酸钾和过氧乙酸对急性肝胰腺坏死病致病性副溶血弧菌HY3的杀菌效果较好。由此可见,正确选择消毒剂对防控急性肝胰腺坏死病致病菌具有重要的现实意义和指导作用。
4 结 论
台州凡纳滨对虾养殖场中引起对虾急性肝胰腺坏死的致病菌主要是副溶血弧菌,检测显示,分离株对氨苄西林、链霉素有抗性。并且,检测显示分离株不携带人类临床致病基因tdh(耐热性溶血毒素)和trh(耐热性溶血毒素相关的溶血毒素),对人的风险低。此外,台州凡纳滨对虾养殖场防治对虾急性肝胰腺坏死病需要避免使用氨苄西林、链霉素,可以采用高锰酸钾作为养殖场消毒剂防治该病。

