维生素E对尼罗罗非鱼生长和性腺发育影响的研究
张 旭,唐瞻杨,2,黄 凯,王丽群,宿志健,刘 婷,王婧杰,麻艳群
( 1.广西大学 动物科学技术学院,广西 南宁 530004; 2.广西水产科学研究院,广西 南宁 530021 )
维生素是机体生命活动中必需的一种微量化合物,对机体生长、繁育等具有促进作用[1]。作为维生素家族的一员,维生素E俗称生育酚,可促进鱼类生长、提高免疫力、增强抗氧化性、提高生产性能等,在鱼类生命活动中起重要作用[2]。维生素E是鱼类机体不可或缺的物质且自身无法合成需在食物中摄入,饲料中维生素E含量将影响鱼类体内维生素E水平,长时间缺乏维生素E将会给鱼类带来不良影响[3]。维生素E在水生生物应用方面的研究报道已有很多,如细鳞鲑(Brachymystaxlenok)[4]幼鱼和胭脂鱼(Myxocyprinusasiaticus)[5]幼鱼饲料中维生素E需求量的研究显示,饲料中添加适量维生素E可以显著提高细鳞鲑幼鱼和胭脂鱼幼鱼的生长指数;在饲料中添加90 mg/kg剂量的维生素E可以显著促进吉富罗非鱼(Oreochromisniloticus)[2]的生长;缺乏维生素E鲤鱼(Cyprinuscarpio)[6]性腺的发育指数明显降低;饲料中添加600 mg/kg维生素E可显著提高金鲫(Carassiusauratusred)[7]性腺发育指数;
饲料中添加维生素E促进了吉富罗非鱼[8]的生殖和免疫功能。
罗非鱼作为动物蛋白的主要来源在我国渔业经济中发挥了重要的作用[9]。维生素E对尼罗罗非鱼(O.niloticus)肠道形态结构及性腺发育组织学影响等方面尚缺乏研究。组织切片可用于观察细胞形态、判断组织发育状况等,是反映组织形态变化的最有效方法[10-11]。樊佳伟等[12]对斜带石斑鱼(Epinepheluscoioides,♀)×鞍带石斑鱼(E.lanceolatus,♂)的受精细胞组织切片进行了观察。随着组织切片技术的不断优化,其在斑马鱼(Daniorerio)[13]、吉富罗非鱼[14]、草鱼(Ctenopharyngodonidellus)[15]等水生生物中已得到广泛应用。笔者对不同维生素E水平下雌、雄尼罗罗非鱼肠道和性腺石蜡组织切片进行分析,拟从组织学角度探讨维生素E对尼罗罗非鱼肠道及性腺发育产生的影响。试验结果将为尼罗罗非鱼组织学研究提供理论基础,亦为今后尼罗罗非鱼产业健康可持续发展提供技术支撑。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 试验鱼
试验鱼来源于广西水产科学研究院,分别挑选健康、有活力的雌性尼罗罗非鱼和雄性尼罗罗非鱼作为试验对象,试验开始前在温度(28.0±0.5) ℃、pH 8.0的环境中暂养10 d,暂养期间正常投食。
1.1.2 试剂
无水乙醇、二甲苯、盐酸、氨水和中性树胶(国药集团化学试剂有限公司),苏木素—伊红染液(武汉谷歌生物科技),4%多聚甲醛通用型组织固定液(广西南宁楚杰生物科技有限公司)。
1.1.3 仪器
脱水机(武汉俊杰电子有限公司JJ-12J)、包埋机(武汉俊杰电子有限公司JB-P5)、切片机(上海徕卡仪器有限公司RM2016)、烘箱(上海慧泰仪器制造有限公司DHG-9140A)、正置光学显微镜(日本尼康Nikon Eclipse CI)。
1.2 饲料制备
试验基础饲料由百洋产业投资集团股份有限公司提供,原料组成包括:玉米、次粉、鱼粉、豆粕、菜粕、磷酸二氢钙、氯化钠等。维生素E(98%)由源叶生物提供,以30 mL/kg大豆油为溶剂。基础饲料中添加不同剂量维生素E制备5种试验饲料,分别为0 mg/kg组、40 mg/kg组、80 mg/kg组、120 mg/kg组和160 mg/kg组,饲料混合均匀后密封于低温干燥处保存备用,试验饲料营养水平见表1。
1.3 试验设计
养殖试验时间为2019年7月15日—8月14
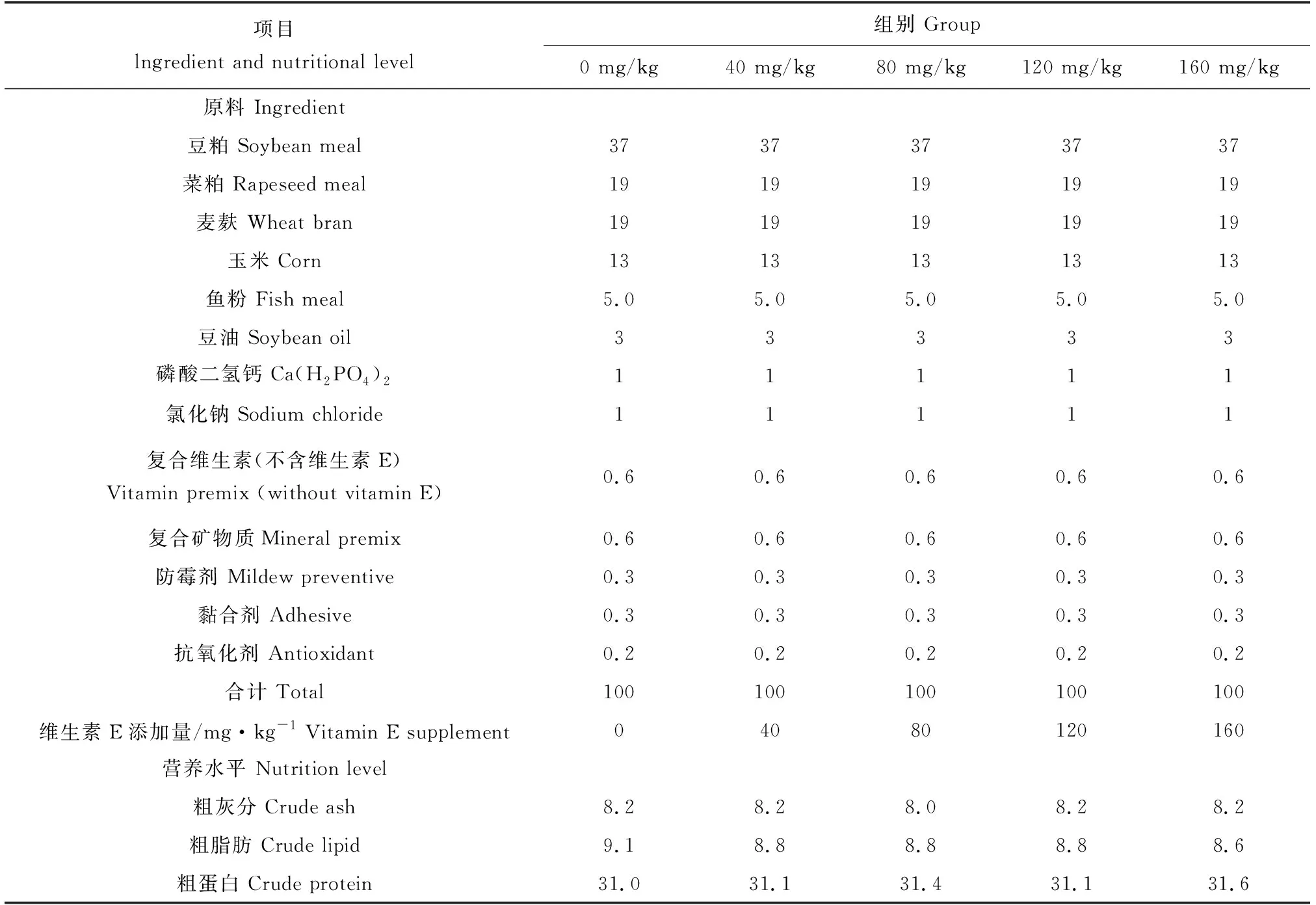
表1 饲料的组成与营养水平 %Tab.1 The ingredients and nutritional levels of the diet
日,为期30 d。试验共设10个组别,分别为:雌性尼罗罗非鱼对照组(0 mg/kg组),雌性尼罗罗非鱼试验组(40 mg/kg组、80 mg/kg组、120 mg/kg组和160 mg/kg组);雄性尼罗罗非鱼对照组(0 mg/kg组),雄性尼罗罗非鱼试验组(40 mg/kg组、80 mg/kg组、120 mg/kg组和160 mg/kg组)。每个试验组3个平行,每个平行30尾试验鱼,养殖期间保持养殖环境不变,同一编号雌性、雄性尼罗罗非鱼投喂相同饲料。试验雌性尼罗罗非鱼初始体质量为(19.81±3.90) g,初始全长为(9.73±0.66) cm,试验雄性尼罗罗非鱼初始体质量为(18.55±3.65) g,初始全长为(9.75±0.71) cm。养殖用水为曝晒除氯自来水,换水1次/3 d。每日9:00和17:00各饱食投喂1次,饲料以1 h内吃完为基准,养殖期间试验鱼状况良好均未出现染病及死亡现象。
1.4 生长参数测定
养殖试验结束后,分别测量雌、雄尼罗罗非鱼全长、体质量,计算生长参数:
特定生长率/%·d-1=(lnm2-lnm1)/t×100%
质量增加率/%=(m2-m1)/m1×100%
相对增长率/%=(L2-L1)/L1×100%
式中,m1为试验鱼初始体质量(g),m2为试验鱼终末体质量(g),L1为试验鱼初始全长(cm),L2为试验鱼终末全长(cm),t为养殖时间(d)。
1.5 肠道及性腺组织分析
试验结束时,在雌性、雄性每组试验鱼中分别随机选取3尾,用鱼安定麻醉处理后立即在冰盘上解剖采集中肠和性腺组织,随即浸泡于4%多聚甲醛通用型组织固定液进行固定。
石蜡组织切片制作方法如下:
脱水机脱水、浸蜡过程:75%酒精4 h→85%酒精2 h→90%酒精2 h→95%酒精1 h→无水乙醇Ⅰ 30 min→无水乙醇Ⅱ 30 min→醇苯5~10 min→二甲苯Ⅰ 5~10 min→二甲苯Ⅱ 5~10 min→蜡Ⅰ 1 h→蜡Ⅱ 1 h→蜡Ⅲ 1 h。包埋机、切片机分别进行包埋和切片处理,片厚4 μm,60 ℃烘箱烤片。
脱蜡程序:二甲苯Ⅰ 20 min→二甲苯Ⅱ 20 min→无水乙醇Ⅰ 10 min→无水乙醇Ⅱ 10 min→95%酒精5 min→90%酒精5 min→80%酒精5 min→70%酒精5 min→蒸馏水洗。
苏木精—伊红染色过程:苏木精染3~8 min,自来水冲洗,1%盐酸酒精分化数秒,自来水冲洗,0.6%氨水返蓝,流水冲洗,伊红染液染色1~3 min。
脱水封片过程:95%酒精Ⅰ 5 min→95%酒精Ⅱ 5 min→无水乙醇Ⅰ 5 min→无水乙醇Ⅱ 5 min→二甲苯Ⅰ 5 min→二甲苯Ⅱ 5 min中脱水透明处理,切片从二甲苯取出稍晾干,中性树胶封片。
使用正置光学显微镜对每张性腺和肠道组织切片进行拍照,在每张肠道切片中随机选取3根完整绒毛应用Image-Pro Plus 6.0软件分别测量绒毛高度(mm)、肌层厚度(mm)、绒毛中间区域宽度(mm)并求平均值。
1.6 数据分析
试验数据由SPSS 17.0统计软件进行统计分析, 利用Duncan′s 功能进行多重比较分析, 差异显著水平为0.05。
2 结 果
2.1 生长参数
尼罗罗非鱼生长参数见表2。饲料中添加维生素E对雌性尼罗罗非鱼终末体质量、终末全长、质量增加率、相对增长率和特定生长率均起到促进作用,其中添加量为120 mg/kg时作用效果最佳(P<0.05)。维生素E添加量为160 mg/kg时雄性尼罗罗非鱼终末体质量、质量增加率和特定生长率达到最大值(P<0.05)。饲料中添加维生素E对雄性尼罗罗非鱼终末全长和相对增长率无显著影响(P>0.05)。以饲料中维生素E添加量为自变量,雌、雄尼罗罗非鱼质量增加率为因变量,分别将雌、雄尼罗罗非鱼质量增加率(y)与维生素E添加量(x)进行回归分析,回归方程如下:
雌性:y=-8×10-5x2+0.0173x+0.8434 (r2=0.9875)
雄性:y=0.0051x+1.9059 (r2=0.9225)
经回归分析发现,雌性、雄性尼罗罗非鱼体质量增加率与维生素E添加量的回归曲线拟合优度r2分别为0.9875和0.9225,说明回归曲线对观测值的拟合程度较好满足试验分析。试验结果表明,雌性尼罗罗非鱼质量增加率在维生素E添加量为120 mg/kg时达到最大值,雄性尼罗罗非鱼质量增加率在维生素E添加量为160 mg/kg时达到最大值。
2.2 肠绒毛参数
尼罗罗非鱼雌鱼、雄鱼中肠组织形态结构见图1。对每张切片绒毛高度、绒毛宽度和肌层厚度进行分析发现,饲料中维生素E添加量为80 mg/kg时,雌性尼罗罗非鱼肌层厚度最大(P<0.05)(表3);维生素E添加量为120 mg/kg时,雌性尼罗罗非鱼绒毛宽度显著升高(P<0.05)。饲料中添加维生素E对雄性尼罗罗非鱼中肠组织形态结构无显著影响(P>0.05)。

表2 雌性、雄性尼罗罗非鱼的性状参数Tab.2 Growth parameters of male and female Nile tilapia O. niloticus

表3 肠道形态学参数 mmTab.3 Intestinal morphological parameters
2.3 性腺发育指数
尼罗罗非鱼卵巢、精巢组织发育情况见图2,参照文献[16]的性腺分期方法对尼罗罗非鱼性腺发育情况进行分析。尼罗罗非鱼卵巢发育情况:0 mg/kg(♀)组卵巢组织细胞形态不规则,细胞质呈嗜碱性被染成深蓝色,细胞核呈嗜酸性被染成红色,细胞核内出现多个核仁,属Ⅱ期卵巢(图2a)。40 mg/kg(♀)组、80 mg/kg(♀)组和160 mg/kg(♀)组卵巢组织细胞形态规则多为圆形,细胞质、细胞核颜色减弱,胞内出现不规则空泡,核仁紧贴核膜排布,属Ⅲ期卵巢(图2b,c,e)。120 mg/kg(♀)组卵巢组织细胞变大,核膜开始溶解,核仁消失,细胞质内充满大的卵黄颗粒与空泡交错排列,属Ⅴ期卵巢(图2d)。试验结果显示,维生素E含量为120 mg/kg时尼罗罗非鱼卵巢发育程度最好,属Ⅴ期卵巢。
尼罗罗非鱼精巢发育情况:0 mg/kg(♂)组和40 mg/kg(♂)组精巢组织中初级精母细胞较多且细胞较小,细胞形态规则多为圆形,细胞核染色较深,属Ⅱ期精巢(图2f,g)。80 mg/kg(♂)组和120 mg/kg(♂)组精巢组织中次级精母细胞、初级精母细胞和精子细胞并存,细胞核嗜碱性染色较深,属Ⅲ期精巢(图2h,i)。160 mg/kg(♂)组精巢组织中发现精小管含有大量精子细胞以及少数成熟精子,精子细胞没有明显核质界限,染色较深,属Ⅳ期精巢(图2j)。在维生素E添加量为160 mg/kg时尼罗罗非鱼精巢发育程度最高,属Ⅳ期精巢。

图2 尼罗罗非鱼性腺组织(♀:卵巢; ♂:精巢)切片Fig.2 The gonad histological section of Nile tilapia O. niloticus (♀:ovary; ♂:testis)N.细胞核; Nu.核仁; PS.初级精母细胞; Sp.精子; St.精子细胞; YV.卵黄泡; ZR.放射带.N.nucleus; Nu.nucleolus; PS.primary spermatocyte; Sp.sperm; St.spermatid; YV.yolk vesicle; ZR.zona radiata.
3 讨 论
3.1 维生素E对尼罗罗非鱼生长性能的影响
大量研究结果表明,维生素E是鱼类维持正常生命活动的必需物质,缺乏维生素E会引起鱼体各项机能发生紊乱,不利于鱼类的生长发育[3]。王源等[17]研究表明,在饲料中添加30 mg/kg维生素E可显著促进三文鱼生长发育;刘汉鹏[18]研究表明,在七彩神仙鱼(Symphysodonharaldi)幼鱼饲料中添加80 mg/kg维生素E可显著促进其生长发育。常杰等[4,19]研究表明,适量维生素E可改善细鳞鲑幼鱼和玛拉巴石斑鱼(E.malabaricus)的生长性能;张志强等[5]在胭脂鱼幼鱼对维生素E需求量的研究中发现,饲料中维生素E添加量为50.60 mg/kg时获得最大生长性能。本试验结果表明,饲料中维生素E添加量为120 mg/kg时雌性尼罗罗非鱼生长性能最佳,雄性尼罗罗非鱼在维生素E添加量为160 mg/kg时生长性能最佳,饲料中添加适量维生素E可显著提高尼罗罗非鱼生长性能,这与上述研究结果相符。此外,物种不同或相同物种生长阶段不同都会造成对维生素E的需求量不同[20-22],推测尼罗罗非鱼雌鱼与雄鱼由于所处生长发育阶段不同造成了维生素E最适添加量的差异。
3.2 维生素E对尼罗罗非鱼消化道结构的影响
肠道是鱼类进食后消化吸收的重要器官,其绒毛形态和肌层厚度将影响鱼类的消化吸收能力[23-24]。肠绒毛作为肠道内部消化吸收的主要部位,其长度和宽度影响肠道内部消化吸收的表面积,面积越大则肠道消化吸收营养物质的效率越高;肌层厚度影响肠道肌肉蠕动能力,能力越强越有利于肠道内物质的运输和吸收[25]。王坛等[26]研究发现,饲用溶菌酶可以显著促进吉富罗非鱼肠道绒毛高度,对吉富罗非鱼的生长起到促进作用;胡海滨等[27]在大豆黄酮对大菱鲆(Scophthalmusmaximus)生长、消化酶活力、抗氧化力及肠道结构影响的研究中发现,适量的大豆黄酮可以改善大菱鲆后肠肠道结构,保护肠道结构完整性。本试验中,维生素E添加量为80 mg/kg时雌性尼罗罗非鱼肌层厚度显著升高,维生素E添加量为120 mg/kg时雌性尼罗罗非鱼绒毛宽度显著升高,同样维生素E添加量条件下雌性尼罗罗非鱼生长均受到显著促进作用,由此可知,饲料中添加维生素E可以通过改善雌性尼罗罗非鱼肠道组织形态结构,提高肠道消化吸收能力进而促进雌性尼罗罗非鱼的生长发育。但本试验结果发现,饲料中添加维生素E对雄性尼罗罗非鱼肠道组织结构影响不显著,推测试验鱼性别不同造成了维生素E需求量的不同,雄性尼罗罗非鱼对维生素E需求量的研究还有待进一步深入。综上所述,饲料中添加适量维生素E可改善雌性尼罗罗非鱼绒毛形态和肌层厚度,提高雌性尼罗罗非鱼的消化吸收能力,促进雌性尼罗罗非鱼的生长。
3.3 维生素E对尼罗罗非鱼繁殖性能的影响
维生素E作为一类酚类化合物与机体固醇类激素合成密切相关,其在促进水生动物性腺发育提高繁殖性能等方面具有重要的作用[28]。大量研究表明,维生素E对半滑舌鳎(Cynoglossussemilaevis)[29]、克氏原螯虾(Procambarusclarkii)[30]、鲤鱼[6]、金鲫[7]等水生动物的繁殖性能均有显著促进作用。本试验结果表明,维生素E对尼罗罗非鱼卵巢、精巢发育均起到促进作用,其中,维生素E添加量为120 mg/kg时,尼罗罗非鱼卵巢发育成熟度最好,维生素E添加量为160 mg/kg时,尼罗罗非鱼精巢发育成熟度最好,这与上述研究结果相符。
4 结 论
维生素E作为一种重要的微量营养因子和天然的抗氧化剂,是存在于所有细胞膜和细胞器中的高效生物抗氧化剂,与动物生长发育密切相关。饲料中添加适量维生素E不但可以有效调控性腺中类固醇激素的生物合成,促进机体性腺发育提高动物的繁殖性能,而且也可以调节动物机体新陈代谢促进动物机体的生长。

