环醚开环反应用于构建呋喃并[3,2-b]吡啶骨架
范威
(滁州城市职业学院科研处,安徽滁州239000)
呋喃并吡啶骨架可分为呋喃并[3,2-b]吡啶、呋喃并[3,2-c]吡啶、呋喃并[3,4-c]吡啶等,如图 1所示,具有众多药理活性[1-3]。通过文献调研,发现已有不同的途径构建了呋喃并吡啶骨架[4-7],但金属催化[8]、催化剂昂贵[9]、溶剂致癌[10]等缺点制约了该类衍生物的批量合成。寻找更绿色地合成该类衍生物的方法,还需深入研究。

图1 呋喃并吡啶骨架
文献[11]用吡啶-N-氧化物衍生物和酰氯或酸酐反应,以50%~91%的产率合成了呋喃并[2,3-b]吡啶,见图2。

图2 合成呋喃并[2,3-b]吡啶
文献[12]以氨基吡啶、异腈、醛基吡啶三组分为原料,微波条件下合成了呋喃并[2,3-c]吡啶衍生物,见图3。

图3 合成呋喃并[2,3-c]吡啶
文献[9]报道了活性亚甲基异腈和烯炔酮的[3+3]环化反应,合成了呋喃并[3,2-c]吡啶,见图4。

图4 合成呋喃并[3,2-c]吡啶
文献[13]通过氮杂邻醌甲基化物和呋喃的[4+2]环加成反应,室温条件下合成了呋喃并[3,2-b]吡啶,见图5。

图5 合成呋喃并[3,2-b]吡啶
文献[14]用醇作为亲核试剂和溶剂,通过炔基取代的喹啉醛的分子内环化反应,合成了呋喃并[3,4-b]吡啶,见图 6。
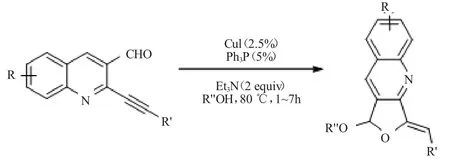
图6 合成呋喃并[3,4-b]吡啶
文献[15]发展了炔丙烯与氰基的 Diels-Alder反应,通过[2+2+2]过程,构建了呋喃并[3,4-c]吡啶骨架,见图7。
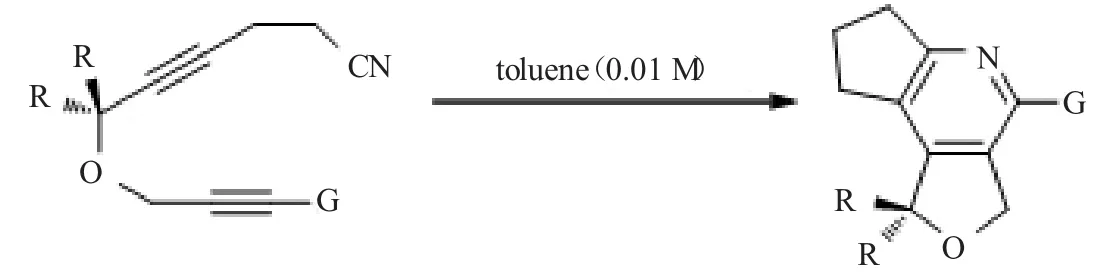
图7 合成呋喃并[3,4-c]吡啶
本课题组用碱催化芳胺烯酯和环醚,通过环醚的开环和C-C键、C-N键的构建,合成了呋喃并[3,2-b]吡啶衍生物,实现了三元环醚向六元吡啶的转变。该反应无需金属、催化剂廉价、溶剂绿色环保,见图8。
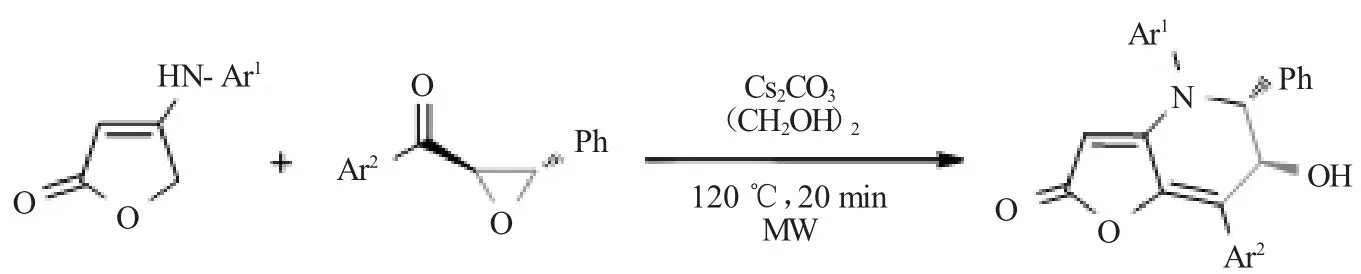
图8 合成呋喃并[3,2-b]吡啶
1 材料与方法
1.1 仪器与试剂
仪器:熔点仪、核磁共振仪、质谱仪、红外光谱仪;试剂:呋喃二酮、芳胺、苯甲醛、α-溴代芳基乙酮。
1.2 原料制备方法
制备芳胺烯酯:以呋喃二酮和芳胺为原料,1,4-二氧六环为溶剂,室温条件下反应,制得芳胺烯酯,如图9所示。
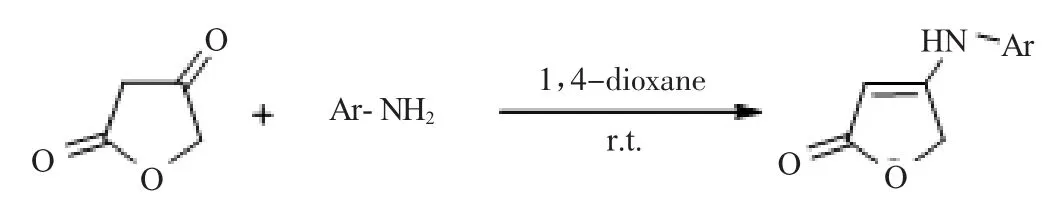
图9 制备芳胺烯酯
制备环醚:在二氯甲烷中,以DBU催化苯甲醛和α-溴代芳基乙酮,-20℃条件下制得了环醚,如图10所示。
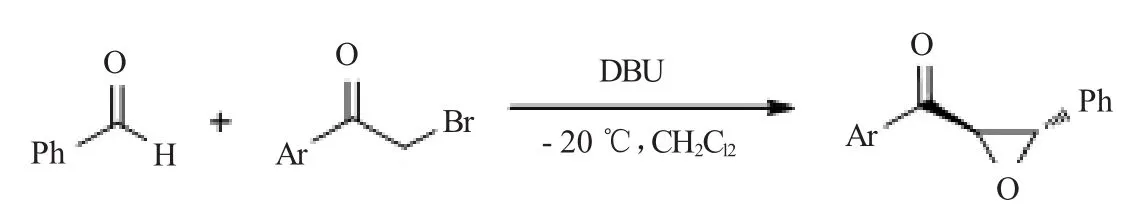
图10 制备环醚
2 结果与分析
2.1 底物拓展
图11为该反应的底物拓展。芳胺烯酯1中Ar1依次为邻氟苯基和间甲氧苯基,分别以76%和65%的分离产率得到3a和3b。环醚2中Ar2由对溴苯基调整为对甲苯基时,产率由67%升至73%。
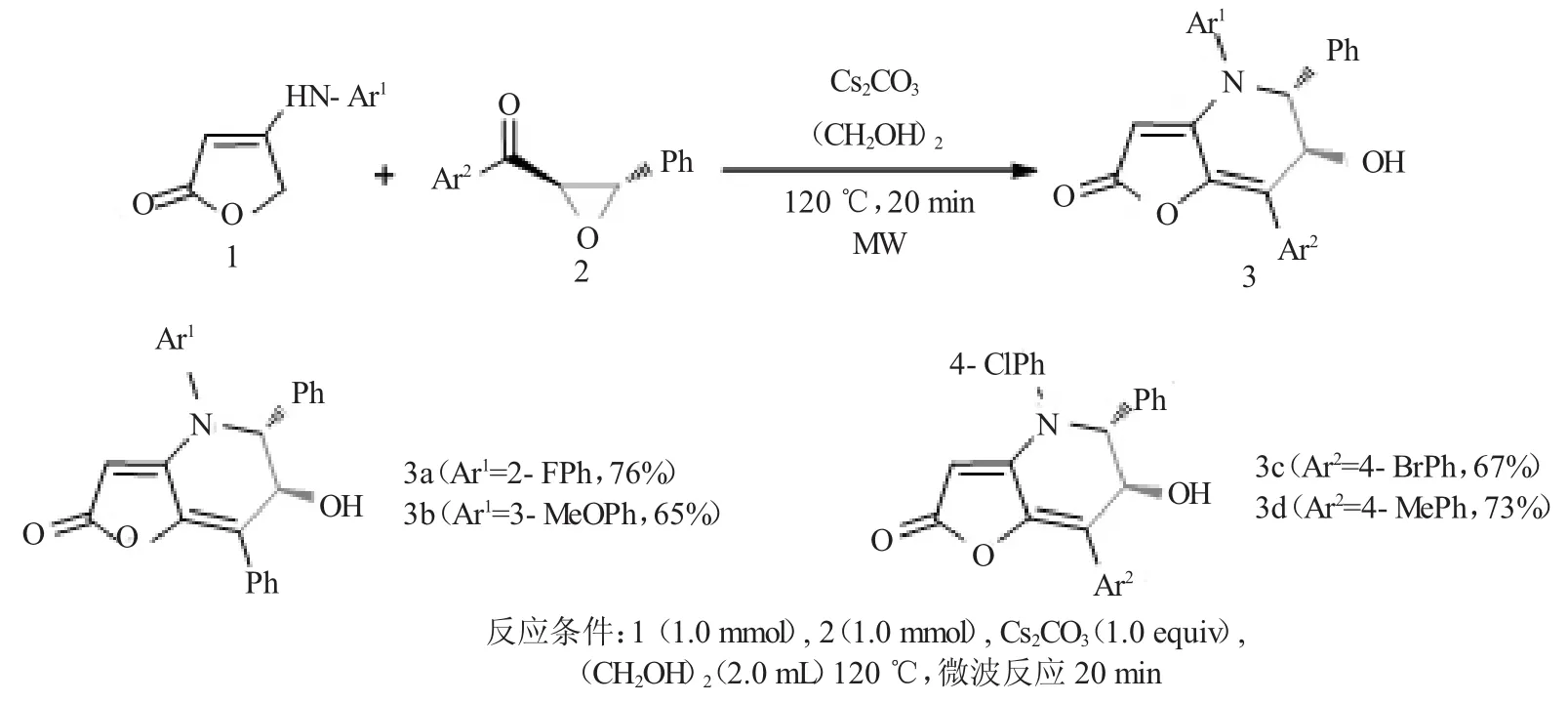
图11 底物拓展
2.2 反应机理
如图12所示,此反应可能经历了去质子(1到1')、亲核取代(1'与2到A)、氢转移(A到B)、分子内Knoevenagel缩合(B到3)等过程,最终得到了产物3。
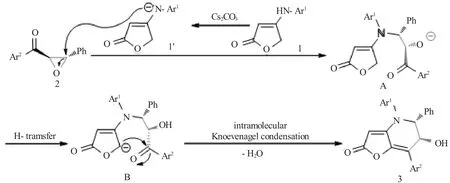
图12 反应机理
3 结论
芳胺烯酯和环醚在廉价的碱催化下,通过环醚的开环反应和C-C键、C-N键的构建,合成了呋喃并[3,2-b]吡啶。该反应无需金属,催化剂廉价,溶剂绿色环保,实现了三元环醚向六元吡啶的转变。

