膳食补充n3多不饱和脂肪酸保护大鼠衰老皮肤胶原的作用及机制研究
薛 欢,王佩茹,徐雨婷,韩佳彤,张国龙,王秀丽,*(.安徽医科大学上海皮肤病临床学院,上海 00443;.同济大学医学院光医学研究所,上海市皮肤病医院,上海 00443)
衰老是肿瘤、免疫功能障碍等疾病发生的最大单一风险因素[1]。皮肤老化可分为内源性老化和外源性老化,内源性老化即自然老化,因年龄的增长而发生。外源性老化主要由紫外线照射(ultraviolet radiation,UVR)引起,又称为光老化。自然老化真皮细胞外基质(extracellular matrix,ECM)中多种胶原的减少和基质金属蛋白酶(matrix metalloproteinases,MMPs)增加,造成皮肤容量减少,临床可表现为皮肤变薄,出现细纹、弹性降低等现象。皮肤自然老化的病理生理改变是老年皮肤生理功能障碍[2]、皮肤免疫状态紊乱及皮肤肿瘤发生的天然因素[3]。
多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)是人体所必需的脂肪酸,其中n-3多不饱和脂肪酸(n-3 PUFAs),在海洋鱼类及某些坚果中含量较为丰富,已被证明在心血管疾病、肿瘤、皮肤保护等方面都有有益作用[4-5]。N-3 PUFAs主要包括α-亚麻酸(α-linolenic acid,ALA)、二十碳五烯酸(eicosapentaenoic acid,EPA)及二十二碳六烯酸(docosahexaenoic acid,DHA)等,在人体内不能合成,必须从食物中供给,属于必需脂肪酸,但现代生活日常饮食中其含量一般较少。其来源主要为海洋生物或海洋鱼类,如鲭鱼、沙丁鱼、鲱鱼。近年研究发现,n-3 PUFAs对包括光敏性疾病、光老化和皮肤肿瘤等在内的皮肤病均有防治作用[6-7]。团队前期研究发现,鱼油作为n-3 PUFAs的膳食补充剂对大鼠表皮屏障及部分胶原基因表达有一定促进作用[8],并可减少急性光损伤的炎症反应[9],但是否对皮肤自然老化有保护作用尚缺乏研究。膳食补充n-3 PUFAs简单易行,可按推荐剂量长期服用,无副作用[10],适合防治包括自然老化等需要长期坚持治疗的慢性疾病或状态。本文通过膳食干预,探索膳食补充n-3 PUFAs对自然老化大鼠皮肤真皮胶原的影响。
1 材料与方法
1.1 材料与仪器
雌性F344大鼠 15只,SPF级,6周龄,购于上海雷根生物科技有限公司;特殊饲料 由美国宾夕法尼亚州的戴茨公司定制,具体配方如表1所示,前期实验中质谱分析显示老化n-3 PUFAs组饲料富含EPA及DHA,总n-3 PUFAs脂肪酸明显较老化对照组多[11];甲醛溶液、无水乙醇(分析纯)、二甲苯(分析纯) 国药集团化学试剂有限公司;异氟烷 深圳瑞沃德生命科技有限公司;Weigert弹力纤维染色试剂盒、Masson三色染色试剂盒 安徽雷根生物技术有限公司;BCA试剂盒 上海雅酶生物科技有限公司;大鼠Ⅰ、Ⅲ型胶原蛋白酶联免疫吸附试剂盒(Krishgen Biosystems)、苏木素染液、伊红染液、中性树胶 上海威奥生物科技有限公司;总RNA提取试剂盒 天根生化科技有限公司;逆转录试剂盒(Hifair® Ⅱ 1st Strand cDNA Synthesis SuperMix for qPCR(gDNA digester plus))、QpcR试剂盒(Hieff® qPCR SYBR Green Master Mix(No Rox)) 上海翊圣生物科技有限公司。

表1 老化对照组及老化n-3 PUFAs组的饲料成分Table 1 Feed composition of aging control group and aging n-3 PUFAs group
RM2235石蜡切片机 德国徕卡微系统有限公司;数显恒温鼓风干燥箱 中国上海精宏有限公司;4 ℃/-20 ℃冰箱 青岛海尔生物医疗股份有限公司;高压消毒锅 上海申安医疗器械厂;超低温冰箱、冷冻离心机 德国Eppendorf;移液枪 赛默飞世尔科技(中国)有限公司;医用离心机 湖南恒诺仪器设备有限公司;光学显微镜 奥林巴斯(中国)有限公司;高通量组织研磨仪 背景鼎昊源科技有限公司;酶标仪 美国Bio-Rad;PCR仪 美国ABI;荧光定量PCR仪 美国罗氏。
1.2 实验方法
1.2.1 实验动物及处理 将大鼠随机分为3组,分别为年轻组、老化n-3 PUFAs组和老化对照组。年轻组大鼠在9月龄时留取皮肤组织。老化n-3 PUFAs组和老化对照组大鼠在14月龄时开始接受特殊饮食共8个月,并在22月龄时留取皮肤组织。老化n-3 PUFAs组饲料的脂质部分由32%的鱼油及68%的混合脂肪组成,以鱼油作为n-3 PUFAs的来源。老化对照组饲料的脂质部分则全部由混合脂肪组成。混合脂肪模拟正常日常饮食中的脂肪模式。除此之外,饲料中其余成分均与普通饲料相当。
1.2.2 组织取材及标本制备 使用异氟烷(瑞沃德)将大鼠麻醉,并将大鼠背部毛发去除干净。用5 mm环钻钻取大鼠背部皮肤组织2块,其中1块放入4%甲醛溶液中固定,用于制作组织病理切片;另1块组织液氮速冻后放入-80 ℃保存,用于酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)及实时定量聚合酶链式反应(real-time quantitative polymerase chain reaction,RT-qPCR)实验。
1.2.3 组织切片及染色 大鼠皮肤组织在甲醛中固定24 h后,石蜡包埋及切片。进行苏木精-伊红染色(HE染色)、Masson染色及Weigert弹力纤维染色。光镜下观察皮肤病理学改变。每张切片随机选取3个视野,使用Image-Pro Plus 6.0分析系统,计量胶原纤维占真皮层的面积比及表皮厚度。
1.2.4 大鼠皮肤胶原的测定 4 ℃下将大鼠皮肤剪碎,加入PBS进行研磨,12000 r/min离心,留取上清液进行实验。BCA法检测上清液中的总蛋白浓度。ELISA检测上清液中的Ⅰ、Ⅲ型胶原蛋白含量,并用总蛋白浓度进行校正。
1.2.5 RT-qPCR分析 液氮研磨法将大鼠皮肤组织研磨成粉末状后,使用RNA提取试剂盒提取组织RNA,逆转录试剂盒将抽提的RNA逆转录为cDNA,qPCR试剂盒进行扩增,实时荧光定量PCR仪检测检测Ⅰ、Ⅲ、Ⅳ、Ⅴ型胶原及MMP1、MMP9、MMP10、MMP13的mRNA表达量并记录数据。使用SYBR Green Ⅱ作为荧光染料,实验参数设置:95 ℃预热仪器10 min;变性:95 ℃持续10 s;退火加延伸:60 ℃持续30 s;总循环40次。结果根据标准曲线由计算后得出。本实验重复3次以确保可靠性。内参基因及所检测基因所需的引物如表2所示。
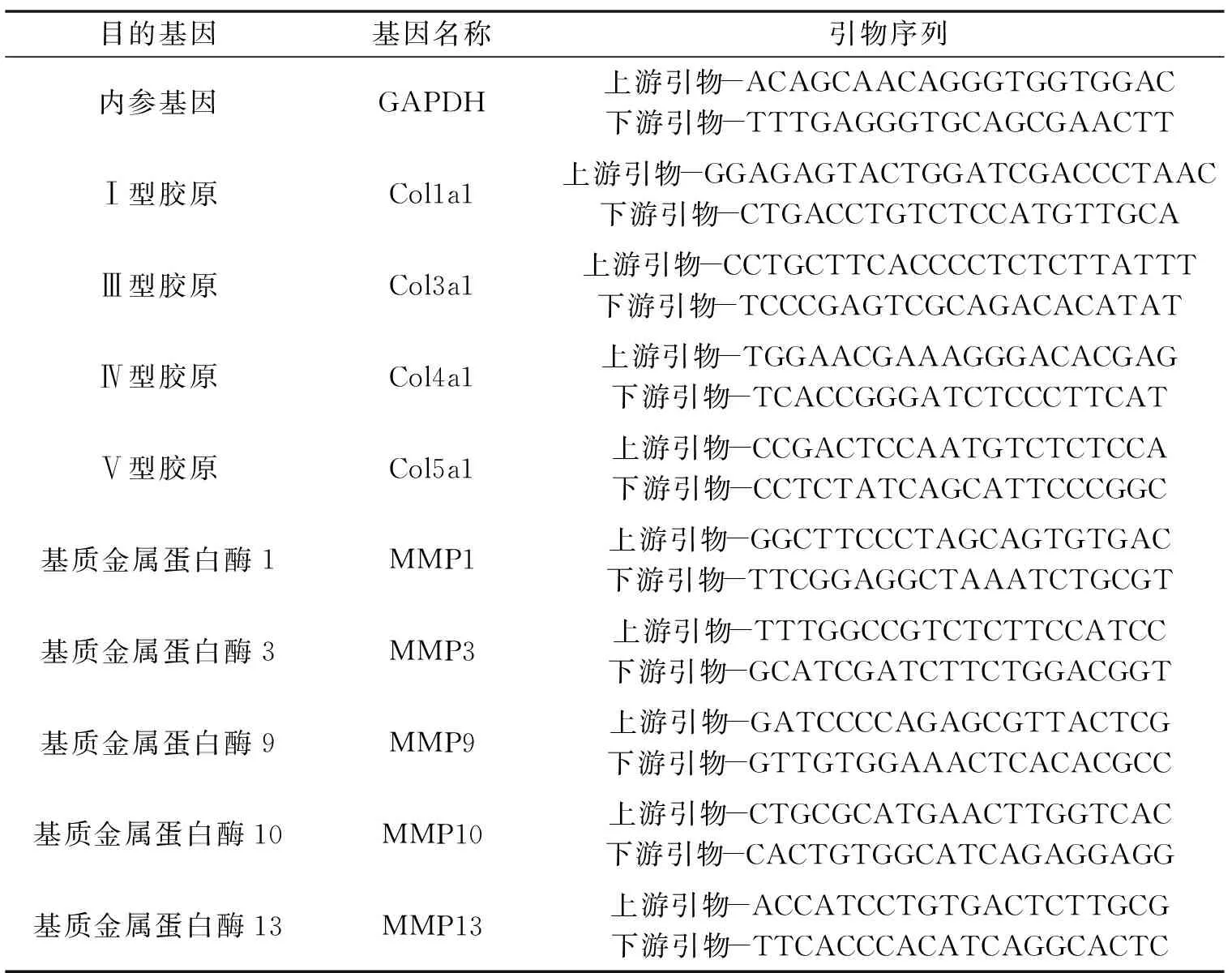
表2 RT-qPCR所需引物Table 2 Primers for RT-qPCR
1.3 数据处理
2 结果与分析
2.1 膳食补充n-3 PUFAs对老化大鼠表皮及真皮结构的影响
采用HE染色观察皮肤结构,Masson染色观察真皮胶原纤维,weigert染色观察弹力纤维。根据大鼠年龄分期,9月龄大鼠尚处于成年早期,22月龄大鼠已进入老年期。如图1所示,HE染色显示年轻组皮肤组织结构完整,表皮呈波浪状,真皮胶原排列整齐;老化大鼠表皮变平变薄,真皮胶原纤维排列紊乱。老化n-3 PUFAs组比老化对照组的真皮胶原排列更为整齐。Masson染色显示年轻大鼠真皮中的胶原纤维紧密排列,老化大鼠的胶原纤维减少,可见变性断裂且分布不均。老化n-3 PUFAs组比老化对照组老化大鼠胶原纤维的排列相对整齐,断裂减轻。Weigert染色中,弹力纤维表现为细长型线状纤维,分散在胶原纤维中。大鼠皮肤中的弹力纤维含量较少(如图中箭头所示),在3组中未观察到明显的数量及形态差别。
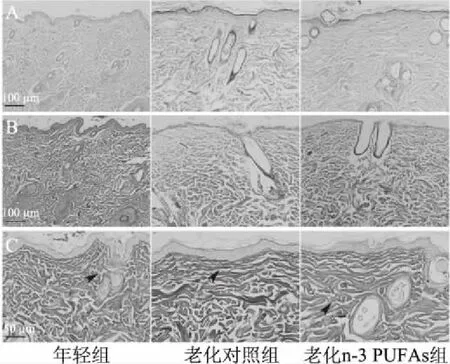
图1 各组大鼠皮肤组织结构变化Fig.1 Changes in skin tissue structure of each group rats注:A:HE染色(200×);B:Masson染色(200×);C:Weigert染色结果(400×)。
使用Image-Pro Plus 6.0图像分析系统对胶原纤维面积占真皮层面积的比值及表皮厚度进行测定,如表3所示,发现老化大鼠胶原纤维含量较年轻大鼠高度显著减少(P<0.001),老化n-3 PUFAs组胶原纤维减少程度较老化对照组显著改善(P<0.01)。老化大鼠表皮厚度较年轻组显著减少(P<0.05),老化n-3 PUFAs组和老化对照组的表皮厚度无显著差异(P>0.05)。

表3 各组大鼠表皮厚度及胶原纤维占比统计结果Table 3 Statistics of epidermal thickness and collagen proportion in each group
2.2 膳食补充n-3 PUFAs对老化皮肤Ⅰ、Ⅲ型胶原蛋白含量的影响
老化大鼠的Ⅰ、Ⅲ型胶原蛋白表达量均较年轻大鼠少,差异具有统计学意义(P<0.05)。老化n-3 PUFAs组大鼠的Ⅰ、Ⅲ型胶原蛋白表达均较老化对照组多,差异具有有统计学意义(P<0.05),见图2。

图2 ELISA检测各组大鼠皮肤Ⅰ型和Ⅲ型胶原表达Fig.2 The expression of type Ⅰ and type Ⅲ collagen of rats in each group注:Y:年轻组大鼠;C:老化对照组;F:老化n-3 PUFAs组;*表示差异显著P<0.05,**表示差异极显著P<0.01,***表示差异高度显著P<0.001,ns表示无统计学意义;图3~图4同。
2.3 膳食补充n-3 PUFAs对老化皮肤Ⅰ、Ⅲ、Ⅳ、Ⅴ型胶原基因表达的影响
老化大鼠的Ⅰ、Ⅲ、Ⅳ、Ⅴ型胶原mRNA相对表达量均较年轻大鼠少,差异具有统计学意义(P<0.05)。老化n-3 PUFAs组大鼠的Ⅰ、Ⅲ型胶原mRNA相对表达量均较老化对照组多,差异具有统计学意义(P<0.05),见图3。
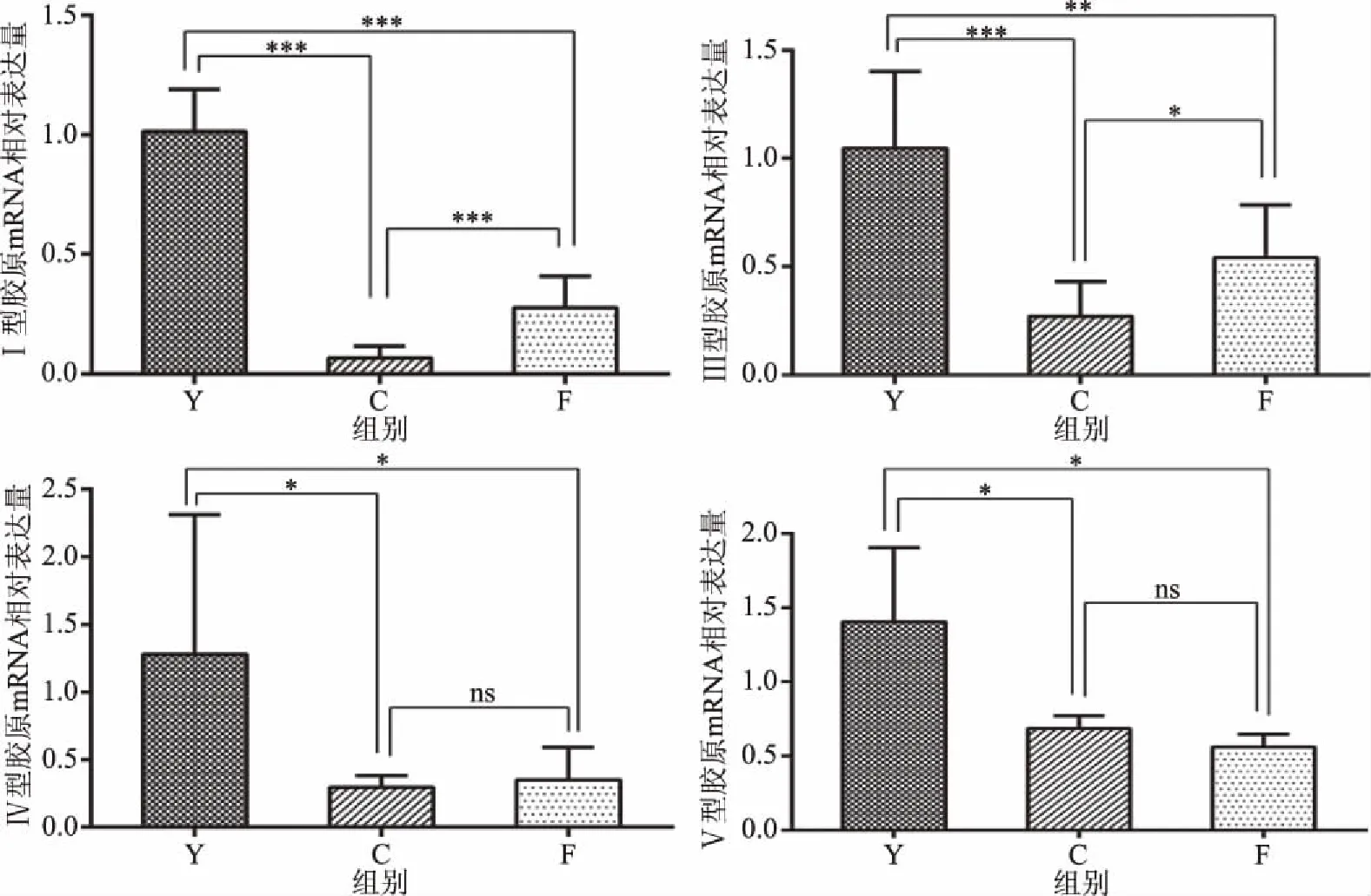
图3 各组大鼠皮肤Ⅰ、Ⅲ、Ⅳ、Ⅴ型胶原mRNA相对表达水平Fig.3 Relative mRNA expression levels of collagen Ⅰ,Ⅲ,Ⅳ and Ⅴ in each group
2.4 膳食补充n-3 PUFAs对老化皮肤基质金属蛋白酶的影响
老化对照组大鼠的MMP1、MMP9、MMP10、MMP13的mRNA相对表达量均较年轻大鼠多,差异具有统计学意义(P<0.05)。老化n-3 PUFAs组大鼠皮肤的MMP10、MMP13的mRNA相对表达量较老化对照组减少,差异有统计学意义(P<0.05),见图4。
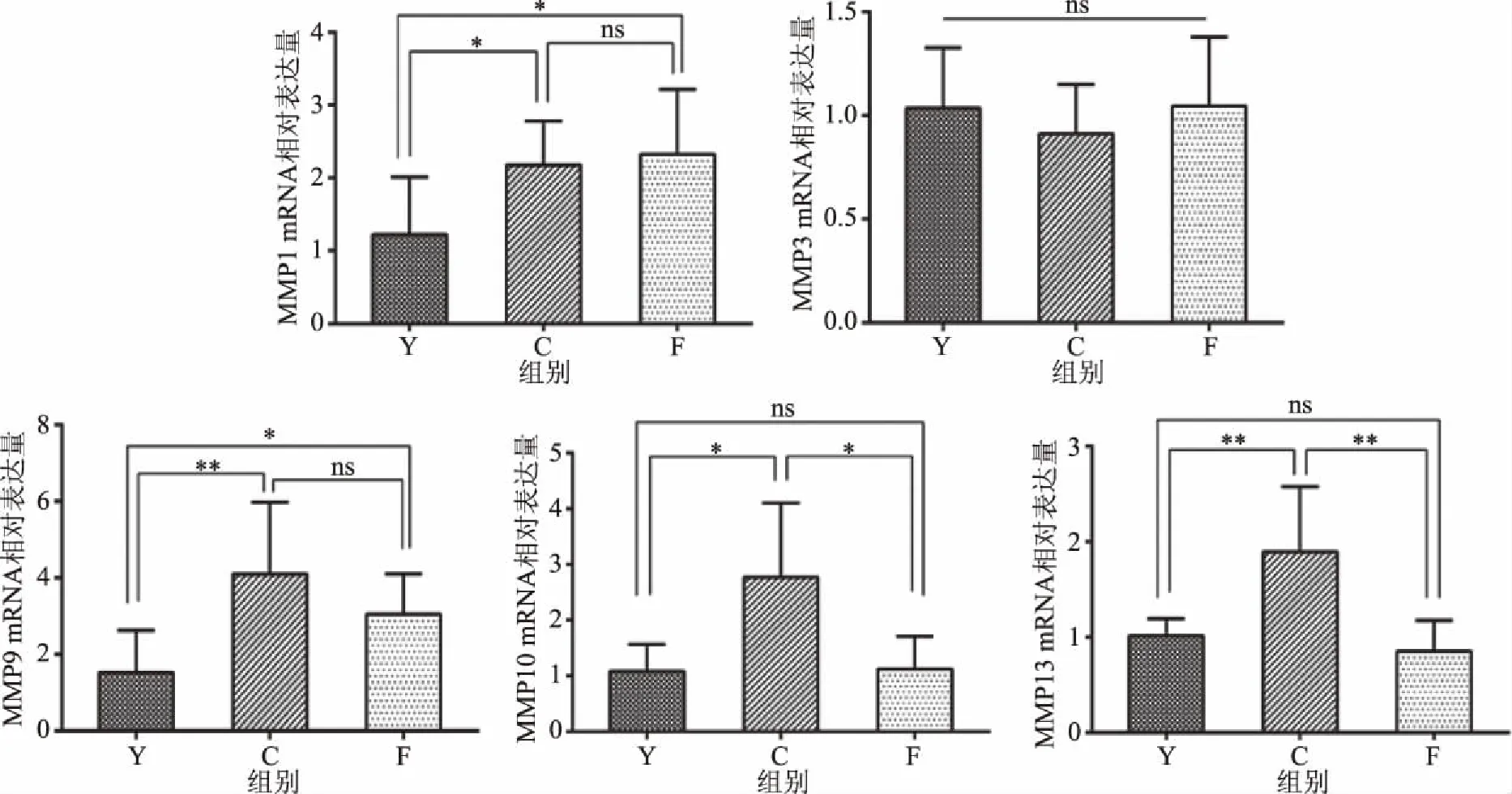
图4 各组大鼠皮肤MMPs mRNA相对表达水平Fig.4 Relative mRNA expression levels of MMPs in each group
3 讨论与结论
随着老龄化人口的比例不断增加,越来越多的老年人饱受年龄相关皮肤病的困扰。老化皮肤易受干燥瘙痒、皮肤感染、皮肤损伤愈合延迟、老年性自身免疫性病及皮肤恶性肿瘤的困扰[12]。氧化损伤在衰老中起着核心作用。细胞对氧化应激的反应由丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)介导。老化皮肤MAPK信号转导通路激活增加。激活的MAPK通路可介导组织炎症反应及激活蛋白-1(activator protein-1,AP-1)转录因子的合成,从而抑制胶原的合成,并通过上调MMPs基因转录水平[13-14]促进胶原降解。n-3 PUFAs具有抑制炎症和氧化反应的作用,目前研究认为其抑制机制为下调MAPK通路活性[15]。基于以上机制基础,本实验就n-3 PUFAs是否可以保护衰老皮肤中的胶原做以研究。
自然老化皮肤全层都会发生退行性变化,真皮层的变化最明显[16]。真皮ECM由胶原、蛋白多糖、黏多糖等构成。胶原是真皮最主要的成分,老化皮肤胶原进行性丢失和破坏,不仅会损害皮肤结构,导致皮肤结构和外观的改变,且会引起皮肤功能障碍及老年性皮肤疾病,例如伤口愈合延迟和皮肤肿瘤的发生发展[17]。真皮胶原纤维中,Ⅰ型胶原占胶原总量的80%~90%,Ⅲ型胶原占8%~12%,Ⅴ型胶原常和I型和III型胶原形成混合纤维。Ⅳ型胶原分布在皮肤基底膜。蛋白多糖和黏多糖围绕并嵌入真皮中的纤维和基质中,负责调节真皮含水量,影响皮肤弹性和屏障功能。皮肤老化过程中,胶原合成减少和降解增多都会使得胶原稳态破坏,真皮胶原缺乏[18-19]。大鼠的皮肤真皮层较小鼠厚,更适合研究真皮胶原改变,故本研究采用大鼠皮肤自然老化模型进行实验。
本研究发现,自然老化大鼠表皮变薄,真皮胶原含量减少。膳食补充n-3 PUFAs可改善老化真皮中Ⅰ、Ⅲ胶原的含量。通过qPCR对Ⅰ、Ⅲ、Ⅳ、Ⅴ型胶原基因的表达进行相对定量分析,结果与病理组织学及蛋白结果表现相符,各型胶原mRNA表达量均随老化的发生而减少,并且老化n-3 PUFAs组Ⅰ型及Ⅲ型胶原mRNA表达量明显比老化对照组多。Ⅰ型胶原主要维持皮肤韧性,Ⅲ型胶原主要维持皮肤弹性。Ⅰ、Ⅲ型胶原蛋白含量丰富,是老化过程中真皮改变最明显的两种成分,尤其是Ⅰ型胶原,与衰老显著相关[20]。胶原蛋白水平和mRNA水平的改变表明膳食补充n-3 PUFAs可促进皮肤中的Ⅰ、Ⅲ型胶原合成,延缓老化过程。Ⅳ、Ⅴ型胶原在皮肤中含量微少,老化皮肤中其减少可能与真皮-表皮交界处及真皮胶原纤维结构变化相关[21-22]。本研究中Ⅳ、Ⅴ型胶原mRNA在老化n-3 PUFA组和老化对照组中未检测到差别,亦可能与其含量少,超过检测敏感度有关。如前所述,老化皮肤组织氧化应激状态激活的MAPK通路可触发下游AP-1转录因子活性增加,进而抑制真皮胶原的合成[23],n-3 PUFAs又可抑制MAPK通路活化,故推测n-3 PUFAs补充促进Ⅰ、Ⅲ型胶原合成可能通过抑制老化皮肤的MAPK通路发挥作用。
胶原降解主要由MMPs调节[24]。MMPs升高致使ECM受损,受损的ECM形成的微环境不利于成纤维细胞的功能,并促使成纤维细胞产生更多的MMPs,从而形成不良循环[25]。老化皮肤中增加的MMPs亦能影响到血管重建作用中的病理性破坏[26],在肿瘤入侵周围组织及转移中也发挥了重要作用。故降低MMPs不仅具有积极的抗老化意义,也可对老化所致皮肤病有潜在益处。MMPs分为五类,分别为胶原酶、明胶酶、基质酶、基质溶解素、膜型基质金属蛋白酶。皮肤中MMPs的主要来源是表皮角质形成细胞和真皮成纤维细胞。有研究发现在老年人皮肤中,MMP1、MMP2、MMP3、MMP9、MMP10、MMP11、MMP13、MMP17、MMP26和MMP27的水平升高[24,27-28],即真皮损伤的主要介质并非是单一的MMP,而是多种MMPs的联合作用。众多酶中,只有胶原酶可以降解天然Ⅰ型胶原中的三螺旋结构[29]。MMP1、MMP13属于胶原酶,它们有相似的结构和功能。目前认为MMP1是分解胶原作用最强的酶,在自然老化、光老化及多种肿瘤组织中都会升高。MMP13降解Ⅰ、Ⅲ型胶原的效果较MMP1弱[30]。MMP3、MMP10属于间质酶,只能降解被胶原酶分解的胶原以及其他ECM蛋白。间质酶另一重要功能是激活各种Pro-MMPs[31]。MMP9属于明胶酶,主要降解被MMP1分解的Ⅰ型胶原及Ⅳ型胶原。
本研究发现,老化大鼠的MMP1、MMP9、MMP10、MMP13的mRNA表达均增高,符合自然老化的规律。老化n-3 PUFAs组和老化对照组的MMP10及MMP13的mRNA表达量存在显著差异(P<0.05),而MMP1、MMP3、MMP9(P>0.05)并无差异。与此不同的是,本课题组既往曾就膳食补充n-3 PUFAs延缓光老化进行过探究,结果显示其可通过抑制小鼠皮肤中MMP1含量而发挥保护作用。推测这种差别源于自然老化和光老化的产生机制不同。光老化过程中的氧化应激事件主要是UVR引起的皮肤组织中活性氧(reactive oxygen species,ROS)增多。自然老化过程中的氧化应激事件则主要是机体氧化代谢产生的ROS[32]。尽管自然老化和光老化皮肤中的ROS都可激活MAPK信号转导通路,诱导MMPs表达,从而导致胶原降解异常,但两者的启动事件并不相同,UVR的胶原降解效应较自然老化显著增加。ROS导致的炎症反应也是老化发生机制中重要的一环。自然老化皮肤中的ROS水平及炎症反应都较光老化弱,这可能是n-3 PUFAs并未影响到MMP1水平的原因。根据本实验结果,膳食补充n-3 PUFAs或通过减少MMP10、MMP13延缓Ⅰ、Ⅲ型胶原及其他ECM蛋白降解保护皮肤。
以上结果表明,膳食补充n-3 PUFAs可促进老化大鼠真皮Ⅰ、Ⅲ胶原生成,减少MMP10、MMP13的表达延缓老化皮肤真皮ECM降解,一定程度延缓皮肤自然老化进程。然而,膳食补充n-3 PUFAs促进真皮胶原合成的具体机制仍需深入研究。在人体中是否可以延缓衰老,减轻衰老相关皮肤疾病亦有待探索。

