吡啶硫酸氢盐离子液体催化甘油与乙酸酯化反应动力学
徐浩,李洋,夏成康,何瑞宁,邹昀,童张法
(广西石化资源加工及过程强化技术重点实验室,广西大学化学化工学院,广西南宁530004)
引 言
三乙酸甘油酯(C9H14O6,简称TAG),作为一种重要的精细化工中间体,在香水、涂料、医药、香烟等行业有着广泛的应用[1]。工业上酯类化合物通常采用催化反应精馏技术[2]直接酯化法生产,同时再结合渗透汽化膜分离技术[3-5]进一步纯化,获得较高浓度的成品。TAG 传统生产工艺也是以浓硫酸为催化剂,通过甘油与乙酸发生酯化反应,再经过分离纯化后得到产品。但是浓硫酸催化剂存在转化率低、选择性差、副产品多、腐蚀设备、污染环境等缺点[6-8],因此亟需开发新型催化剂以解决传统催化剂带来的诸多问题。
此外,用于酯化反应的催化剂还有以下几类:分子筛催化剂、杂多酸催化剂、固体酸催化剂、树脂催化剂、有机酸和无机盐催化剂、离子液体催化剂等。分子筛催化剂比表面积大、结构稳定、可高温使用,但存在容易积炭失活的问题[9];杂多酸催化剂具有强酸性、来源丰富、后处理方便等优点,但其在酸度均匀化、负载牢固化方面的研究有待深入[10-11];固体酸催化剂选择性好、催化活性高,但存在活性下降快、成本较高的缺陷[12-13];树脂催化剂具有催化活性高、易与产物分离的优点,但由于热稳定性较差,其应用受到局限[14-16];有机酸和无机盐催化剂避免了液体酸催化剂的强腐蚀性和污染问题,但催化剂不易回收重复使用[17-18];其中离子液体作为一种绿色环保的新型催化剂,具有不易挥发、催化反应活性高、不易失活、可重复利用、化学稳定性和热稳定性好等突出优点,获得众多研究者广泛关注[19-21]。如董颜箔等[22]使用1-丁基-3-甲基咪唑硫酸氢盐离子液体([BMIM]HSO4)作为乙酸与乙醇酯化反应的催化剂,用于反应精馏合成乙酸乙酯,催化剂具有较高的选择性,产品纯度高;贾鹏飞等[23]制备了酸性聚离子液体[N4H4(CH2)6]·4HSO4,将其作为催化剂用于氯乙酸乙酯合成研究,催化剂具有较好的重复使用效果;Sun 等[24]筛选出1-磺酸丁基-3-甲基咪唑对甲苯磺酸盐离子液体([BSO3HMIM]TS)用于催化合成咖啡酸甘油酯,显示出较高的催化活性。
建立反应动力学模型有助于揭示反应机理,也是实现催化剂工业化应用的关键步骤[25]。甘油酯化反应动力学机理一般分以下两类:一级反应动力学模型,二级可逆反应动力学模型。贾玉岩等[26]以固体酸Amberlyst-15 作催化剂研究甘油-乙酸酯化反应动力学,建立了一级反应动力学模型,并且通过实验得到很好的验证。Li 等[27]以NKC-9 阳离子交换树脂作为催化剂,采用反应精馏技术制备TAG,建立二级可逆反应动力学模型成功模拟和预测了甘油酯化反应过程。然而,由于甘油-乙酸酯化反应体系较为复杂,大多数研究忽略逆反应,采用拟均相一级反应模型进行动力学计算。此外,目前针对离子液体催化剂用于合成TAG 的反应动力学研究也鲜有报道。
本文以吡啶硫酸氢盐离子液体作为甘油和乙酸酯化反应的催化剂,用单因素实验方法探究了反应温度、酸醇摩尔比、催化剂用量等因素对甘油转化率及产物收率的影响。采用拟均相一级反应模型建立动力学微分方程组,利用四五阶龙格-库塔法求解动力学方程获得反应速率常数;通过Arrhenius 方程关联反应速率常数与指前因子和反应活化能,线性拟合求得速率常数关于温度的关系式;根据此动力学方程求出不同温度下各组分浓度随时间变化的拟合曲线,通过比较实验点在拟合曲线的分布情况以判断动力学方程的准确性。最后通过与Amberlyst-15、杂多酸等传统催化剂性能对比,评价吡啶硫酸氢盐离子液体在甘油和乙酸酯化反应中的催化效果。
1 实验部分
1.1 实验试剂
乙酸,分析纯,成都市科隆化学品有限公司;甘油,分析纯,广东光华科技股份有限公司;吡啶硫酸氢盐,分析纯,上海成捷化学有限公司;三乙酸甘油酯,分析纯,上海麦克林生化科技有限公司。
1.2 反应动力学实验
实验反应装置如图1 所示,采用500 ml 三口烧瓶作为反应器,同时各支管口处分别装有冷凝器、温度计和取样器。采用具有磁子搅拌功能的恒温油浴装置控制反应器温度,精度为±1℃。参考He等[28]的操作方法,先将一定量的乙酸与吡啶硫酸氢盐置于三口烧瓶中。一定量的丙三醇置于烧杯中,放置于恒温油浴锅中,开启加热开关进行预热。当预热到设定的温度后,将丙三醇倒入三口烧瓶中,启动磁力搅拌,搅拌速率1100 r/min,使反应物料充分混合,并开始计时。每隔一定时间从反应器中进行取样1 ml 以内,以保持恒容反应,将取出样品及时冰浴冷却防止反应继续发生。同时保证取出的样品总量不大于总反应液的5%,以消除内外扩散及取样对反应的影响。通过调整反应温度、酸醇摩尔比及催化剂用量等条件,考察不同因素对实验结果的影响。
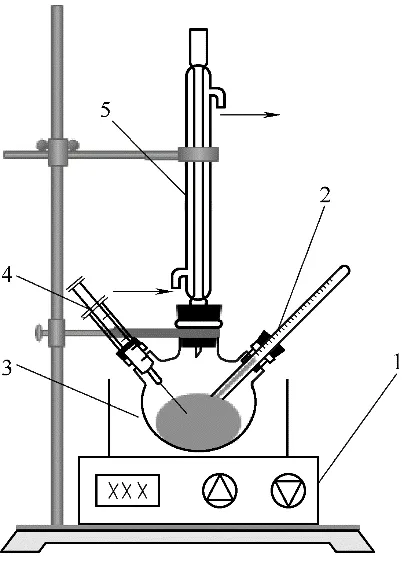
图1 酯化反应实验装置图Fig.1 Apparatus of the esterification reaction experiments
1.3 组成分析方法
采用Agilent GC7820A 型气相色谱仪对样品组成进行定量分析。其中气相色谱仪分析条件为:热导检测器(TCD);HP-INNOWAX 毛细管色谱柱(30 m×320 μm×0.5 μm);进样量0.2 μl;进样器温度310℃;检测器温度280℃;柱温:初始柱温80℃,恒温3 min,50℃/min 速率升至280℃,恒温4 min,以20℃/min 速率升至300℃,恒温4 min;载气为氮气,载气流速2 ml/min。
测定时,选用二甲基亚砜作为内标物,采用内标法进行校正分析[29]。首先量取1 ml的待测样品和1 ml 的二甲基亚砜配制进样试剂;再分别量取1 ml分析纯的三乙酸甘油酯和1 ml 的二甲基亚砜内标物,混合配制成内标溶液。然后利用气相色谱仪分别测出内标溶液和进样试剂的峰面积,计算出校正因子及样品中各物质的质量,再根据相对分子质量分别计算出各物质的物质的量以及摩尔浓度,最后根据式(1)、式(2)分别求出甘油转化率及3 种甘油酯的收率。
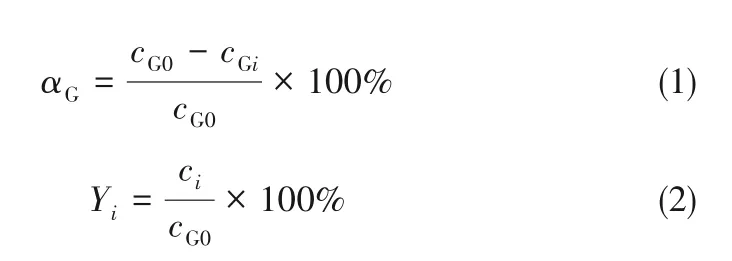
式中,αG、Yi分别代表甘油转化率及产物收率,cG0、cGi分别代表甘油的起始摩尔浓度和平衡摩尔浓度,ci分别代表各产物的平衡摩尔浓度。
2 反应动力学模型的建立及求解
甘油与乙酸酯化反应是一组串联可逆反应[30-31],其反应机理为:首先酸性离子液体提供质子与乙酸的羰基结合形成碳正离子,其次甘油与碳正离子发生亲核取代反应形成中间体,最后中间体脱水生成甘油酯。具体反应过程为:首先乙酸与甘油反应生成单乙酸甘油酯(MAG)和水;接着MAG 与乙酸进一步酯化反应,生成二乙酸甘油酯(DAG)和水;最后DAG 与乙酸反应生成三乙酸甘油酯(TAG)和水。
LHHW 动力学模型[32]表达式中分子、分母分别为动力项和阻力项,动力主要来源于浓度效应和温度效应,阻力主要来源于吸附阻力和传质阻力,其基本原理为:反应体系在催化剂表面吸附、反应和脱附,由于酯化反应为表面控制反应[33],故本文采用此模型来分析甘油与乙酸酯化反应动力学。由于反应体系中各组分与催化剂均属于液相,不存在酸位吸附,则可忽略该模型中阻力项;本文采用乙酸量大于甘油量(nG∶nAA≥3),正反应速率远大于逆反应速率,故忽略反应中的逆反应,最终该酯化反应动力学模型可以简化为拟均相一级连续反应模型,如式(3)所示:

式中,G 代表甘油,MAG 代表单乙酸甘油酯,DAG 代表二乙酸甘油酯,TAG 代表三乙酸甘油酯,k1、k2、k3分别表示各步反应相应的反应速率常数。各组分的反应速率方程如式(4)~式(7)所示:
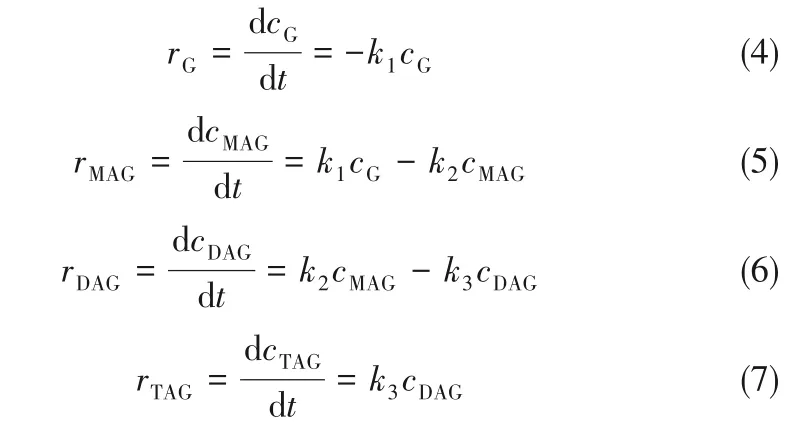
式中,r 为反应速率,mol·L-1·min-1;k1、k2、k3分别为第一、二、三步反应的反应速率常数,min-1;ci为各组分浓度,mol·L-1,各组分浓度符合式(8)的关系。
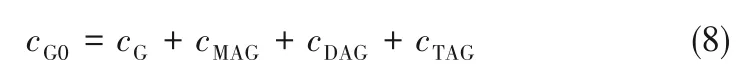
动力学模型方程式(4)~式(7)均属于常微分方程,采用四五阶龙格-库塔法[34]求解微分方程,计算过程主要包括3步:变量设定、参数估计及模型方程求解,首先以各取样时间下样品中各组分浓度的实验值为自变量,以反应速率常数为因变量,然后以各组分浓度的实验值与计算值的残差平方和(RSS)最小为目标函数,利用非线性最小二乘法进行参数估计求取反应速率常数的初值;最后采用四五阶龙格-库塔法循环迭代计算求解模型方程获得反应速率常数及其置信区间。目标函数见式(9),其中N 为数据点数量,ccal和cexp分别为各组分浓度的计算值以及实验值。
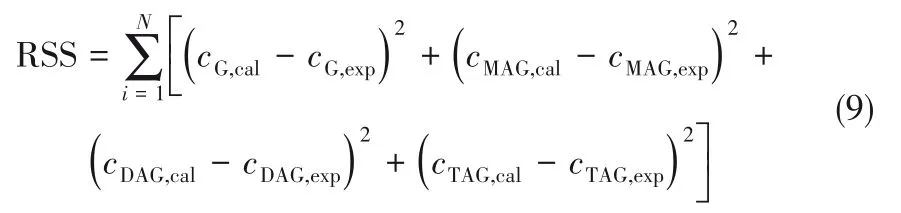
利用上述计算方法获取不同实验条件下的反应速率常数ki,根据指前因子ki0和反应活化能Ea,i之间的Arrhenius 关系式(10),线性化处理后得式(11),以1/T为x轴、lnki为y轴作图,线性拟合得到线性方程的斜率为-Ea,i/R、截距为lnki0,从而获得指前因子及反应活化能数值。
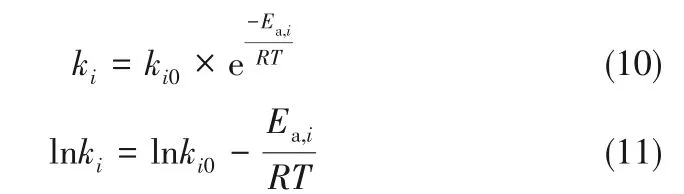
式中,ki、ki0、R、T、Ea分别是化学反应速率常数、指前因子、摩尔气体常数、反应温度及反应活化能,其中,i=1,2,3。
3 结果与讨论
3.1 反应温度的影响
图2 是反应温度分别为65、80、95、110℃时,在乙酸/甘油初始摩尔比为3∶1、催化剂用量为甘油质量的1%(质量分数)、搅拌转速为1100 r·min-1的条件下,甘油转化率及产物收率随时间变化的结果。随反应温度升高,反应速率加快,反应达到平衡所需时间缩短;同时,甘油的平衡转化率随着反应温度的升高而增大。主要由于提高反应温度,分子间运动更剧烈,有利于增加反应物分子之间的有效碰撞,从而提高了甘油的平衡转化率;另外,由于甘油、吡啶硫酸氢盐离子液体及甘油酯均为油状液体,升高反应温度,可降低反应体系黏度[35],导致相间传质速率和反应速率加快,从而缩短反应达到平衡所需时间。当温度从65℃上升至110℃时,甘油的转化率从78.1%增加至86.5%,三乙酸甘油酯的收率由4.8%增加32.8%,另外由于该反应是放热反应,温度过高会导致反应逆向进行,且会增大实验能耗;而且产物在高温与大气相通的条件下极易发生氧化裂解[36],故本实验选择110℃为最佳反应温度。
3.2 酸醇摩尔比的影响
图3是在反应温度为110℃、催化剂用量为甘油质量的1%(质量分数)、搅拌转速为1100 r·min-1的条件下,乙酸/甘油摩尔比(nAA∶nG)分别为3∶1、6∶1、9∶1 时,不同酸醇摩尔比对甘油转化率及产物收率的影响结果。随着乙酸含量的增加,甘油浓度在短时间迅速下降,约200 min 趋于稳定,单乙酸甘油酯达到收率最高点的时间缩短,三乙酸甘油酯产品收率也随之增大。因为甘油与乙酸酯化反应是可逆反应,增加原料乙酸的量有利于反应正向进行,在短时间内能生成大量单乙酸甘油酯。对比图3(b)和图3(c)可知,当nAA∶nG=6∶1 时,甘油最高转化率达到93.6%,三乙酸甘油酯的最大产率是34.8%;当nAA∶nG=9∶1 时,甘油最高转化率达到94.6%,三乙酸甘油酯的产率为36.2%;综合来看,当酸醇摩尔比为6∶1时,继续增加乙酸用量并没有显著地提高甘油的转化率和三乙酸甘油酯的产率,但会增加原料消耗及后续分离纯化的负荷,因此最佳酸醇摩尔比为6∶1。
3.3 催化剂用量的影响
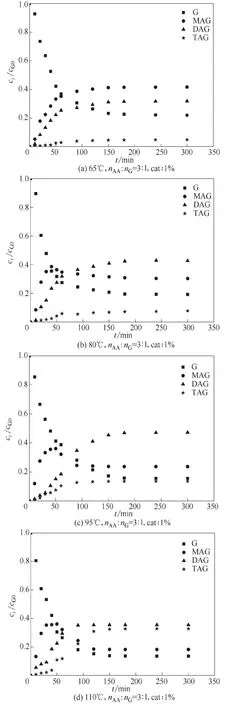
图2 不同反应温度下甘油-乙酸酯化反应体系各组分随时间变化情况Fig.2 Variation of each component of G-AA reaction system with time under different reaction temperature

图3 不同酸醇摩尔比下甘油-乙酸酯化反应体系各组分随时间变化情况Fig.3 Variation of each component of G-AA reaction system with time under different acid-alcohol molar ratio
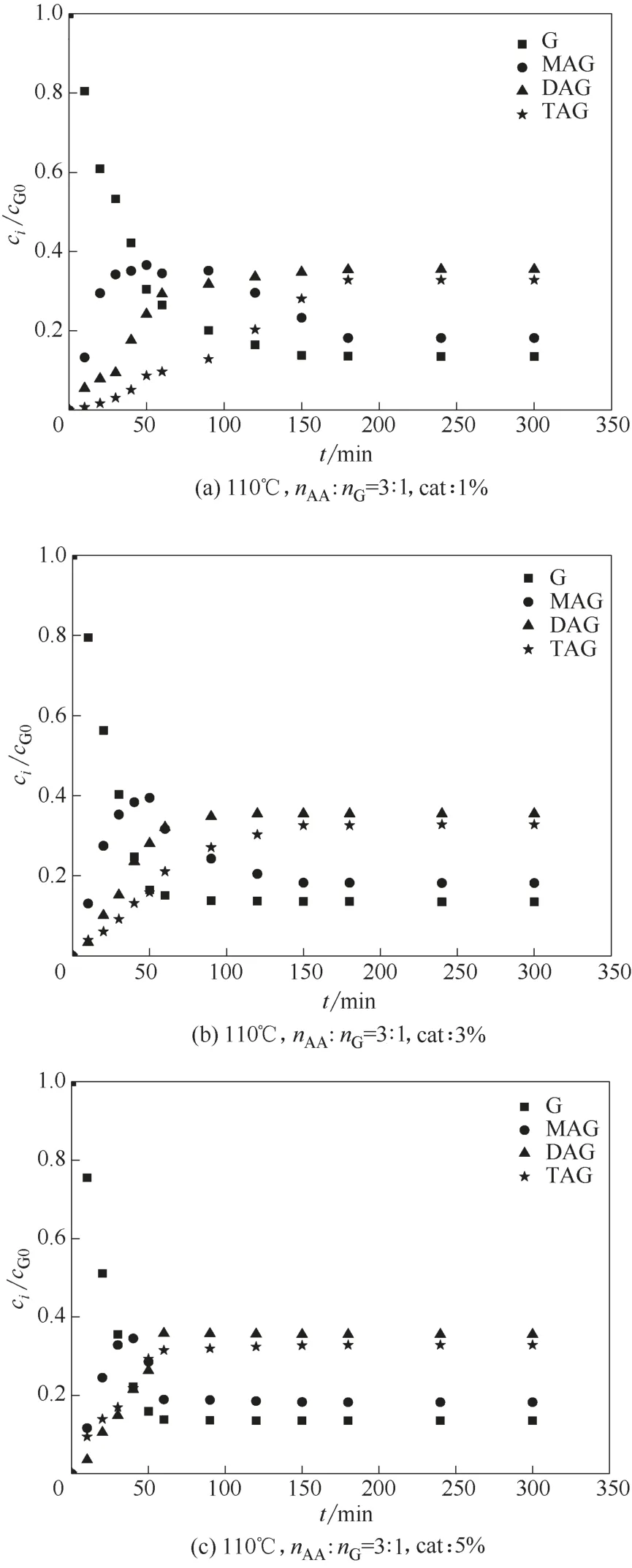
图4 不同催化剂用量下甘油-乙酸酯化反应体系各组分随时间变化情况Fig.4 Variation of each component of G-AA reaction system with time under different catalyst dosage
图4 是反应温度为110℃、酸醇摩尔比(nAA∶nG)为3∶1、磁力搅拌转速为1100 r·min-1,催化剂用量分别为甘油质量的1%、3%、5%(均为质量分数)的条件下,不同催化剂用量对甘油转化率及产物收率的影响结果。当催化剂用量为1%时,酯化反应体系约240 min 才达到平衡,而当催化剂用量为5%时,酯化反应体系约60 min 就达到平衡,增加催化剂用量显著提高反应速率。在前60 min 时,随着催化剂用量的增大,三乙酸甘油酯的收率整体呈增加趋势。比较图4(a)和图4(b),增加催化剂用量能够提高三乙酸甘油酯的产率,由于随着催化剂的用量增多,酸性位点也随之增多,故催化效果也明显变强。对比图4(b)和图4(c),可发现增加离子液体催化剂量对三乙酸甘油酯产率影响变弱,当催化剂用量继续增加时,反应体系中催化活性位点不再增加,所以三乙酸甘油酯生成速率不会继续明显增加;考虑到催化剂用量成本问题,故选择最佳催化剂用量为甘油质量的3%(即ccat=129.04 mmol H+/L)。
通过探究反应温度、酸醇摩尔比以及催化剂用量等条件对甘油酯化反应的影响结果,确定了反应最佳条件为:反应温度为110℃、酸醇摩尔比为6∶1、催化剂用量为甘油质量的3%,其最佳反应条件下甘油酯化产物收率结果见图5。在最佳条件下进行实验,甘油酯化反应达平衡时,甘油的转化率为98.5%,二乙酸甘油酯和三乙酸甘油酯的混合收率高达87.0%,其中DAG 和TAG 的收率分别为46.6%和40.4%,结果表明合适的反应条件有利于三乙酸甘油酯的生成,使得目标反应更彻底。
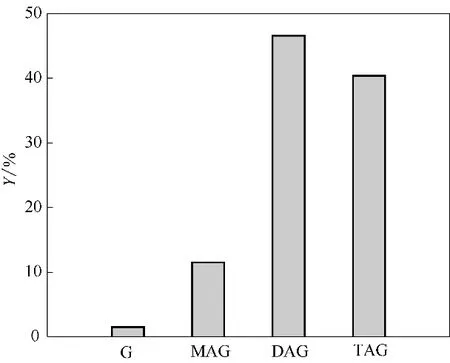
图5 最佳反应条件下甘油酯化产物收率Fig.5 Product yield of G-AA esterification at optimal reaction conditions
3.4 动力学模型参数确定及验证
表1 是计算所得到的不同温度的反应速率常数,随着反应温度的升高,各步反应的反应速率常数ki不断增大,说明提高反应温度有利于促进反应的发生,加快反应产物的生成;另外,同一温度下,各步反应的反应速率常数ki依次减小,表明随着反应进行,后续反应速率越慢。

表1 不同反应温度下的反应速率常数Table 1 Reaction rate constants at different temperatures
图6是反应速率常数与反应温度的线性化处理后的关系图,各点的线性相关性较好,根据直线斜率和截距可以推算出各步反应的反应活化能和指前因子,结果见表2,随着甘油-乙酸酯化反应的不断进行,第一、二、三步的反应活化能依次增大,这是因为随着反应产物中的酯基增多,相应的空间位阻越来越大,反应也越困难[37]。

图6 反应速率常数与反应温度的关系Fig.6 Relationship between reaction rate constant and temperature

表2 甘油与乙酸酯化反应的指前因子和活化能Table 2 Pre-exponential factor and activation energy of G-AA esterification
图7是不同反应温度下反应组成变化的实验数据与模型计算值对比情况,其中点为实验值,曲线为动力学模型计算值。图中计算曲线与实验点基本一致,在温度大于80℃情况下,局部单乙酸甘油酯计算值与实验值产生一定偏差,这与模型简化设定中忽略逆反应有关,总体上该动力学方程能够描述整个反应动力学变化的趋势。
3.5 不同催化剂效果的比较
表3 是本文与文献报道的Amberlyst-15[38]、杂多酸[39]在甘油-乙酸反应中的催化性能比较结果。其中MR、mcat、ccat、mmix分别表示酸醇摩尔比、催化剂质量、催化剂浓度及反应体系的质量,从最佳反应条件、甘油转化率及反应产物的收率及各步反应的反应活化能等几方面综合比较,吡啶硫酸氢盐相对于其他催化剂,反应条件更为温和,选择性更高,反应活化能更小,具有较好的催化效果。
4 结 论
(1)对于甘油与乙酸酯化反应,甘油转化率随反应温度、乙酸/甘油摩尔比升高而增加;随着催化剂用量的增加,甘油的反应速率逐渐增大,但平衡转化率基本不变。甘油与乙酸酯化最佳反应条件为反应温度为110℃,乙酸/甘油摩尔比为6∶1,催化剂用量为甘油的3%。在此条件下反应120 min 后,甘油的转化率达到98.5%,DAG 和TAG 的总收率达到87.0%。
(2)利用拟均相一级连续反应机理建立甘油与乙酸酯化反应动力学模型,并通过不同反应温度下的反应动力学实验数据拟合关联出模型参数,模型计算值与实验值一致性较好。
(3)甘油与乙酸在新型催化剂作用下生成单乙酸甘油酯、二乙酸甘油酯、三乙酸甘油酯的活化能分别为19.10、21.58 和23.25 kJ·mol-1,该催化剂相较于已报道的Amberlyst-15、杂多酸催化剂反应条件更温和、选择性更高、反应活化能更小,具有较好的催化效果。
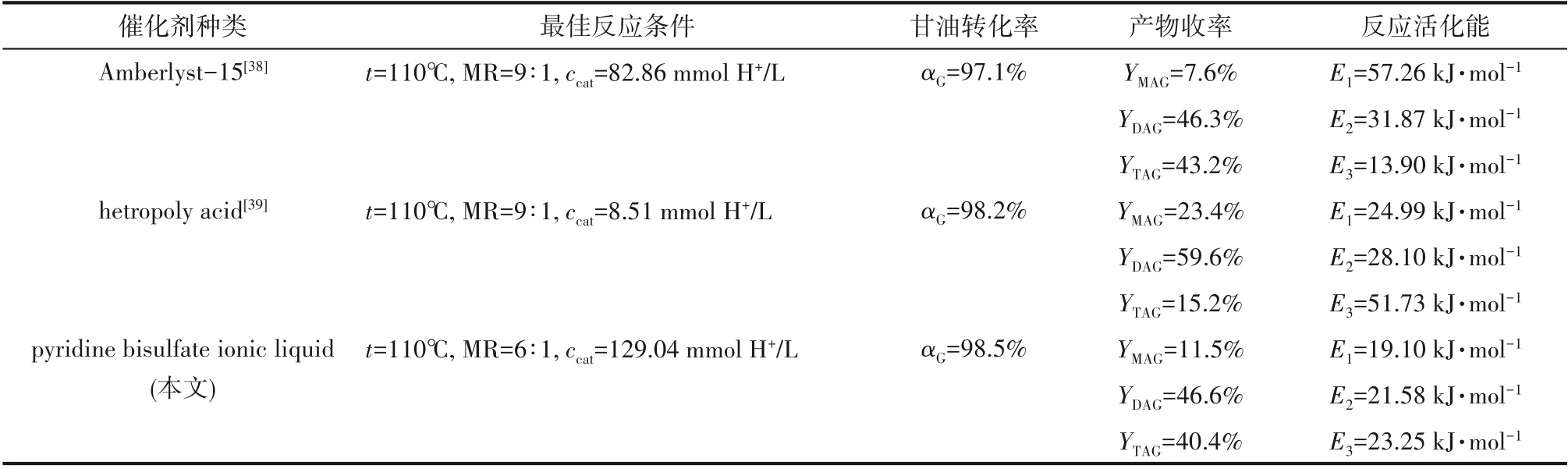
表3 不同催化剂性能的比较Table 3 Performances comparison of different catalysts for G-AA esterification
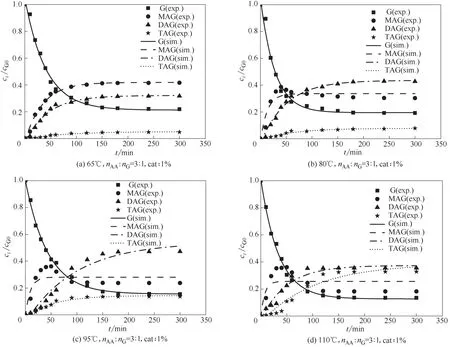
图7 不同反应温度下各组分变化的实验点与计算曲线的比较Fig.7 Comparison between experimental points and calculated curves of changes in components at different reaction temperatures
符 号 说 明
c——物质的量浓度,mol·L-1
Ea——活化能,kJ·mol-1
k——反应速率常数,min-1
k0——指前因子,min-1
m——质量,g
n——物质的量,mol
r——反应速率,mol·L-1·min-1
Y——收率,%
α——转化率,%
下角标
AA——乙酸
cat——催化剂
DAG——二乙酸甘油酯
G——甘油
i——各物质组分
MAG——单乙酸甘油酯
TAG——三乙酸甘油酯
0——反应前

