天麻素治疗缺血性脑卒中导致神经元死亡的作用机制研究
许 鑫,周 欣,楚世峰,李芳芳,郑清炼,何宏媛,陈乃宏,
(1. 华南师范大学脑科学与康复医学研究院,广东 广州 510631;2. 中国医学科学院药物研究所神经科学中心, 天然药物活性物质与功能国家重点实验室, 北京 100050;3. 天津中医药大学,天津 301617)
脑卒中是导致我国居民死亡的首位病因[1],它具有高发病率、高致残率、高死亡率、高复发率、高经济负担的特点[2],溶栓药组织型纤溶酶原激活剂(tPA)是唯一被FDA批准的用于抗急性缺血性脑卒中的药物[3],但由于存在治疗时间窗短,疗效有限,易引发出血转化等风险[4],难以满足需求。
神经元死亡是脑卒中的核心病理环节,包括急性和迟发性神经元死亡,迟发性神经元死亡通常表现为细胞凋亡。有研究发现,相关因子生存素(Survivin)能够抑制线粒体介导的caspase系列引起的细胞凋亡作用,而且Survivin的抗凋亡作用需要乙肝病毒X蛋白结合蛋白(hepatitis B X-interacting protein,HBXIP)的协助,HBXIP/Survivin形成的复合物可以拮抗缺血性脑卒中导致的神经元凋亡,改善缺血性脑卒中病变损伤。
天麻素(gastrodin,Gas)作为天麻的主要活性成分之一,对神经衰弱、失眠、头痛症状都有着缓解的作用,其结构式如Fig 1。现代药理学研究发现,Gas具有多种生物学活性,如杨根梦等[5]研究发现,Gas可减弱神经母细胞瘤细胞(SHSY5Y)自噬,保护神经细胞,SHSY5Y细胞系被广泛运用于帕金森病发病机制的研究,表明Gas对帕金森病具有一定的影响。赵朝华等[6]研究发现,Gas能够明显抑制缺血/再灌注早期S100β的过表达,保护神经胶质细胞正常生长、繁殖和分化;杜亮等[7]研究发现Gas可明显提高钠离子、钾离子和三磷酸腺苷酶的活性,促进大脑细胞能量的代谢,有效清除自由基,减少脑缺血/再灌注造成的损伤;Zhang等[8-9]的研究发现Gas可抑制TNF-α、IL-1β和IL-6等炎症因子的释放,改善血脑屏障,减轻脑缺血后的炎症反应和缺血性脑损伤,这些可看出Gas对缺血性脑卒中的相关治疗具有一定的基础,Gas具有多种药理活性。
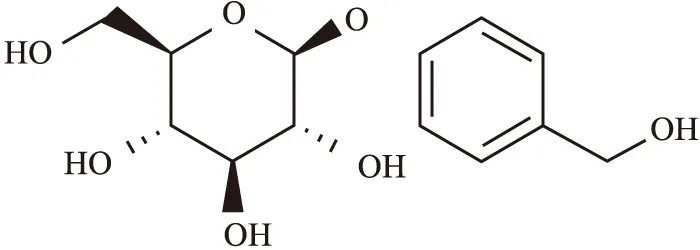
Fig 1 Chemical structure of gastrodin
然而上述研究均聚焦于卒中后24 h内的研究,对于迟发性神经元死亡的影响未见报道。Survivin和HBXIP在Gas的保护作用中的变化尚不清楚。本研究发现,Gas可改善短暂性大脑中动脉阻塞(transient middle cerebral artery occlusion,tMCAO)再灌注引发的大鼠迟发性神经元死亡,其机制与凋亡蛋白caspase-3、caspase-8和抗凋亡蛋白Survivin、HBXIP的表达有关。
1 材料
1.1 实验动物♂SD大鼠,体质量(260~280) g,购自斯贝福(北京)生物科技有限公司(清洁级,合格证编号:SCXK(京)2016-0002),购入后饲养于中国医学科学院药物研究所动物房,室温维持在(26±2) ℃,相对湿度(55±5)%,12 h/12 h光照/避光循环,自由摄食与饮水。
1.2 实验药品与试剂Gas注射液(昆药集团股份有限公司,批号:110807-201809);依达拉奉(Edaravone,Eda)注射液(南京先声东元制药有限公司,批号:80-190103);Anti-β-actin抗体、羊抗鼠二抗(sigma公司);Anti-caspase-3抗体(批号:J2815)、Anti-caspase-8抗体(批号:H0911)、Anti-HBXIP抗体(批号:A2715)(圣克鲁斯生物技术公司);Anti-Survivin抗体(abcam公司,批号:GR3211325-1);Alexa FlureTM488 donkey anti-mouse二抗(批号:A5441)、Alexa FlureTM546 donkey anti-rabbit二抗(批号:AC026)(赛默飞世尔科技公司);PVDF膜(孔径0.22μm,美国Millipore公司)。
1.3 实验仪器小动物呼吸麻醉机(深圳市瑞沃德生命科技有限公司);tMCAO栓线(北京西浓科技有限公司);高速组织研磨仪(康涛科技);激光共聚焦显微镜(Zesis公司);生物分子成像仪(GE公司);ECL发光仪(GE公司);2K16型台式低温离心机(Sigma公司);HR-120电子分析天平(A&D公司);DYY-7C型垂直板电泳转移装置及蛋白电泳系统电源(北京六一仪器厂);Milli-Q plus超纯水仪(Millipore公司)。
2 方法
2.1 实验设计
2.1.1Gas治疗缺血性脑卒中的药理学作用评价 为了检测Gas是否具有抗脑缺血/再灌注损伤的作用,将SD大鼠分为6组,每组15只,分别为Sham组、Model组、Model+Gas(25 mg·kg-1)组、Model+Gas(50 mg·kg-1)组、Model+Gas(100 mg·kg-1)组、Model组+Eda(10 mg·kg-1)治疗组。各组动物通过tMCAO处理后立即通过尾静脉注射分别给予生理盐水,不同剂量的Gas注射液,依达拉奉注射液。3 d后进行神经行为学评分,评分后立即处死大鼠,取脑进行TTC染色,根据染色结果统计各组大鼠梗死率和水肿率评价Gas对脑缺血/再灌注3 d后脑卒中损伤的影响。
2.1.2Gas对缺血性脑卒中相关因子表达的影响 为了探究Gas对缺血性脑卒中相关因子表达的影响,将SD大鼠分为6组,每组6只,分别为Sham组、Model组、Model+Gas(25 mg·kg-1)组、Model+Gas(50 mg·kg-1)组、Model+Gas(100 mg·kg-1)组、Model组+Eda(10 mg·kg-1)治疗组,各组动物进行tMCAO模型处理,再灌注后立即通过尾静脉注射分别给予生理盐水,不同剂量的Gas注射液,依达拉奉注射液。连续给药3 d,3 d后各组分别取3只进行灌流取脑,另外3只取缺血侧海马体和皮层组织,用于检测β-actin、caspase-3、caspase-8、Survivin和HBXIP蛋白的表达。
2.2 实验动物模型的制备动物模型采用线栓法来制备。大鼠适应1周后,术前禁食12 h,自由饮水。首先放入麻醉箱中麻醉后称体质量,仰卧位于操作台上固定四肢,带上麻醉面罩。用酒精棉润湿消毒脖颈处皮毛,手术剪小心分开皮下肌肉和脂肪,尖镊仔细分开并充分暴露出右侧颈总动脉(common carotid artery,CCA),颈外动脉(external carotid artery,ECA)和颈内动脉(internal carotid artery,ICA);将ECA结扎后并灼断,用动脉夹夹闭CCA和ICA部位,在ECA灼断处和活结之间剪一小口,插入线栓到颅腔内,在感觉到有阻力系紧活结,缝合颈部皮肤;缺血60min后剪开皮肤,拔出线栓恢复供血,缝合皮肤完成缺血/再灌注造模实验。
2.3 大鼠神经行为学评分再灌注3 d后,对各组大鼠进行神经行为学评分,评分方法为Zea Longa’s test法,评分标准如下:0=无障碍;1=不能完全伸展左侧前肢;2=向左侧转圈;3=向左侧倾倒;4=无自主活动或陷入深度昏迷中。
2.4 TTC检测大鼠梗死率和水肿率行为学评分结束后,立即用10%水合氯醛麻醉后断头取脑,切成6个脑片后置于3%的TTC溶液中,37 ℃下避光孵育15 min后放入4%多聚甲醛溶液中,浸泡24 h后将脑切片按顺序排列整齐并拍照保存,用Image-Pro Plus 6.01图像分析软件统计每个脑切片的梗死面积,患侧面积以及健侧面积。脑梗死率/%=梗死面积/(健侧面积×2)×100%;水肿率/%=(损伤侧面积-健侧面积)/(健侧面积×2)×100%
2.5 实验动物灌流取脑每组选取3只大鼠,用10%水合氯醛麻醉(3 mL·kg-1),仰卧位于解剖台上,沿着腹部两边向上剪,向上拉开胸部皮肤充分暴露出大鼠心脏,将灌注针插入左心室,止血钳夹紧灌注针和心脏,镊子挑破右心耳,开始灌注PBS溶液(pH 7.4),肝脏变白后换成4%多聚甲醛溶液继续灌注,直到大鼠肝脏变硬,四肢和尾巴僵直且不易弯折后即可取脑,放于4%多聚甲醛溶液中保存备用。
2.6 尼氏染色观察缺血侧神经元形态将灌流后的大脑进行石蜡切片,石蜡切片常规脱蜡后脱水(二甲苯Ⅰ、二甲苯Ⅱ各15 min,然后梯度乙醇脱水:100%Ⅰ、100%Ⅱ、95%、90%、80%、70%各5 min);蒸馏水冲洗3次,每次5 min;然后置于60 ℃孵箱用焦油紫染色30 s;蒸馏水洗净染料后,分别置于70%、80%和95%以及100%乙醇中脱水,再用二甲苯透明;最后用中性树胶封片。正置显微镜下观察拍照,并用Image-Pro Plus 6.01图像分析软件分析尼氏体累积光密度值。
2.7 免疫荧光染色检测Survivin和HBXIP的表达每组取6张石蜡切片,将石蜡切片组织脱蜡,二甲苯15 min×2,梯度酒精进行水化:100%乙醇10 min×2,95%乙醇5 min×1,80%乙醇5 min×1,70%乙醇5 min×1,60%乙醇5 min×1,双蒸水5 min×2,PBS溶液5 min×3;切片放入抗原修复液中煮沸10 min,自然冷却至室温,然后PBS溶液5 min×3;将切片放入含有0.5% Triton X-100(曲拉通)的PBS溶液中,透化10 min后PBS溶液5 min×3;擦干脑组织外的水迹,用组化笔画圈,滴加50 μl 5%BSA后,在湿盒中室温下封闭30 min;擦干组织周围,滴加50一抗Survivin(1 ∶250)和HBXIP(1 ∶250),4 ℃过夜;取出湿盒复温30 min,PBST溶液10 min×3;避光条件下,加二抗稀释液和Hoechst 33342(比例1 ∶1 000),室温孵育2 h;PBST溶液10 min×3,90%甘油封片后盖上盖玻片,用指甲油封住固定。
2.8 海马体和皮层蛋白的提取分别称取海马体和皮层组织约80 mg,加入800 μL预冷的组织裂解液,超声破碎仪中匀浆,冰上裂解30 min后于4 ℃ 12 000 r·min-1离心30 min,取上清,取5 μL上清通过BCA法测定蛋白含量,其余上清按比例加入SDS上样缓冲液并于100 ℃沸水浴中煮沸10 min变性,-80 ℃保存。
2.9 Western blot检测caspase-3、caspase-8和Survivin、HBXIP蛋白的表达采用SDS-PAGE 凝胶电泳,然后将蛋白转至PVDF 膜,用5% BSA 封闭2 h 后孵育一抗,加入一抗β-actin(1 ∶5 000)、caspase-3(1 ∶1 000)、caspase-8(1 ∶1 000)、Survivin(1 ∶2 500)、HBXIP(1 ∶2 500),4 ℃孵育过夜。摇床室温孵育二抗2 h。PVDF 膜用TBST 洗涤10 min×3次后,加ECL 显色剂,用凝胶成像系统检测,以β-actin为内参,分析目的条带/对应内参的相对表达量。
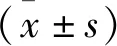
3 结果
3.1 Gas对tMCAO大鼠梗死率、水肿率以及神经行为学评分的影响如Fig 2所示,Sham组未见梗死区和水肿,无神经功能缺损。当大鼠缺血/再灌注3 d后,相比于Sham组、Model组、缺血侧大脑白色梗死区和水肿范围明显增加(P<0.01),神经缺损功能评分增加(P<0.01);与Model组相比,Gas(50、100 mg·kg-1)和Edaravone(10 mg·kg-1)治疗组的大脑梗死率、水肿率和神经行为学评分明显减少,差异具有显著性(P<0.01)。
3.2 Gas对tMCAO大鼠神经元形态学损伤的影响如Fig 3A-C所示,Sham组大鼠海马CA1区和皮层中锥体细胞形态结构完整,排列紧密,胞质核仁清晰,存在大量的神经元;缺血/再灌注3 d后,Model组大脑海马CA1区和皮层中神经元细胞较少,轮廓模糊不清,尼氏小体明显减少,细胞排列紊乱(P<0.01);Gas(50、100 mg·kg-1)和Edaravone(10 mg·kg-1)治疗组大脑海马CA1区和皮层中锥体细胞排列较为紧密,细胞边界较为清晰,尼氏小体数量增加,神经元密度增加(P<0.01)。
3.3Gas可抑制缺血/再灌注后相关凋亡蛋白的表达如Fig 4 A,B所示,通过蛋白免疫印迹法检测大脑缺血侧海马CA1区和皮层中caspase-3蛋白表达增加。缺血/再灌注后72 h,与sham组相比,Model组中caspase-3的表达明显增加;与Model组相比,Gas(50、100 mg·kg-1)和Eda(10 mg·kg-1)药物治疗后海马CA1区和皮层中缺血侧caspase-3蛋白表达减少(P<0.05);大脑缺血侧海马CA1区和皮层中caspase-8蛋白的表达表现出同样的趋势。
3.4 Gas可促进tMCAO大鼠神经元中Survivin和HBXIP蛋白的表达如Fig 5 A所示,通过蛋白免疫印迹法检测大脑缺血侧皮层中Survivin和HBXIP蛋白表达增加。缺血/再灌注后72 h,与sham组相比,Model组中Survivin和HBXIP的表达明显增加(P<0.05);与Model组相比,Gas(100 mg·kg-1)和Eda(10 mg·kg-1)药物治疗后缺血侧皮层中Survivin和HBXIP蛋白表达增加(P<0.01)。
如Fig 5 B、C所示,免疫荧光染色显示,相比于Sham组大脑海马和皮层组织内的Survivin和HBXIP荧光表达水平增加;相比于Model组,Gas给药组和依达拉奉给药组Survivin和HBXIP荧光表达增加。其趋势与Survivin和HBXIP蛋白表达相一致。

Fig 5 Effect of gastrodin on expressions of Survivin,HBXIP in brain of rats induced by tMCAOA: Protein levels of Survivin and HBXIP in brains 72 h after tMCAO in rats B: Immunofluorescence showed the expression of Survivin in hippocampus CA1 and cortex of 72 h after tMCAO in rats; C: Immunofluorescence showed the expression of HBXIP in hippocampus CA1 and cortex of 72 h after tMCAO in rats.#P<0.05 vs sham group,*P<0.05,**P<0.01 vs model group.
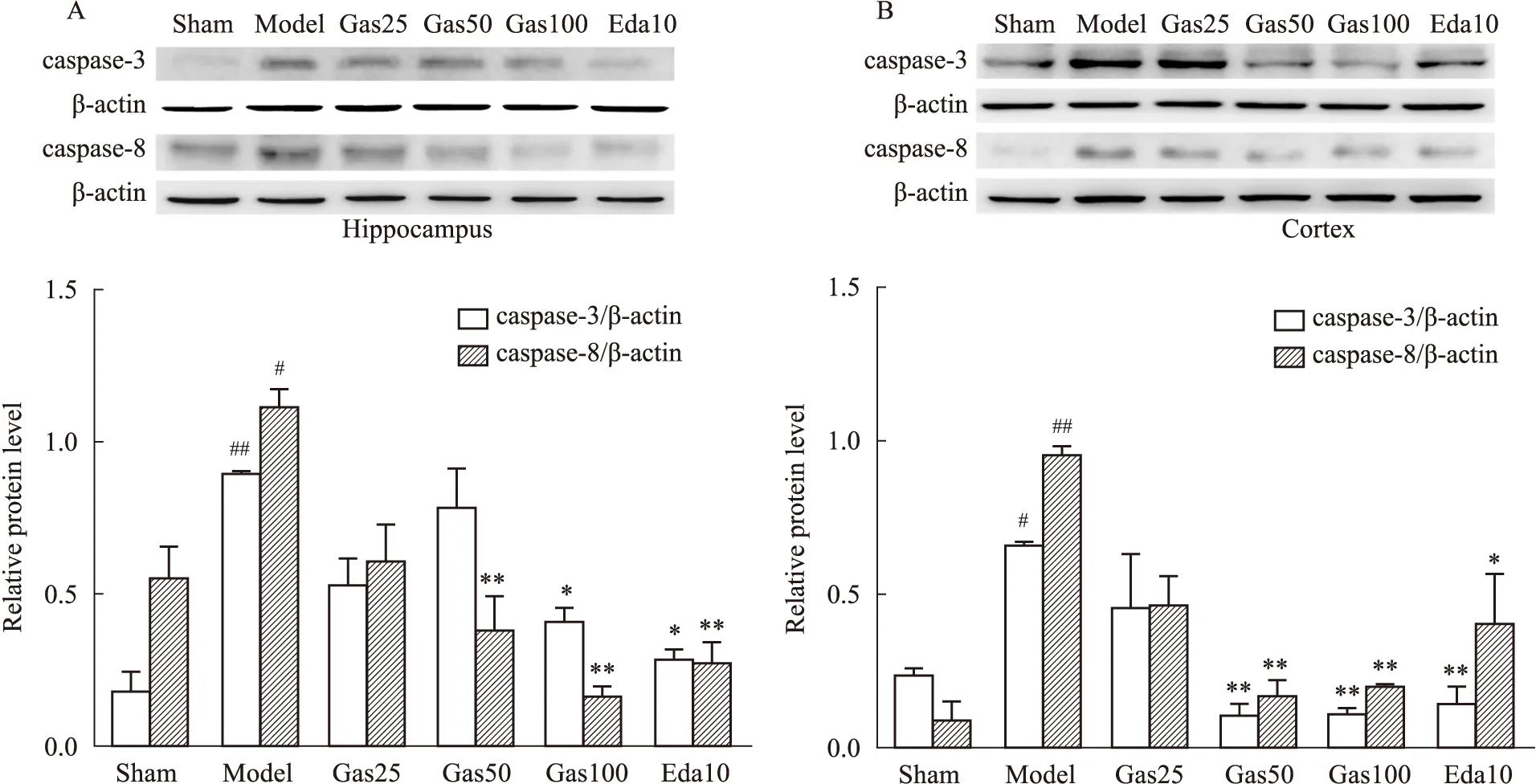
Fig 4 Effect of gastrodin on expressions of caspase-3,caspase-8 in brain of rats induced by tMCAOA: Protein levels of caspase-3 and caspase-8 in hippocampus 72 h after tMCAO in rats; B: Protein levels of caspase-3 and caspase-8 in cortex 72 h after tMCAO in rats vs sham group,*P<0.05,**P<0.01 vs model group.
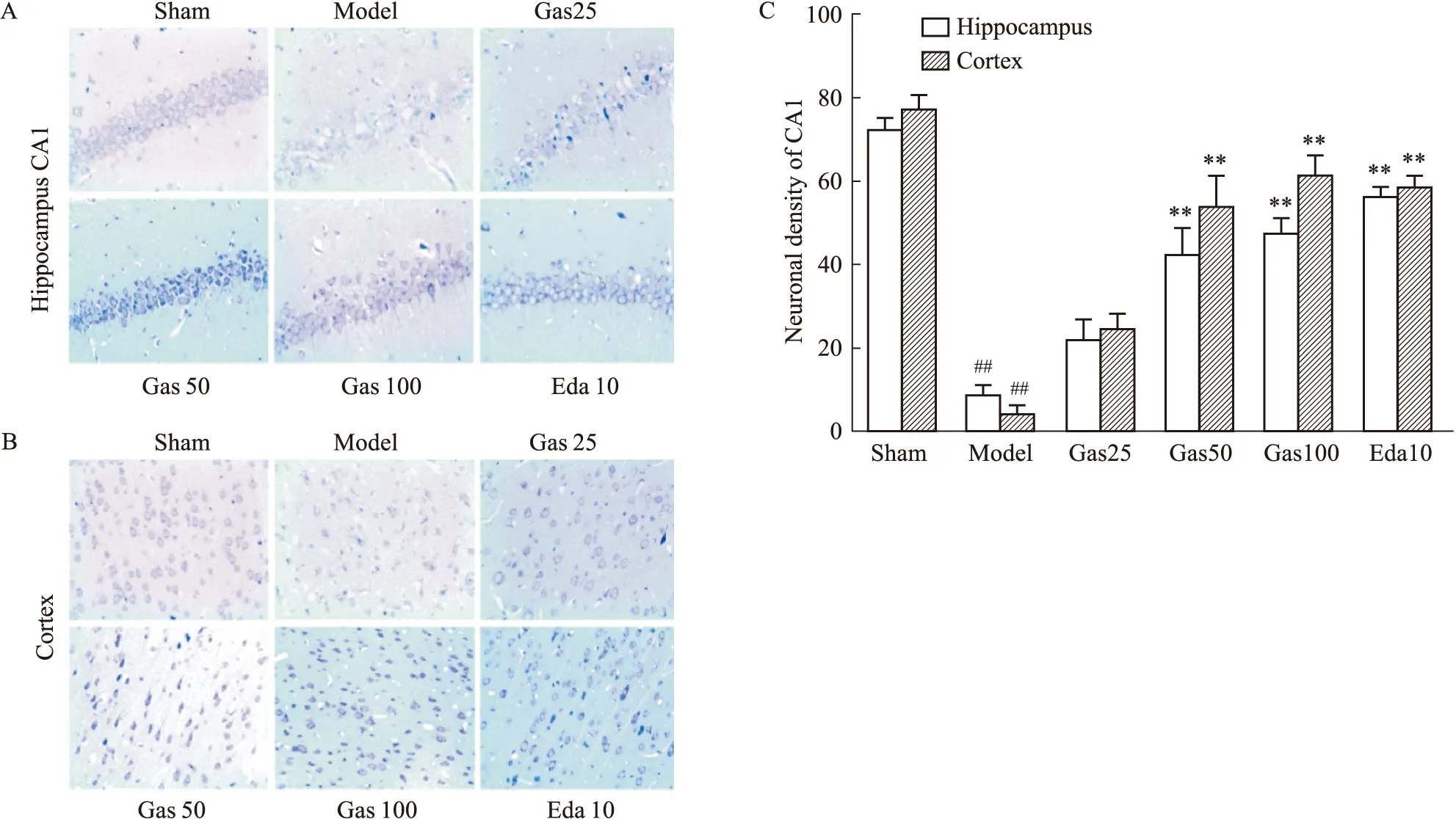
Fig 3 Effect of gastrodin against hippocampus CA1 neuronal and cortex neuronal injury in rats with tMCAO
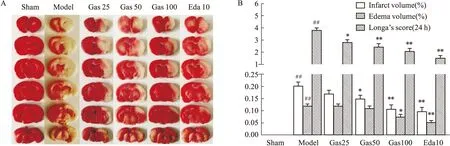
Fig 2 Effect of gastrodin on ischemia-reperfusion injury in tMCAO ratsA: Representative photographs of TTC-stained brain sections; B: Cerebral infarct volume and edema volume examined of rats in each group,and Ldonga's test score to evaluate neurological deficits vs Sham group,*P<0.05,**P<0.01 vs Model group.
4 讨论
缺血/再灌注后使大脑出现病理性变化,随后出现一系列生理改变,包括氧化应激、炎症反应、细胞程序性死亡等,从而引起神经细胞功能障碍和神经元死亡。有研究发现,Gas可以在分子水平与机体纤维蛋白原结合,可通过血脑屏障,静脉注射可快速进入大脑,故本实验选择尾静脉注射给药的方式来探究。研究结果显示,Gas可明显减少tMCAO大鼠的神经行为学异常,脑梗死和脑水肿症状,表明Gas具有改善缺血/再灌注损伤的作用。
由于脑缺血会导致神经元坏死或凋亡,本研究还观察了与缺血性脑卒中密切相关的大脑海马CA1区和皮层神经元损伤情况[10-12]。尼氏小体是神经元合成蛋白的主要场所,其变化能反映神经元功能情况,是神经细胞功能活性的形态指标。当受损神经元功能修复后,已经破碎并逐渐消失的尼氏小体可重新出现。尼氏染色结果显示,Gas治疗明显增加增加尼氏小体数量,明显促进神经元功能的恢复。
细胞凋亡是迟发性神经元死亡的主要形式,一般发生在缺血/再灌注3~4 d。当细胞受到刺激时,细胞色素C从线粒体释放后与凋亡相关因子1(apoptosis protein activating factor,Apaf-1)结合形成多聚体,并促使caspase-9与其结合形成凋亡小体,激活caspase-3,从而诱导细胞凋亡。而激活的caspase-8能间接诱导细胞色素C从线粒体释放进入胞质,从而把死亡受体通路和线粒体通路联系起来,有效地扩大了凋亡信号。另外由于酶原形式的pro-caspase-3和pro-caspase-8本身不具备催化活性,故而实验中通过检测活化后的caspase-3和caspase-8来表明细胞凋亡的发生。本研究发现,Gas可明显抑制caspase-3和caspase-8凋亡因子的表达,提示本实验中,Gas具有抑制细胞凋亡通路激活的功效。
细胞的凋亡不仅仅是凋亡因子表达参与的结果,而是细胞内抗凋亡因子与促凋亡因子表达失衡导致的结果。有文献显示,Survivin能够抑制线粒体中由凋亡蛋白活化因子1结合细胞色素c和活化Pro-caspase-9,酶解Pro-caspase-3 使之激活从而执行的细胞凋亡[13]。Survivin还可通过p21抑制caspase活化而抗凋亡。在神经系统中,2005年有文献报道从胚胎d 10.5开始进行Survivin的条件敲除,新生小鼠突变体显示出严重的多灶性凋亡,脑体积明显缩小,表明Survivin对于发育中的中枢神经细胞的存活很重要。当大脑受到缺血/再灌注损伤后,Survivin在神经组织细胞中会大量的表达,而且参与迟发性神经元死亡的过程[14]。而HBXIP作为Survivin分子伴侣,可与Survivin形成复合物,增强Survivin的抗凋亡作用。
HBXIP是一种因可与乙肝病毒X蛋白的C端特异性结合而得名的蛋白质,参与DNA的复制、细胞凋亡、细胞侵袭和转移等过程,与Survivin结合后可抑制线粒体内源性途径诱导的凋亡。2017年文献表示HBXIP和Survivin复合物可拮抗全脑缺血/再灌注后损伤中的神经元凋亡[15]。本实验通过蛋白质印迹法和免疫荧光染色法观察发现,Survivin和HBXIP蛋白的表达在Gas治疗下得到明显的提升。表明Gas不仅通过抑制凋亡因子的表达,而且促进抗凋亡因子的表达来实现对缺血性脑卒中神经元的保护作用。
本课题研究进一步阐明Gas对缺血性脑卒中的相关作用机理,有助于丰富和发展缺血性脑卒中发病机制的假说,为寻找新型潜在的抗缺血性脑卒中具有重要的意义。
(致谢:本实验研究工作在中国医学科学院药物研究所药理实验室完成,感谢实验室的老师和同学!)

