大黄素甲醚对酒精性肝损伤中SIRT1-AMPK通路的影响
王瑞婕,杨 勇,白 婷
(大连大学医学院,辽宁 大连 116622)
在我国,酒文化源远流长,随着我国饮食结构和生活方式的改变,酒精性肝病(alcoholic liver disease,ALD)的发病率迅速增加,其引起的健康问题严重威胁我国人民的身体健康和社会发展[1]。ALD是指长时间乙醇作用导致肝细胞坏死和永久性结构破坏的肝病严重形式,包括轻症酒精性肝病(mild alcoholic injury)、酒精性脂肪肝(alcoholic fatty liver)、酒精性肝炎(alcohol hepatitis)、酒精性肝纤维化(alcoholic hepatic fibrosis)和酒精性肝硬化(alcoholic cirrhosis)等5种类型[2]。酒精性脂肪肝是指由于长期大量的酒精摄入导致的肝脏脂肪代谢异常的疾病。酒精进入机体,大部分会在肝脏被代谢,由于人体代谢能力有限,最终会引起肝内的脂肪堆积,脂肪变性、坏死,从而导致脂肪肝。
沉默信息调节因子蛋白1(silent information regulator factor 2 related enzyme 1,SIRT1),是NAD+依赖的Ⅲ型组蛋白脱乙酰酶,主要通过对组蛋白、转录因子及其它蛋白修饰的赖氨酸残基进行去乙酰化,调节基因、蛋白的表达[3]。酒精的摄入可通过脂联素、乙醛、乙酸脂多糖、氧化应激等多种方式抑制SIRT1的活性及表达,进而多种转录因子的活性被抑制或被激活,诱发一系列级联反应,从而调节脂肪合成以及脂肪酸氧化过程,因此形成酒精性脂肪肝[4]。伴随酒精摄入量的不断增加,呈现渐进性发展趋势,可发展至酒精性肝炎、酒精性肝纤维化、酒精性肝硬化甚至肝癌[5]。Yang等[6]发现,在C57BL/J小鼠肝脏和HepG2细胞中,α-硫辛酸可以增强SIRT1去乙酰化酶的活性,通过去乙酰化肝脏激酶1(LKB1),激活SIRT1/LKB1/腺苷酸活化蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)信号通路,发挥调节代谢的作用。LKB1通过磷酸化AMPKα亚基(Thr172)并抑制磷酸化酶对AMPK的去磷酸化作用从而使其激活[7]。AMPK是能量代谢的关键调节因子,因其活性受AMP/ATP比值调控,被称作细胞的“能量监测器”,在维持机体能量代谢平衡、葡萄糖及脂肪酸代谢、细胞代谢等过程中发挥重要的调节作用[8]。当胞内AMP与ATP的比值增加时,AMPK的磷酸化使下游靶分子激活,一方面糖原、脂肪和胆固醇的合成被抑制,即减少了ATP的利用,另一方面细胞的分解代谢增加,促进脂肪酸氧化、糖酵解,即增加了ATP的产生;当AMP与ATP的比值减少时,细胞的合成代谢增加,则AMPK的活性受到抑制[9]。固醇调节元件结合蛋白-1c(sterol regulatory element-binding protein-1c,SREBP-1c)是调节脂肪合成的关键核转录因子,属于固醇调节元件结合蛋白家族成员中的一员。在研究酒精性脂肪肝时发现,SREBP-1c是AMPK的一个直接靶蛋白,AMPK抑制SREBP-1c活性是通过磷酸化SREBP-1c的372丝氨酸位点,调节蛋白裂解成熟和核内转位过程,进而抑制固醇调节元件依赖的促脂靶蛋白脂肪酸合成酶的表达[10]。在酒精性肝炎的研究中,基于肝脏巨噬细胞和肝细胞的交叉对话,调控SIRT1-LKB1-AMPK-SREBP1c通路可抑制脂肪生成和肝脏脂质沉积,从而缓解酒精性肝病的进程[11]。
大黄素甲醚(physcion,PHY)属蒽醌类化合物,又名朱砂莲乙素、非斯酮,是分布最广泛的一种蒽醌类物质,主要从中草药蓼科植物大黄中提取得到。研究发现,大黄素甲醚具有抗炎性因子、抗氧化、抗癌、抗菌以及抗白血病等多种药理活性[12]。此外,大黄素甲醚对胆汁淤积肝损伤有一定的保护作用[13]。因此,本研究拟针对大黄素甲醚,探讨其对酒精性肝损伤中SIRT1-AMPK通路的作用机制。
1 材料
1.1 实验动物8~10周龄C57BL/6小鼠,健康♂,体质量约(20±2)g,由大连医科大学动物中心提供,许可证号为SCXK(辽)2004-0017。
1.2 药物与试剂大黄素甲醚(纯度>99%,北京索莱宝科技有限公司);SRT1720(SIRT1激动剂)、AICAR(AMPK激动剂)(纯度>99%,MCE公司);Lieber-DeCarli酒精液体饲料(南通特洛菲饲料科技有限公司);谷丙转氨酶(alanine aminotransferase,ALT)试剂盒、谷草转氨酶(aspartate aminotransferase,AST)试剂盒、甘油三酯(triglyceride,TG)试剂盒(南京建成生物工程研究所);SIRT1抗体、AMPKα抗体、p-AMPKα抗体、GAPDH抗体(Cell Signaling Technology公司);SREBP-1c抗体(Abcam公司);IL-1β ELISA试剂盒(美国PeproTech公司)。
1.3 仪器高速冷冻离心机、Multiskan FC酶标仪(美国Thermo Fisher公司);蛋白电泳转膜系统(美国Bio Rad公司)。
2 方法
2.1 动物分组将36只C57BL/6小鼠,随机分为6组,即正常对照组(Control)、酒精饲料组(EtOH)、酒精饲料+SRT1720组、酒精饲料+AICAR组、酒精饲料+大黄素甲醚组(PHY 20、40 mg·kg-1),每组6只。
2.2 模型构建采用美国国立卫生院酒精滥用与酒精中毒研究所(National Institute on Alcohol Abuse and Alcoholism,NIAAA)肝病研究室建立ALD模型的方法建立小鼠酒精性肝损伤模型[12]。首先给予6组小鼠5 d对照饮食,作为液体饮食的适应期,随后正式开始实验:正常对照组继续给予对照液体饮食;其余5组改为含5%酒精的Lieber-DeCarli液体饲料喂养,共喂养10 d,每天上午7~9点之间更换饮食。正常对照组根据小鼠体质量灌胃给予生理盐水。酒精饲料+SRT1720组灌胃给予50 mg·kg-1SRT1720,酒精饲料+AICAR组灌胃给予500 mg·kg-1AICAR,酒精饲料+大黄素甲醚组分别灌胃给予20、40 mg·kg-1大黄素甲醚,连续10 d。d 11除对照组外,其余5组各酒精灌胃(5 g·kg-1体质量)1次,对照组给予等热量麦芽糖糊精灌胃1次。9 h后处死小鼠,收集血清,分离肝脏,肝脏左叶用10%中性福尔马林浸泡用于病理检测,其余部分放于-80 ℃冰箱内保存,用于后期Western blot蛋白印迹实验。
2.3 肝脏外观形态观察及肝指数测定小鼠称体质量后眼球取血,颈椎脱臼处死,剖取肝脏,将肝组织置于6 cm培养皿中,用高倍相机在同视野下拍照观察外观形态。生理盐水洗血,滤纸吸干后称肝质量。肝指数/%=肝脏质量(g)/体质量(g)×100%。
2.4 血清生化指标检测使用ALT、AST、TG检测试剂盒测定血清中三者含量。
2.5 肝组织病理观察取出在10%中性福尔马林缓冲液中固定的肝组织,包埋在石蜡中。用旋转切片机将肝脏包埋块切成5 μm厚度,常规HE染色。200倍光学显微镜下观察分析肝组织病理学改变。
2.6 免疫组织化学实验采用常规免疫组化染色,用石蜡包埋肝组织,切片脱蜡至水,抗原修复,内源性过氧化物酶封闭后一抗4 ℃孵育过夜,增强剂孵育后二抗室温孵育20 min,DAB显色后苏木精复染,脱水、透明、封片,200倍光学显微镜下观察SIRT1、p-AMPKα表达情况。
2.7 ELISA检测细胞因子IL-1β含量取肝脏标本,按照ELISA试剂盒的说明书进行操作,测定肝脏中IL-1β的含量。
2.8 Western blot检测蛋白表达水平从-80 ℃冰箱中取出肝脏组织称质量后,利用液氮和研钵将其粉碎成细粉。加入组织裂解液进一步匀浆研磨,冰上放置充分裂解,30 min后,4 ℃,1 000 r·min-1离心15 min,上清即为肝脏总蛋白。BCA法测定蛋白浓度,95 ℃热浴5 min使蛋白变性。采用10% SDS-PAGE胶进行电泳,湿法转膜;5%脱脂奶室温封闭1 h后,加入封闭液稀释的AMPKα(兔抗,1 ∶1 000)、p-AMPKα(兔抗,1 ∶500)、SIRT1(鼠抗,1 ∶1 000)、SREBP1c(兔抗,1 ∶5 000)抗体和内参GAPDH(兔抗,1 ∶1 000)抗体,4 ℃孵育过夜。次日,用TBST缓冲液洗膜,加入相应二抗室温孵育1 h后,ECL显色,暗室中用X胶片感光、显影、定影、扫描图片。
3 结果
3.1 大黄素甲醚对酒精诱导小鼠状态与肝指数的影响Lieber-DeCarli液体酒精饲料慢性喂养10 d,酒精模型组小鼠出现活动量减少,小鼠体质量减轻,正常对照组小鼠毛色光滑,活动积极。PHY、SRT1720、AICAR各组小鼠毛色略有改善,活动量与精神状态也略有改善。肝指数在一定程度上反映肝脏肿胀情况,大黄素甲醚各组肝指数虽有所降低,但无统计学意义,见Fig 1。
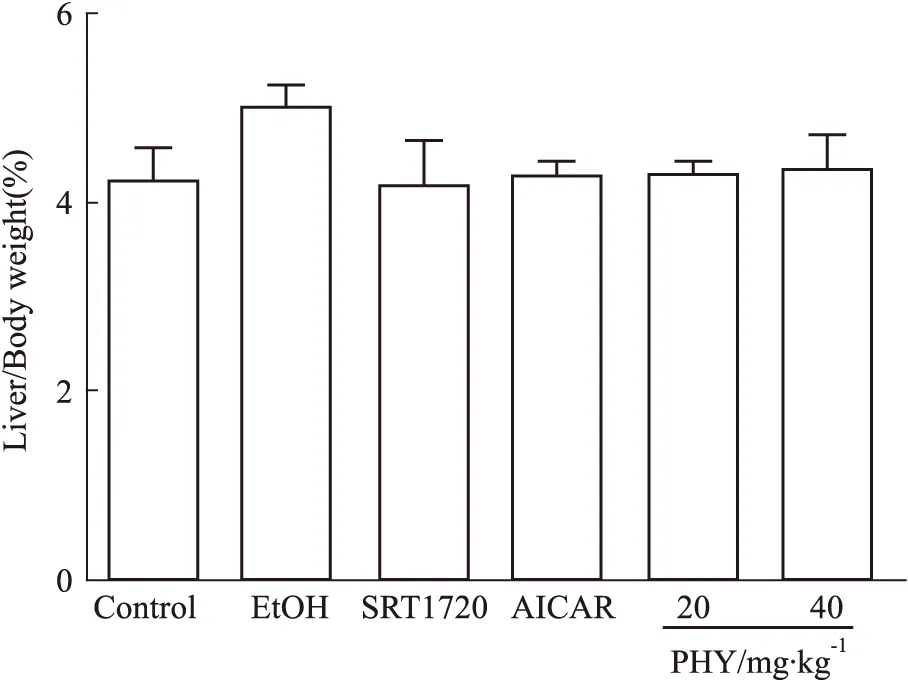
Fig 1 Ratios of liver to body
3.2 大黄素甲醚对血清中ALT、AST、TG含量的影响与正常对照组相比,酒精模型组小鼠血清中ALT、AST、TG含量明显高于正常组(P<0.01),与酒精模型组相比,大黄素甲醚PHY以及SRT1720、AICAR激动剂组小鼠血清ALT、AST、TG明显降低(P<0.01),且大黄素甲醚高剂量组要低于各激动剂组,见Tab 1。

Tab 1 Comparison of serum ALT,AST,TG content
3.3 大黄素甲醚对小鼠肝组织病理变化的影响如Fig 2所示,大体观察肝脏表面颜色和光滑度,正常组小鼠肝脏表面光滑,颜色呈红褐色,酒精模型组小鼠肝脏表面粗糙,色泽较正常组小鼠暗淡。HE染色观察肝内结构,炎症水肿等病理损伤,正常组小鼠肝脏未见明显病变,肝细胞结构正常,内无脂滴形成,肝细胞无脂肪变性。酒精模型组小鼠肝脏不同程度的水肿,脂质内分布有许多脂肪空泡,有点状、片状坏死及炎性细胞浸润。大黄素甲醚组以及SRT1720、AICAR激动剂组小鼠肝脏肿胀程度明显减轻,肝组织变性程度也明显减轻,说明大黄素甲醚在一定程度上减轻肝细胞的脂肪变性与炎性细胞浸润。
3.4 大黄素甲醚对肝脏组织中IL-1β的影响为了观察大黄素甲醚对酒精性肝损伤小鼠肝脏炎症的影响,采用ELISA测定肝脏IL-1β水平。与正常对照组相比,酒精模型组小鼠肝脏中IL-1β水平明显升高(P<0.01),与模型组相比,SRT1720及AICAR组IL-1β表达明显降低,大黄素甲醚高低剂量给药组明显降低IL-1β水平(P<0.01),且存在剂量依赖性,见Fig 3。
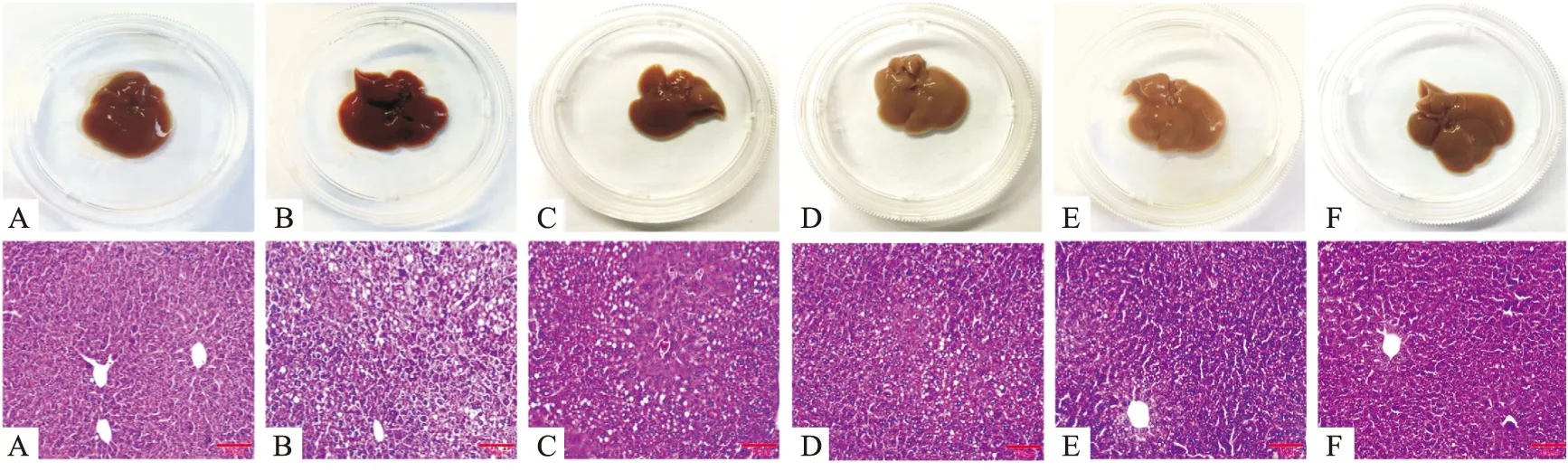
Fig 2 Pictures and pathological changes of mouse liver(HE×200)A: Control; B: EtOH; C: SRT1720; D: AICAR; E: PHY (20 mg·kg-1); F: PHY (40 mg·kg-1)
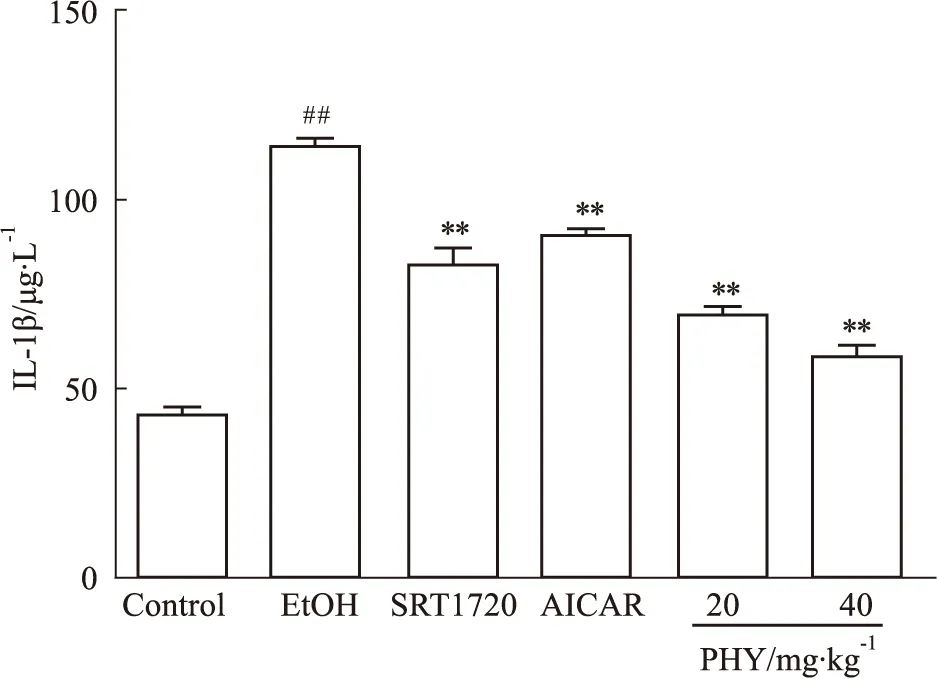
Fig 3 Effect of PHY on IL-1β in mice with##P<0.01 vs control; **P<0.01 vs EtOH.
3.5 大黄素甲醚对小鼠肝脏中SIRT1、p-AMPKα表达的影响免疫组化染色测定PHY及各激动剂对小鼠肝脏中SIRT1、p-AMPKα表达的影响,采集高倍视野图像,Fig 4结果显示,SIRT1、p-AMPKα细胞染色呈黄色或棕黄色为阳性,与正常对照组相比,酒精模型组小鼠肝脏SIRT1、p-AMPKα蛋白表达明显减少;与酒精模型组相比,SRT1720及AICAR组SIRT1、p-AMPKα表达明显增强,大黄素甲醚组SIRT1、p-AMPKα表达呈剂量依赖性升高。
3.6 大黄素甲醚对肝脏组织中SIRT1、AMPKα、p-AMPKα、SREBP1c蛋白水平的影响从Fig 5结果可知,与正常对照组相比,酒精模型组SIRT1表达以及AMPKα的磷酸化水平受抑制。与酒精模型组相比,SRT1720及AICAR组SIRT1表达及AMPKα的磷酸化水平明显升高,大黄素甲醚高低剂量给药组SIRT1表达及AMPKα的磷酸化水平明显增加,且存在剂量依赖性(P<0.01)。此外,与正常对照组相比,酒精模型组SREBP1c蛋白表达增加,与酒精模型组相比,PHY高低剂量给药组以及SRT1720、AICAR组均明显地降低了SREBP1c蛋白表达(P<0.01)。

Fig 5 Expression of SIRT1,AMPKα,p-AMPKα,SREBP1c in liver tissues of mice##P<0.01 vs control; *P<0.05,**P<0.01 vs EtOH.
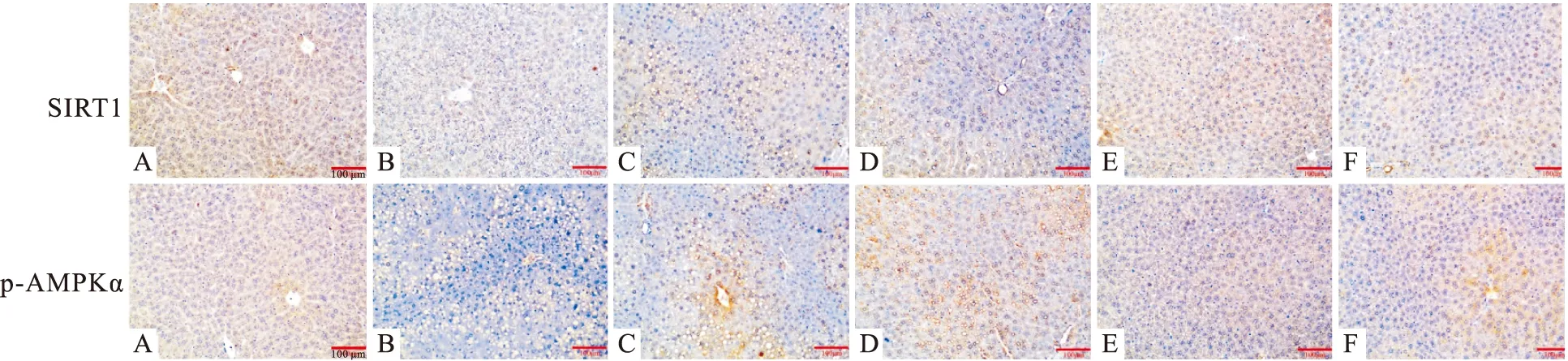
Fig 4 Expression of SIRT1 and p-AMPKα in liver tissues of mice in each group(×200)A: Control; B: EtOH; C: SRT1720; D: AICAR; E: PHY (20 mg·kg-1); F: PHY (40 mg·kg-1)
4 讨论
过度饮酒会导致脂肪肝的发生,它是ALD的最早期阶段,20%~40%的重度饮酒者会发展为更严重的ALD,包括酒精性肝炎和肝硬化。许多酒精性肝炎患者都有长期慢性饮酒史,最近伴有酗酒、醉酒的病史[14],同样,实验动物模型也发生上述变化。NIAAA模型(Gao-Binge模型)与人类的饮酒方式高度接近,可模拟人酒精性肝炎的发病过程,表现为肝脏有较严重的脂肪变性和炎症,中性粒细胞浸润明显,血清中酒精浓度较高,ALT水平明显升高[15]。因此,本研究采用含酒精的Lieber-DeCarli饮食喂养小鼠10 d,然后用单剂酒精灌胃1次建立酒精性肝损伤模型。本研究显示,小鼠模型组的肝脏内脂滴沉积,炎性细胞浸润,说明Lieber-DeCarli慢性喂养加急性酒精灌胃成功建立小鼠酒精性肝损伤,且PHY给药组的小鼠肝脏内脂肪沉积随浓度增加而有所改善。有研究表明大黄甲醚能够抑制肝脏巨噬细胞促分裂原激活蛋白激酶和核转录因子κB激活,从而发挥抗炎的作用[16]。为了观察PHY对肝细胞炎症损伤的影响,采用ELISA测定IL-1β水平,实验结果表明PHY能够抑制酒精诱导的IL-1β水平,同时,SIRT1激动剂以及AMPK激动剂均能降低IL-1β水平,说明PHY能够抑制酒精性肝损伤的炎症反应。
肝脏是SIRT1主要表达的器官之一,SIRT1可调节基因表达、参与糖脂代谢、调节炎性反应等许多病理生理过程。为了进一步探讨PHY缓解酒精性肝损伤的机制,我们研究了其对SIRT1-AMPK通路的作用。酒精性肝损伤可以降低SIRT1的表达,肝内过表达SIRT1可防止由ALD引起的肝脏脂质代谢损伤[17]。本研究结果显示,在酒精性肝损伤小鼠中,肝脏SIRT1表达量下降,而给予PHY后,SIRT1表达量明显升高,且给予SIRT1激动剂SRT1720组其表达量也明显升高,显示SIRT1在酒精性肝损伤中起调控作用。SIRT1下游分子AMPK是广泛分布于生物体内的高度保守的蛋白激酶,具有抗氧化应激、抗炎和抗凋亡等多种生物学作用,可抑制脂肪酸与甘油三酯的合成,促进脂肪酸氧化分解,从而影响脂质代谢。在肝脏中,AMPK通过磷酸化作用调节脂质代谢,其下游蛋白激酶SREBP-1c是调控脂质合成与代谢的关键调控分子,在酒精性肝损伤的发生发展中起着重要作用。本研究结果中,酒精性肝损伤小鼠肝组织p-AMPKα蛋白水平降低,SREBP-1c表达量增加,经PHY干预后,AMPKα的磷酸化增加,SREBP-1c表达减少,且AMPK激动剂AICAR组SREBP-1c表达量也明显降低。总之,我们的研究结果提示PHY可能通过激活SIRT1-AMPK通路,调节脂质合成与代谢的关键调控分子,抑制脂肪酸合成,从而在缓解酒精性肝损伤中发挥重要作用,但是更深入的机制需采用SIRT1基因敲除鼠及细胞的进一步研究来揭示。
综上所述,PHY能够改善慢性喂养液体酒精饲料加急性酒精灌胃所引起的脂肪变性损伤和炎症水平,对肝脏具有一定的保护作用,其机制可能与SIRT1-AMPK信号通路的活化相关,确切机制有待深入探索。

