野黄芩素改善高糖诱导小胶质细胞活化引起的血脑屏障功能障碍
王梦娜,梅茜钰,陆 宾,徐 红
(上海中医药大学中药研究所,上海市复方中药重点实验室,中药标准化教育部重点实验室,中药新资源与质量标准综合评价国家中医药管理局重点研究室,上海 201203)
中枢神经系统(central nervous system,CNS) 微血管内皮细胞对维持CNS稳态有着至关重要的作用,也是构成血脑屏障(blood brain barrier,BBB) 的关键成分[1]。据报道,糖尿病进程中的高糖环境会引起微血管内皮功能障碍,会加速许多CNS疾病进程,包括中风、阿尔茨海默病和创伤性脑损伤[2-4]。BBB是由高度特异性的CNS微血管内皮细胞组成,许多脑疾病常伴有BBB破坏,进而导致疾病发展的加剧[5]。在BBB中,紧密连接(tight junctions,TJs) 蛋白主要包括Claudin和Occludin两大家族,主要功能为连接内皮细胞,封闭间隙,在维持血脑屏障功能和调节血管内皮通透性方面扮演了重要的角色[6]。
野黄芩素(scutellarein)是从灯盏细辛(erigerontis herba)、木蝴蝶(oroxyli semen)等具有抗炎镇痛中药中分离鉴定的活性单体成分,具有抗癌、神经保护和抗炎等作用[7-9]。有报道发现,野黄芩素可抑制缺氧诱导的血管内皮细胞增殖和血管内皮生长因子表达,从而有助于减轻糖尿病微血管并发症糖尿病视网膜病的发生[10]。本研究主要探讨野黄芩素对高糖诱导激活神经小胶质细胞所介导的BBB破损的改善作用。
1 材料
1.1 药物野黄芩素(scutellarein,纯度≥98%),购自上海益宏生物化工有限公司。
1.2 细胞小鼠脑内皮细胞株bEnd.3购自Life Technology(Carlsbad, CA);小鼠神经小胶质细胞BV-2得自上海中医药大学中药研究所吴晓俊老师课题组馈赠。
1.3 主要试剂Occludin(货号sc-133256)、claudin-1(货号sc-166338) 和claudin-19(货号sc-390274) 抗体均购自Santa Cruz(CA);claudin-5(货号GTX84681) 抗体购自GeneTax(Alton Parkway Irvine, CA);anti-Rabbit IgG(H+L)(货号312-005-003) 和anti-Mouse IgG(H+L)(货号415-005-166) 均购自Jackson ImmunoResearch(West Grove, PA);酶联免疫吸附试验盒(ELISA) 购自R&D(Minneapolis, MN);葡萄糖和其他试剂,除非另有说明,均购自Sigma Chemical Co.(St. Louis, MO)。
1.4 主要仪器凝胶成像系统(SYNGENE),超纯水过滤仪(Millipore),分析天平(METTLER TOLEDO),酶标仪(Bio-Tech),低温离心机(Eppendorf),-80℃低温冰箱(Thermo Fish),超声波细胞粉碎仪(宁波新芝生物科技公司)。
2 方法
2.1 细胞培养含10% FBS、1%双抗的DMEM培养基和RPMI 1640培养基分别用于培养小胶质细胞BV-2和内皮细胞bEnd.3,两种细胞均在5% CO2、37 ℃饱和湿度恒温培养箱中培养。
2.2 细胞模型建立及药物处理细胞模型建立:取对数生长期内皮细胞,传至0.45 μm孔径的细胞小室中,置小室于24孔板中,在小室中加培养基400 μL,在24孔板中加培养基500 μL,隔天换液,培养1周后于24孔板中铺入对数生长期小胶质细胞,密度2×104/孔,建立血脑屏障细胞模型。药物处理:野黄芩素以DMSO溶解,配制成0.1 mol·L-1的母液,按所需浓度以培养基进行稀释用于后续实验,加药后DMSO终浓度不得超过0.1%。葡萄糖(glucose)、甘露醇(mannitol) 溶解于无血清的DMEM培养基中,溶液用0.22 μm滤膜进行过滤除菌,浓度为0.5 mol·L-1。TNF-α粉末以0.1% BSA溶液溶解,配成浓度20 mg·L-1的母液。
2.3 蛋白电泳实验取对数生长期内皮细胞,贴壁生长良好后,加入野黄芩素(20、50 μmol·L-1),保护6 h后加入TNF-α(20 μg·L-1),孵育18 h后胰蛋白酶消化收细胞沉淀,并制备成蛋白样本。用SDS-PAGE胶对制备好的蛋白样本进行电泳,完成后将目标蛋白转印至PVDF膜(甲醇活化)上,条带在TBST溶液(含5%脱脂牛奶)中封闭1 h,然后按实验需求1 ∶200稀释抗体claudin-1、claudin-19,1 ∶1 000稀释抗体occludin、claudin-5,将抗体同条带一起4 ℃孵育过夜。隔天取出条带于室温平衡1 h后,用TBST溶液洗去一抗,快摇洗3次,每次8~10 min,然后与1 ∶3 000稀释的二抗室温孵育1 h,再洗去过量二抗,加入化学发光液进行显像,蛋白条带用GeneTools图像分析软件进行定量。
2.4 酶联免疫吸附实验取对数生长期小胶质细胞,混悬均匀后传至96孔板中,密度为2×104个/孔,体系为每孔100 μL。贴壁生长良好后更换新鲜培养基,加入野黄芩素(20、50 μmol·L-1),孵育6 h后,加入25 mmol·L-1的高浓度葡萄糖和等渗对照甘露醇孵育24 h,收集细胞上清液,离心1 000×g,3 min,吸取上层清液,测定TNF-α含量。具体操作按照试剂盒说明书进行。
2.5 内皮细胞跨内皮电阻实验细胞模型建立后,加野黄芩素,终浓度为20、50 μmol·L-1,保护6 h后,① 于24孔板中加入25 mmol·L-1的高浓度葡萄糖和等渗对照甘露醇,共孵育6 h、24 h后测定跨內皮细胞电阻(transendothelial electrical resistance,TEER);② 于24孔板中加入TNF-α(20 μg·L-1),共孵育6 h、18 h后测定TEER。TEER用Millipore Millicell ERS-2细胞电阻仪进行测量,其计算方法为:单层细胞跨内皮电阻(ΔΩcm2)=(样本小室电阻值-空白小室电阻值) ×单层细胞面积。
2.6 内皮细胞渗漏实验细胞模型建立后,在24孔板中加入野黄芩素,终浓度为20、50 μmol·L-1,保护6 h后,于24孔板中加入25 mmol·L-1的高浓度葡萄糖和等渗对照甘露醇孵育24 h,或者加入TNF-α(20 μg·L-1) 孵育18 h,加异硫氰酸荧光素标记葡聚糖(fluorescein isothiocyanate isomer-dextran,FITC-dextran)(终浓度100 mg·L-1)孵育4 h,收集细胞小室以及24孔板内培养基,测荧光值(激发光485±20 nm,发射光538±20 nm)。FITC-dextran渗漏值计算方法如下:渗漏值/%=24孔板内培养基FITC-dextran荧光值/(24孔板内培养基FITC-dextran荧光值+小室内培养基FITC-dextran荧光值)×100%。
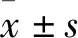
3 结果
3.1 野黄芩素对高糖诱导小胶质细胞后内皮细胞屏障功能的影响如Fig 1 所示,与空白对照组相比,小胶质细胞BV-2用高糖诱导6 h、24 h后,共同培养的细胞小室中内皮细胞bEnd.3的跨膜电阻值明显下降(P<0.01),而给予不同剂量野黄芩素(20、50 μmol·L-1) 预孵育可逆转下降的电阻值(P<0.05,P<0.01),同时等渗对照甘露醇组以及不给予高糖诱导而只与小胶质细胞BV-2共培养组其电阻值均未产生明显变化。如Fig 2所示,与空白对照组相比,小胶质细胞BV-2与内皮细胞bEnd.3共培养时,小胶质细胞BV-2用高糖诱导24 h后,细胞小室中FITC标记葡聚糖穿过内皮细胞bEnd.3构成的单细胞层进入24孔板的渗漏量明显升高(P<0.01),而给予不同剂量的野黄芩素(20、50 μmol·L-1)均可逆转升高的渗漏量(P<0.01),同时等渗对照甘露醇组以及不给高糖诱导而只与小胶质细胞bEnd.3共培养组的渗漏量均未产生明显变化。
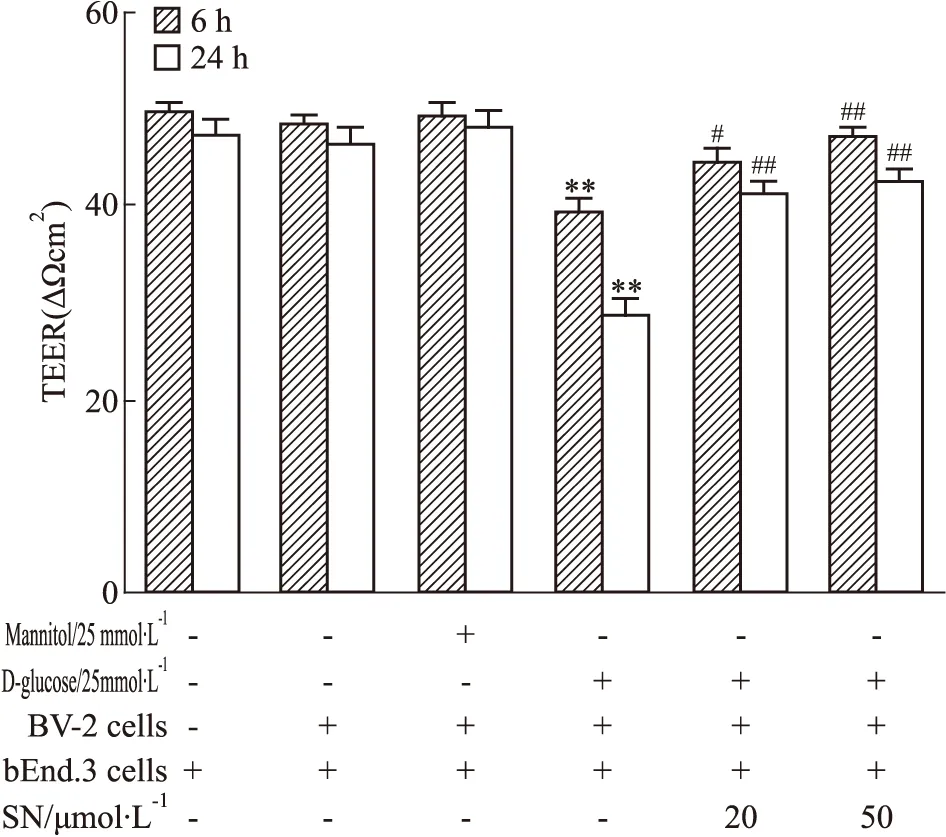
Fig 1 Effect of scutellarin on TEER of cross-endothelial cell bEnd.3 after HG induced microglia **P<0.01 vs control group;#P<0.05,##P<0.01 vs HG group.

Fig 2 Effect of scutellarin on FITC-dextran permeability of bEnd.3 after BV-2 induced by **P<0.01 vs control group;##P<0.01 vs HG group.
3.2 野黄芩素对高糖诱导小胶质细胞上清液中TNF-α含量的影响如Fig 3所示,与空白对照组相比,小胶质细胞BV-2用高糖诱导24 h后,细胞上清液中TNF-α的含量明显增加(P<0.05),而给予不同剂量野黄芩素(20、50 μmol·L-1)可逆转增加的TNF-α含量(P<0.05,P<0.01),同时等渗对照甘露醇组的TNF-α含量未产生明显变化。
3.3 野黄芩素对TNF-α诱导后内皮细胞屏障功能的影响如Fig 4所示,与空白对照组相比,内皮细胞bEnd.3给予TNF-α刺激6 h、18 h后,其跨膜电阻值明显下降(P<0.01),而给予不同浓度的野黄芩素(20、50 μmol·L-1)后均可逆转由TNF-α导致的跨膜电阻值下降(P<0.01)。如Fig 5所示,与空白对照组相比,内皮细胞bEnd.3给予TNF-α刺激18 h后,FITC-dextran渗漏值亦明显升高(P<0.01),而给予野黄芩素(20、50 μmol·L-1)后可抑制其渗漏的增加(P<0.05,P<0.01)。
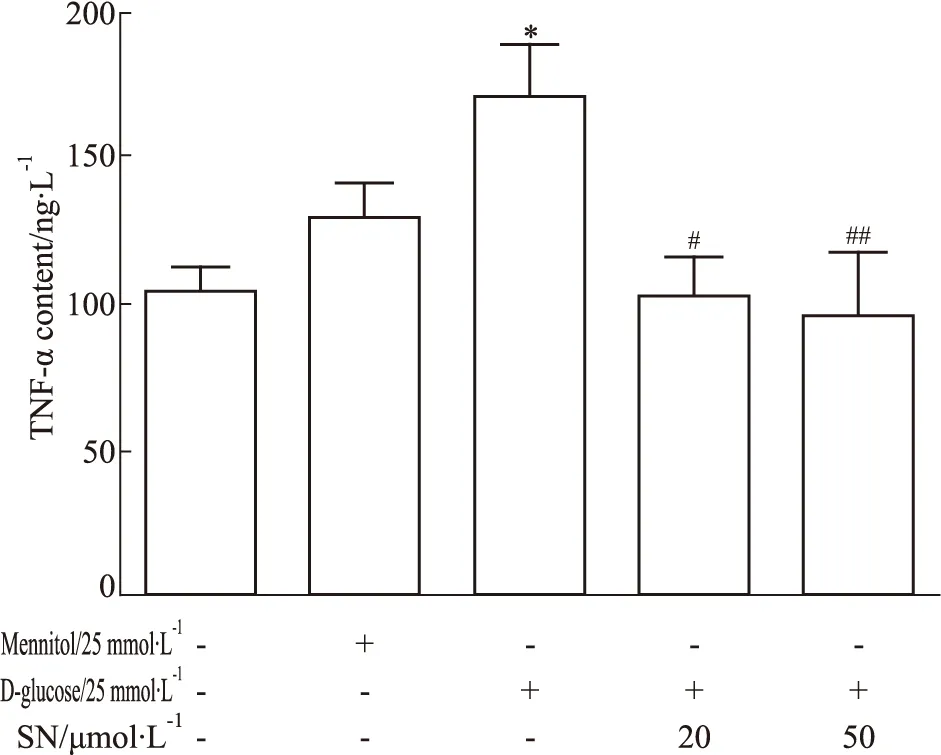
Fig 3 Effect of scutellarin on TNF-α content in supernatant of bEnd.3 induced by *P<0.05 vs control group;#P<0.05,##P<0.01 vs HG group.
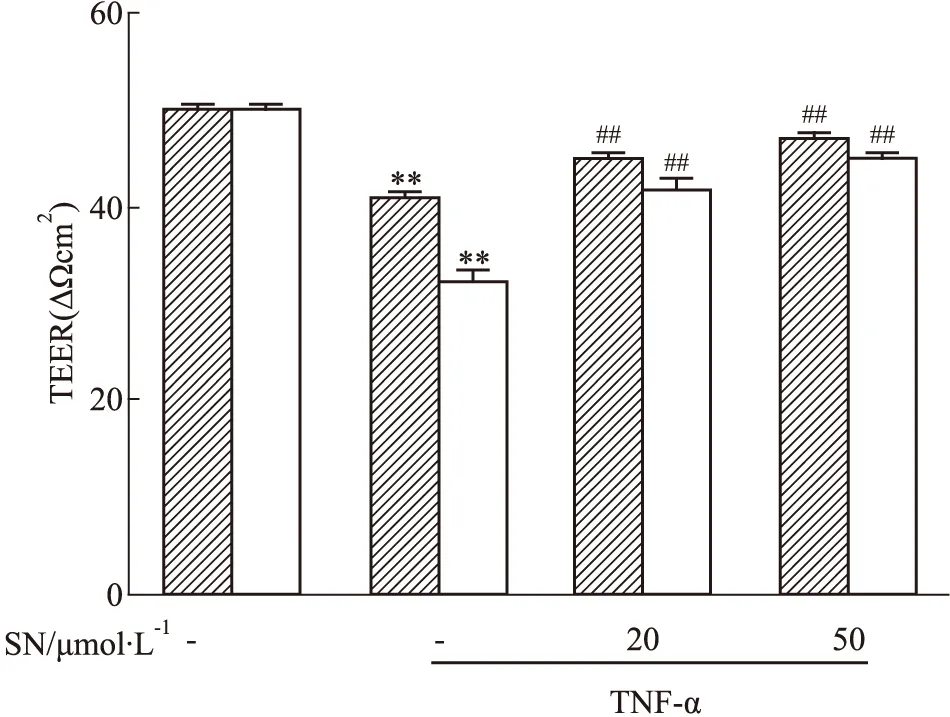
Fig 4 Effect of scutellarin on TEER of bEnd.3 **P<0.01 vs control group;##P<0.01 vs model group.
3.4 野黄芩素对TNF-α诱导后内皮细胞紧密连接蛋白表达的影响如Fig 6所示,与空白对照组相比,内皮细胞bEnd.3给予TNF-α刺激18 h后,其claudin-1、claudin-5和claudin-19的蛋白表达均明显减少(P<0.05),而给予不同浓度的野黄芩素(20、50 μmol·L-1) 后claudin-1、claudin-19的蛋白表达均明显被逆转(P<0.05)。
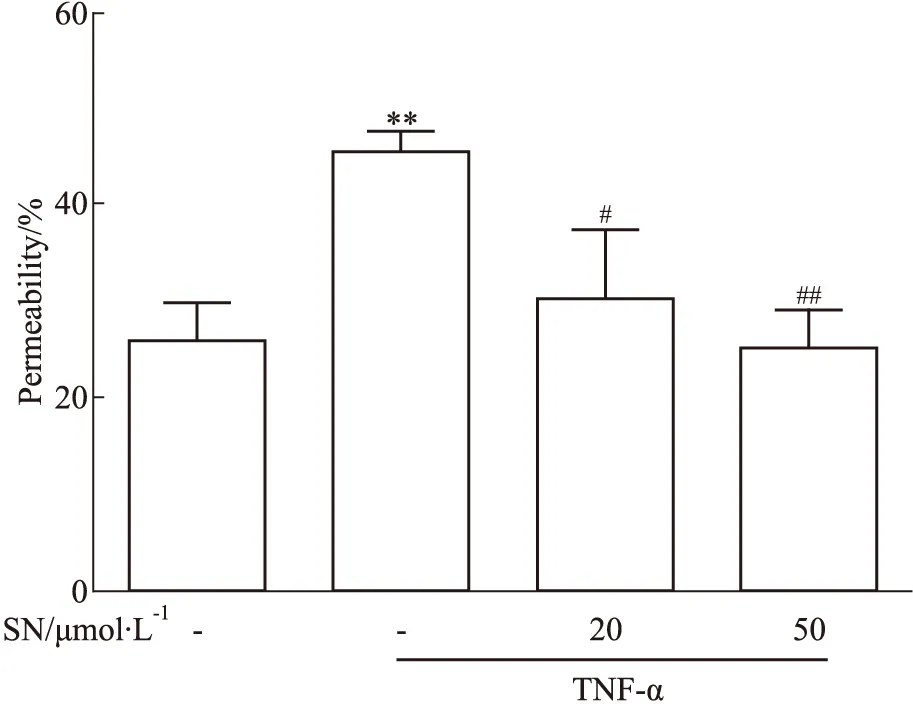
Fig 5 Effect of scutellarin on FITC-dextran permeability of bEnd.3 induced by **P<0.01 vs control group;#P<0.05,##P<0.01 vs model group.

Fig 6 Effect of scutellarin on expression of tight junction protein in bEnd.3 induced by *P<0.05 vs control group;#P<0.05 vs model group.
4 讨论
已有研究表明,糖尿病状态下持续的高血糖会破坏BBB的完整性,增加CNS微血管的通透性,这些改变是引起糖尿病CNS并发症的主要原因之一[11]。目前关于糖尿病如何影响BBB的研究报道并不是很多,其具体机制有待进一步研究。在CNS中,小胶质细胞是长期存在的免疫细胞,据报道其激活与各种CNS疾病(如中风、阿尔茨海默病等) 的发展进程密切相关[12]。已有研究发现在糖尿病状态下,高糖诱导小胶质细胞激活所介导的炎性反应会对血视网膜屏障造成明显的损伤[13],但是否会对BBB也造成损伤尚不清楚。本研究将高糖诱导激活的小胶质细胞同内皮细胞共培养后,采用TEER实验和FITC-dextran渗漏法进行检测,发现高糖诱导活化的小胶质细胞可以在体外对内皮细胞屏障造成明显的损伤,提示糖尿病状态下激活的神经小胶质细胞会导致BBB的破损。进一步研究发现,野黄芩素明显逆转了高糖诱导小胶质细胞活化所介导的BBB损伤。
TNF-α是活化的小胶质细胞释放的主要促炎性细胞因子之一,有报道发现,TNF-α可诱导内皮功能障碍,破坏CNS稳态[14]。本研究发现野黄芩素可抑制体外高糖诱导的小胶质细胞BV-2中促炎性细胞因子TNF-α的释放。进一步研究发现,TNF-α可在体外脑血管内皮细胞bEnd.3上引起内皮细胞屏障的破坏,而野黄芩素能逆转TNF-α诱导的内皮细胞屏障破损。这些结果提示,神经小胶质细胞可以在糖尿病状态下经持续高糖刺激后被诱导激活,释放炎性因子如TNF-α,造成BBB的损伤。野黄芩素既可以抑制高糖诱导的小胶质细胞活化从而降低TNF-α的释放,也可以逆转炎性细胞因子TNF-α所诱导的BBB破损。
TJs蛋白主要由与肌动蛋白细胞骨架相连的跨膜(junctional adhesion molecules,occludin and claudins)和胞质蛋白(zonula occludens-1 and-2)组成,TJs的完整性对维持BBB的正常功能至关重要[15]。已有研究表明,促炎性细胞因子,如TNF-α和IL-1,可引起TJs的改变,并导致BBB损伤[16]。claudin-1、claudin-5和claudin-19是典型的TJs蛋白,在BBB中表达丰富,其表达降低与缺血性脑卒中、阿尔兹海默病的发生有关[17-18]。在本研究中,TNF-α可以诱导claudin-1、claudin-5和claudin-19蛋白在脑血管内皮细胞bEnd.3中表达明显降低,而野黄芩素逆转了claudin-1、claudin-19蛋白表达的降低,但是不能逆转claudin-5蛋白表达的降低。同时TNF-α没有影响脑血管内皮细胞bEnd.3中occludin蛋白的表达,而野黄芩素也对其表达没有任何影响。上述结果提示,野黄芩素在一定程度上可通过逆转TNF-α诱导的TJs蛋白如claudin-1、claudin-19表达的下调,维持BBB的完整性。
总之,本文的研究结果表明,天然产物野黄芩素可以保护BBB免受高糖诱导激活的小胶质细胞所介导的损伤。其作用机制可能是野黄芩素降低了小胶质细胞中TNF-α等促炎性细胞因子的表达,并通过维持TJs的完整性,逆转了促炎性因子TNF-α诱导的BBB损伤。这项研究表明野黄芩素对糖尿病中枢神经系统并发症具有潜在的治疗作用。

