和厚朴酚对TGF-β1诱导的心肌成纤维细胞迁移的影响
谭嘉安,刘英华,张根水,宜 全
(广州医科大学药学院药理教研室,广东 广州 511436)
心肌纤维化(myocardial fibrosis,MF)是指在心肌缺血性损伤、部分外来性异物或全身性疾病的刺激下导致心肌组织发生严重炎症反应甚至坏死后出现心脏修复反应。在心脏受到损伤后伤口愈合时,心肌成纤维细胞及其活化后的肌成纤维细胞起着关键作用:它们产生的纤维化瘢痕取代了受损组织。而纤维化瘢痕组织表现为坚韧缺乏弹性,硬度明显增加,顺应性明显降低。因此可导致心脏的病理变化,例如心律失常、心力衰竭等[1]。受损心肌中细胞外基质(extracellular matrix,ECM)成分的积累是心肌纤维化过程的特点,正常情况下CFs合成与分泌少量纤连蛋白(fibronectin,FN)、Ⅰ-型胶原蛋白(collagen-1,COL-1),维护ECM的稳态。然而,在心脏损伤和应激刺激下,受损心肌会募集免疫细胞并释放大量转录生长因子-β (transcription growth factor-β,TGF-β)[2]。TGF-β1在多种器官和组织的纤维化中表达增加,并在调控细胞进程以及ECM包括胶原、FN等起着重要作用[3-4]。在接受TGF-β信号后,静止的CFs活化并且转变为MFs,表现出加剧的增殖,迁移和收缩能力,以及过度分泌FN和COL-1的能力[5]。活化的CFs还通过产生粘着相关蛋白促使ECM重塑及在胞外堆积[6]。这些变化共同导致了纤维化心脏的病理变化。因此,靶向受损心肌中的ECM成分蛋白的积累有益于缓解或治疗心脏纤维化疾病。
和厚朴酚(honokiol,HKL)提取自中草药厚朴,具有抗肿瘤、抗菌、抗病毒的作用,且还具有抗炎抗氧化等药理作用,能够用于治疗心律失常、心脑缺血/再灌注损伤[7],因此和厚朴酚在治疗心脑血管疾病方面表现出巨大的潜力。
本实验使用TGF-β1处理诱导的心肌成纤维细胞活化迁移,构建体外的心肌纤维化模型[8]。研究和厚朴酚对TGF-β1诱导的大鼠乳鼠心肌成纤维细胞迁移的作用,检测细胞外基质蛋白FN、COL-1表达的影响。为心肌纤维化疾病的药物治疗提供一定的理论依据。
1 材料与方法
1.1 材料
1.1.1实验动物 新生d 1~3的SD大鼠乳鼠,雌雄不限,购自广东省实验动物中心。动物使用许可证号:SYXK(粤)2016-0168。
1.1.2试剂 和厚朴酚(批号:F1904059,纯度≥98%)购于阿拉丁试剂有限公司;DMEM培养基(Gibco);胎牛血清(Gibco);DMSO 、MTT、TGF-β1(批号:0331323)购于Novoprotein公司;Vimentin的一抗购于Santa Crus; GAPDH一抗、辣根过氧化物酶标记的山羊抗兔二抗购于中杉金桥;FN的一抗、COL-1的一抗的一抗均购于武汉三鹰生物技术有限公司;ECL发光液(CST);
1.1.3仪器 三气培养箱(美国Thermo);超净工作台(苏州仪器厂);电子天平(德国BP2215);-80 ℃低温冰箱(美国Thermo);酶标仪(德国Beckmen);荧光正置显微镜(日本Nikon公司);低温高速离心机(德国Hettic);垂直电泳槽、转膜仪(美国Bio-Red公司);自动洗片机(美国Kodak)。
1.2 方法
1.2.1SD乳鼠CFs的提取与培养 全程在无菌操作台中进行,所有器材提前30 min照射紫外消毒。取新生d 1~2的SD乳鼠,酒精清洗3遍移至超净台,倒“T”形打开胸腔,轻轻挤压乳鼠背部令心脏从开口处露出,使用镊子快速取下心脏,使用预冷 HBSS缓冲液清洗干净,然后移至100 mm 培养皿中修剪,并收集心室组织,继续使用HBSS缓冲液冲洗,剪碎直到所有大的心脏组织碎片被分散为止;加入8 mL的HBSS、2 mL的0.25胰酶(控制HBSS ∶胰酶=4 ∶1) ,封口膜封口至4 ℃冰箱消化14~16 h后取出。吸取所有组织液体混合物至15 mL离心管中,加入2 mL血清终止消化;37 ℃水浴复温后,加入25XⅡ型胶原酶置于 37 ℃水浴摇床摇晃45 min;取出,吸取离心管中的混合液到200 目滤网中过滤到50 mL 离心管中,加入适量 L-15 细胞培养液到剩余组织中吹打取上清过滤,确保多数细胞从消化后的组织中解离至细胞悬液。离心(1 000 r·min-1,室温,5 min),弃去上清,加入5 mL 10% FBS的高糖培养基,使用移液枪轻轻吹打混匀,然后均匀接种至100 mm 直径的培养皿中,置 37 ℃,5% CO2培养箱中培养 45 min,小心吸弃皿中液体,更换为10% FBS。此时培养皿中贴壁细胞为心肌成纤维细胞,这个过程为差速贴壁分离。通过传代再差速纯化心肌成纤维细胞。
1.2.2CFs的形态以及纯度鉴定 将差速贴壁分离分离的CFs培养至90%以上进行传代,然后以1.0×104个/皿接种至共聚焦小皿中,24 h后更换10%FBS。在细胞汇合度达到60%时,使用预热的PBS缓冲液洗去培养基,再用4%的多聚甲醛固定20 min。用PBS缓冲液轻轻晃洗4次吸干。1%的曲通破膜30 min,处理然后用PBS缓冲液洗去残余曲通;100 mmol甘氨酸封闭,PBS缓冲液清洗5 min×3次;5% BSA封闭1 h后加入心肌成纤维细胞骨架成分Vimentin(1 ∶500)一抗,4 ℃过夜。d 2取出后使用PBST清洗5 min×4次,室温孵育相应的荧光二抗1 h,后面过程均避光操作。然后用PBST清洗5 min×3次;加入细胞核染液DAPI室温孵育10 min,先用PBST清洗5 min×3次,再用超纯水轻轻晃洗2次;往共聚焦小皿中加入适量的抗淬灭剂,于正置荧光显微镜下分析样本,拍照记录。
1.2.3MTT检测不同浓度的TGF-β1对CFs活力的影响 将处于指数增长期的CFs进行消化传代处理,然后以7×103/孔进行接种至96孔板,放置三气培养箱培养24 h。设置对照组(正常成纤维细胞),TGF-β1组(2.5、5、10、20、40 pg·L-1),培养24 h。每孔加入100 μL用PBS稀释的0.5 g·L-1的MTT溶液,在三气培养箱中孵育3~4 h。从培养箱中取出,可使用0.5 mL规格的注射器小心吸弃孔内培养上清液,每孔加150 μL DMSO,震荡10 min,使孔内紫色结晶物充分溶解。于490 nm处测定吸光度(OD)值。
1.2.4划痕实验检测和厚朴酚对CFs迁移的影响 所有器材均经过紫外消毒30 min。在6孔板背部横着用marker笔画5道直线,大约每道间隔0.5 cm。将处于指数增长期的心肌成纤维进行消化传代处理,然后以5×105/孔均匀接种于6孔板中,放置三气培养箱培养。设置对照组(正常成纤维细胞),模型组(仅加入10 pg·L-1的TGF-β1),给药组(含10 pg·L-1TGF-β1并依次加入1、2.5、5 μmol·L-1的和厚朴酚),对照药组(小檗碱10 μmol·L-1),在0.1%FBS条件下培养,24 h后在正置显微镜下拍照记录。通过比较0 h刮擦面积百分比之间的差异来分析数据。
1.2.5激光共聚焦检测纤连蛋白FN的表达 将差速贴壁分离分离的CFs培养至90%以上进行传代,然后以1.0×104个/皿接种至共聚焦小皿中,培养24 h。设置对照组,模型组(10 pg·L-1的TGF-β1),给药组(TGF-β1+HKL5 μmol·L-1),给药处理24 h后取出。按照“1.2.2”项所述的免疫荧光步骤操作,孵育Vimentin(1 ∶500)、FN(1 ∶400)一抗4 ℃过夜。d 2取出后使用PBST清洗5 min×4次,荧光二抗室温避光孵育45 min,后面步骤参见“1.2.2”。最后加入抗淬灭剂,于正置荧光显微镜下分析样本,拍照记录。
1.2.6Western blot检测相关蛋白的表达 将差速贴壁分离的CFs培养至90%以上进行传代,然后以4.5×105个/皿接种至60 mm培养皿中,24 h后更换10% FBS。待细胞汇合度为75%时进行给药处理,设置分组对照组、模型组(10 pg·L-1TGF-β1)、给药处理组(1、2.5、5 μmol·L-1的和厚朴酚)。放置三气培养箱24 h后取出,预冷的PBS轻轻晃洗3次,使用滤纸吸干残余水分,加入含蛋白酶抑制剂的RIPA裂解液裂解30 min,刮下离心收集上清。使用蛋白定量试剂盒测定待测样品总蛋白浓度,制备蛋白上样液。经过上样-电泳-转膜的过程将蛋白转移至PVDF膜上,使用体积分数为3的BSA室温封闭2 h。孵育一抗,FN(1 ∶500)、COL-1(1 ∶1 000)、GAPDH(1 ∶5 000), 4 ℃孵育过夜。TBST洗膜5 min×3次。室温孵育二抗1 h,TBST洗膜10 min×4次,ECL化学发光法检测。
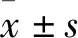
2 结果
2.1 CFs的形态以及纯度从Fig 1可以观察到,大鼠乳鼠心肌成纤维细胞为扁平状不规则的多边形细胞,对多个视野下的细胞使用ImageJ进行细胞计数,统计得到使用差速贴壁分离的得到的细胞中心肌成纤维占0.954 6±0.017 0。

2.2 TGF-β1对CFs增殖的影响如Fig 2所示,与Control组比较,使用不同TGF-β1处理成纤维细胞24 h时,在10 pg·L-1时能够明显促进成纤维细胞增殖,结果差异具有统计学意义(P<0.05),我们采用TGF-β1为10 pg·L-1作为后续实验浓度。

Fig 1 Morphology identification of CFs
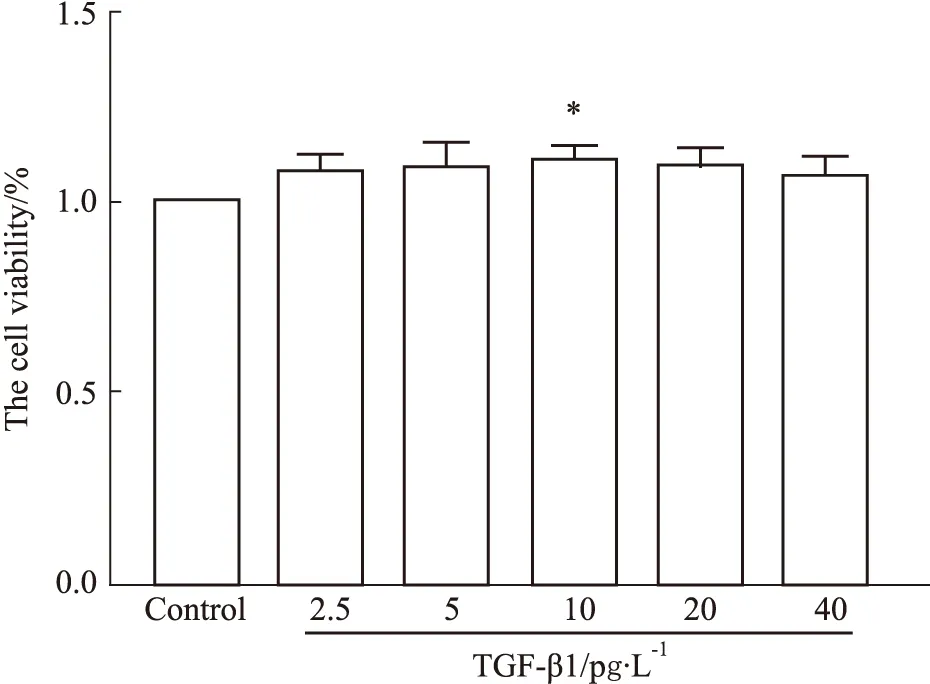
Fig 2 Effect of different concentrations of TGF-β1 on cell activity n=3)*P<0.05 vs control
2.3 HKL对TGF-β1刺激后CFs迁移能力的影响划痕实验中将所有组对应同一个视野下的两个时间点划痕面积进行统计,结果显示,与空白对照组相比,采用TGF-β1处理的成纤维细胞伤口愈合更快(P<0.05);与模型组(TGF-β1)组相比,和厚朴酚能够抑制TGF-β1处理后的伤口愈合速率(P<0.01),即和厚朴酚能够抑制TGF-β1刺激后成纤维细胞迁移能力。
2.4 HKL对TGF-β1刺激后成FN蛋白分泌的影响Fig 4的免疫荧光结果表明,与正常对照组相比,TGF-β1(10 pg·L-1)处理组FN蛋白荧光强度增加,而与TGF-β1组相比,HKL(5 μmol·L-1)组FN蛋白荧光强度减弱,提示和厚朴酚能够抑制TGF-β1刺激后成纤维FN分泌。
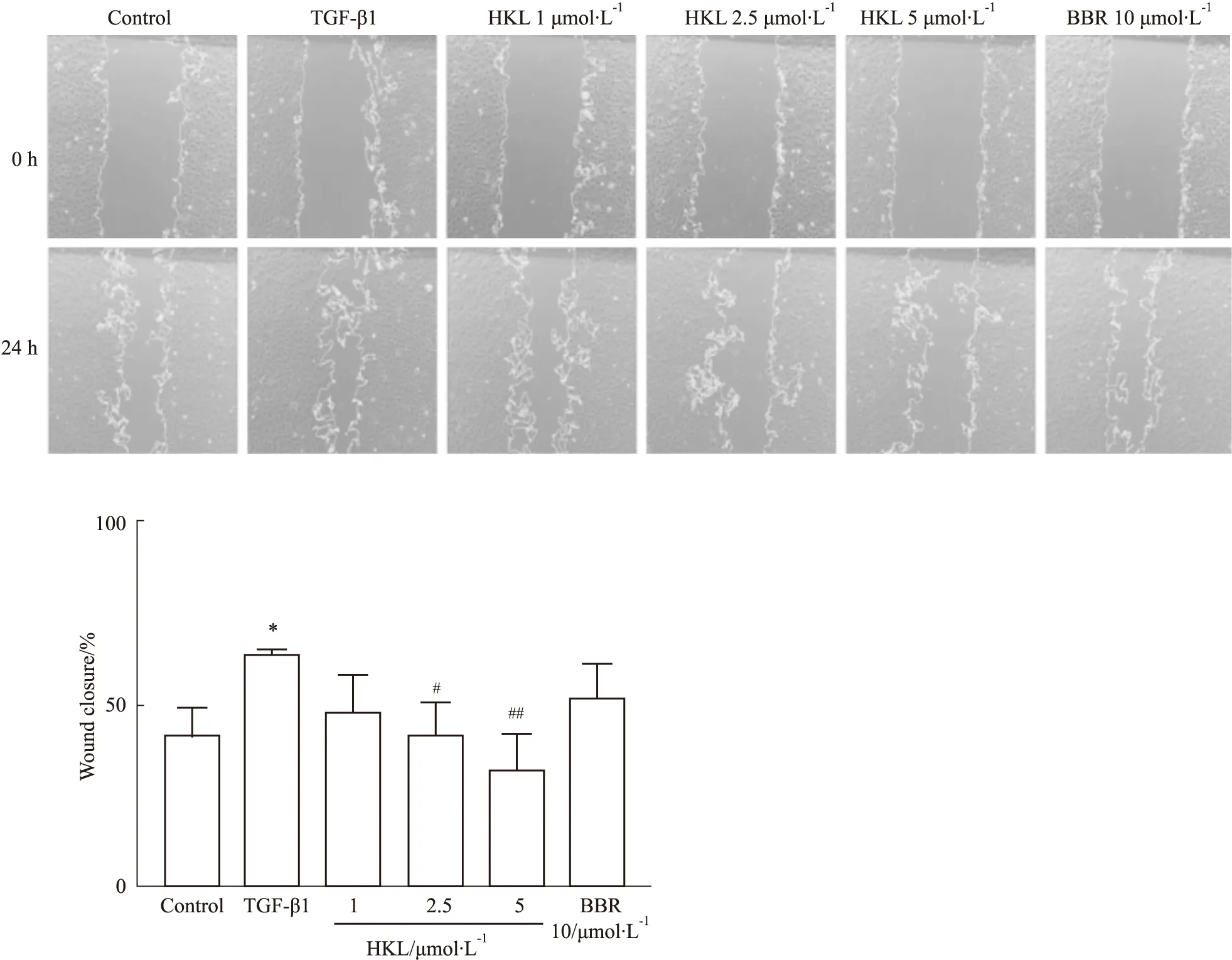
Fig 3 Effect of different concentrations of HKL on CFs migration induced by TGF-β1 n=3)*P<0.05 vs control; #P<0.05, ##P<0.01 vs TGF-β1

Fig 4 Effect of HKL on FN secretion after TGF-β1 stimulation
2.5 CFs对TGF-β1诱导的CFs中FN、COL-1蛋白表达的影响如Fig 5所示,与空白对照组相比,使用TGF-β1处理后FN蛋白表达水平明显增高(P<0.01),给予和厚朴酚处理后,FN蛋白表达水平明显降低(P<0.01)。经TGF-β1处理24 h后COL-1蛋白表达水平升高(P<0.05),给予和厚朴酚处理后能够明显降低COL-1蛋白表达(P<0.01)。
Fig 5 Effect of HKL on expression of FN and COL-1 induced by TGF-β1 n=3 )*P<0.05, **P<0.01 vs control; ##P<0.01 vs TGF-β1
3 讨论
活化的纤维细胞介导的纤维化组织重塑发生在大多数器官中,特别是在硬皮病、动脉粥样硬化、心力衰竭、肝硬化、肾纤维化和许多癌症等主要疾病的末期。当心脏在各种因素诱导下发生纤维化时能够导致心律失常、心功能紊乱、心力衰竭等不良后果。在纤维化过程中,成纤维细胞受到多种细胞因子的刺激后活化,而活化的成纤维细胞是主要的效应细胞。活化的成纤维细胞也称为肌成纤维细胞,是一类高度收缩的细胞类型,其特征是过多的沉积细胞外基质(ECM)蛋白,这也是纤维化发生的特点和标志。纤维化是一个多种信号通路并存的过程,它与转化生长因子β(TGF-β)/Smad信号传导,炎症和氧化应激信号传导,肾素-血管紧张素系统,Wnt/β-catenin信号通路和脂质代谢都有关。其中最经典的是TGF-β/Smad途径,TGF-β/Smad级联反应由三元信号复合物组成,当TGF-β1与转化生长因子β 受体Ⅱ(TGFβRⅡ)相互作用时,TGF-β1受体I被激活,继而磷酸化细胞质介体Smad2和Smad3,并与Smad4形成异源三聚体复合物,然后移位进入细胞核,结合共有序列,并调节基因转录。有文献报导,TGF-β1可以经TGF-β/Smads信号通路参与调节心肌成纤维细胞的增殖、转化、迁移和ECM的产生, TGF-β1是促MF的最主要因素[9]。本研究通过使用TGF-β1刺激心肌成纤维细胞建立心肌纤维化的体外模型,在10 pg·L-1时能够刺激成纤维增殖,同时划痕实验结果表明,在该浓度下成纤维细胞迁移速度增加,当给予和厚朴酚处理后,能够以浓度依赖的抑制成纤维的迁移[10]。在心脏纤维化过程中,心肌梗死等原因诱导成纤维细胞大量增殖,随后迁移到受损部位活化为肌成纤维[11]。当心肌成纤维活化后会分泌FN及COL-1等细胞外基质并沉积在细胞周围,并以此改变肌成纤维的细胞网络微环境,从而影响心脏功能,最终导致心脏纤维化[12]。故抑制受损心脏中的成纤维的迁移和活化,可以改善细胞外基质ECM的分泌沉积。
在我们的实验结果中,使用TGF-β1刺激成纤维细胞后,对FN蛋白进行荧光标记并通过共聚焦显微成像技术观察到,与空白对照组相比,成纤维细胞内外的荧光更强烈,而在使用TGF-β1刺激的同时给予和厚朴酚处理,能够减弱成纤维细胞内外的荧光强度,该结果表明,和厚朴酚能够抑制TGF-β1刺激后FN蛋白的分泌。尽管胶原蛋白是心脏中最丰富的ECM蛋白,但细胞纤连蛋白在心脏纤维化中起关键作用。有文献报道,纤连蛋白能够与整合素、纤维蛋白等细胞表面受体相互作用,在基质组织和细胞-基质相互作用中充当桥接分子,当FN蛋白聚合到细胞外基质中才能使I型胶原蛋白沉积共同介导纤维化过程[13]。最近研究报道,在心力衰竭的体内模型中,抑制FN聚合或心脏成纤维细胞基因表达可减弱MF的病理学特性,并改善不良的心脏重塑和纤维化[6]。同时还有研究表明,二甲双胍能够抑制博来霉素诱导的肺纤维化,机制是抑制胰岛素样生长因子-1介导的FN蛋白、α-SMA、I型和III型胶原的产生进而抑制小鼠肺纤维化[14]。因此,干预细胞FN蛋白的生成和沉积,能够减轻心脏纤维化,改善心脏功能。
为量化和厚朴酚对TGF-β1刺激的成纤维细胞中FN蛋白以及COL-1蛋白表达变化,随后我们使用TGF-β1刺激原代成纤维,并用高中低浓度的和厚朴酚给予治疗。Western blot结果表明,与模型组相比,和厚朴酚能够降低FN、COL-1蛋白的表达水平,这提示和厚朴酚可以减少TGF-β1诱导的CFs细胞外基质蛋白FN和COL-1的分泌与沉积。多项研究表明,和厚朴酚能够抑制多种器官纤维化,他们共同机制可能是通过TGF-β1/SMAD2/3信号通路实现[15]。
综上,我们发现HKL能够减轻TGF-β1诱导的CFs的迁移,抑制成纤维在受损心肌部位的聚集和活化,从而影响FN蛋白、COL-1蛋白的分泌和沉积,最终改善心脏纤维化。因此,和厚朴酚对心肌纤维化过程中抑制FN、COL-1蛋白的沉积作用的发现,将为开发新的抗心肌纤维化药物提供实验参考。

