提高微生态制剂在幼龄反刍动物断奶过程中作用效果的机制探讨
俞少博,王佳堃
(浙江大学奶业科学研究所,浙江杭州 310058)
微生态制剂(Direct Fed Microbials)是一类无致病性,可直接饲喂,且其本身或者其代谢产物对动物机体有积极调控作用的活性微生物[1]。然而,微生态制剂进入瘤胃后,多数情况下无法在瘤胃中有效定植并与已经占据优势地位的瘤胃原住微生物共存,发挥其益生效果[2-3]。而反刍动物在断奶过程中,瘤胃微生物功能和种类均发生显著变化[4-5]。在快速变化的微生物区系中,相对脆弱的相互关系使得外源微生物更易于定植[6]。Dommels 等[7]研究表明,微生态制剂在幼龄反刍动物胃肠道内有效定植并保持代谢活力是其发挥作用的前提。Signorini 等[8]的荟萃分析发现,给犊牛喂食全乳的过程中添加混合产乳酸菌制剂或单菌均有一定的益生效果,这证实幼龄期是微生态制剂干预的适宜期;但该分析也发现,断奶期犊牛只喂食代乳料的条件下,无论是添加单菌还是混菌都没有显著的益生效果,因此微生态制剂在幼龄期的应用同样存在限制因素。为提高微生态制剂的调控效果,本文主要综述近十年来微生态制剂在幼龄反刍动物中的应用现状,分析微生态制剂发挥作用的条件及影响其定植的因素,以新型微生态制剂的研发成果为基础,探讨基因工程技术引入特定底物或者群体响应通路相关基因提高微生态制剂应用效果的可行性。
1 微生态制剂对反刍动物断奶前后生产性能的影响及作用机制探讨
1.1 饲喂微生态制剂对幼龄反刍动物断奶前后生产性能的影响 反刍动物断奶前后,可供饲喂的微生态制剂主要有乳酸杆菌、芽孢杆菌、酵母以及乳酸利用菌等单菌制剂,以及按一定比例混合形成的混菌制剂或添加寡糖底物后形成的合生制剂(表1)[9-16]。饲喂微生态制剂不同程度地提高了幼龄反刍动物断奶前后的日增重和饲料效率,降低了腹泻发生率,并能提高动物个体的采食量等指标。随着相关研究的进一步深入,微生态制剂的可能作用机制也被逐渐揭示。
1.2 饲喂微生态制剂可能提高幼龄反刍动物开食料的利用率 开食料不同于液体饲料,其中含有大量的植物多糖类化合物,如淀粉、纤维素等。Rey 等[17]在犊牛出生后第2 天,就在瘤胃内容物中检测出木聚糖酶和淀粉酶活性,而其瘤胃发酵能力依然低于出生后2 个月的犊牛,微生态制剂仍可能通过促进饲料消化来提高犊牛的生产性能。张志焱等[18]研究发现在羔羊日粮中添加0.1%商用复合微生态制剂(芽孢杆菌、乳酸菌和酵母混合)可以有效提高羔羊断奶后有机物、粗蛋白质和酸性洗涤纤维的消化率。然而,Ishaq 等[19]给刚出生的羔羊直接饲喂分离自美洲麋鹿瘤胃的纤维利用菌(Bacillusspp.和Staphylococcus saprophyticus bovis等),羔羊纤维物质的消化能力并未提高,只提高了饲料转化效率。不同于促进饲料原料降解的微生态制剂,部分微生态制剂则针对瘤胃中二级产物的利用,如乳酸、琥珀酸等。这类二级产物是丙酸生成的主要前体物质,添加利用这些二级产物的微生物可能促进瘤胃丙酸生成[20]。Stein 等[21]给围产期和泌乳早期奶牛添加埃氏巨球菌(Megasphaera elsdenii)后,奶牛瘤胃中乳酸生成丙酸的效率增加,能量供应效率提升。但关于这类乳酸利用菌在反刍动物断奶过程中的应用研究较少,而反刍动物的断奶过程往往面临着与围产期相同的能量负平衡问题,添加埃氏巨球菌等乳酸利用菌来有效利用开食料发酵产生的乳酸转化成丙酸,可能有助于提高肝脏的糖异生过程,缓解能量负平衡。
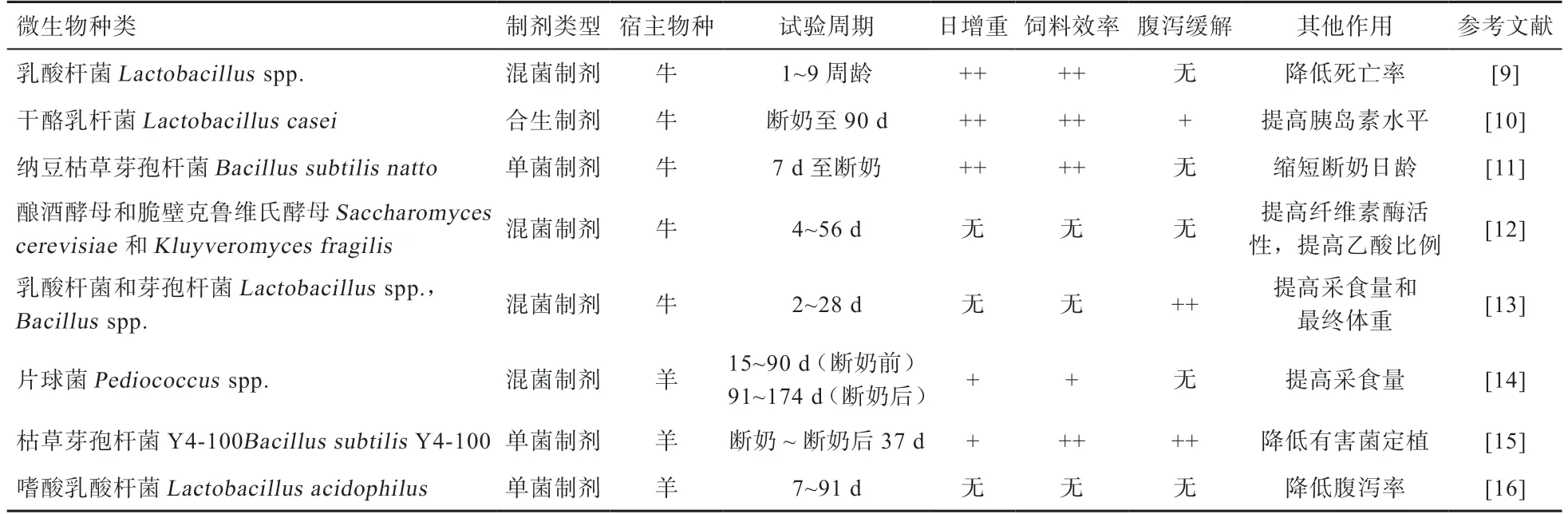
表1 幼龄反刍动物常用的微生态制剂类型
1.3 微生态制剂影响瘤胃中其他功能微生物定植 微生物在幼龄反刍动物瘤胃中的定植是一个复杂的过程,先定植的微生物可能通过消耗氧气、产生二级产物等方式改变现有的瘤胃内环境来影响后续其他微生物的定植[4-5]。微生态制剂可能通过这种方式发挥其对幼龄反刍动物的益生作用。酿酒酵母类微生态制剂能够有效降低瘤胃液的含氧量,从而加快厌氧微生物的定植[22]。0.1%屎肠球菌(Enterococcus faeciumSROD)活菌制剂能够提高体外产气体系中总菌、黄色瘤胃球菌(Ruminococcus flavefaciens)的数量[23]。同时添加布拉迪酵母(Saccharomycescerevisiae boulardiiCNCM I-1079)和嗜酸乳酸杆菌(Lactobacillus acidophilusBT1386)能够提高犊牛瘤胃中丝状杆菌属(Fibrobacter)的相对丰度,而单独添加布拉迪酵母能够提高瘤胃中欧陆森氏菌属(Olsenella)等有益菌的相对丰度[24]。微生态制剂改变幼龄反刍动物消化道微生物的组成,从而提高其断奶前后的生产性能。不仅如此,通过采用微生态制剂对幼龄时期反刍动物进行调控,甚至可能对反刍动物产生长期的作用效果,这为提高成年反刍动物的生产性能提了新的思路。
1.4 饲喂微生态制剂降低肠道病原菌丰度 由于对外界病源菌的抵抗力较弱,病源菌感染导致的腹泻是幼龄反刍动物出生后面临的主要挑战之一,导致腹泻的病原菌主要有大肠杆菌、沙门氏菌以及梭状杆菌等。腹泻会造成营养物质的消化不良,严重的可能导致幼畜死亡[25]。微生态制剂可能降低宿主肠道病原菌的丰度并降低腹泻发生率。体外抑菌试验证实,牛瘤胃源的海氏肠球菌(Enterococcus hirae)能够有效抑制大肠杆菌(Escherichia coliATCC 25922)、铜绿色假单胞菌(Pseudomonas aeruginosaATCC 27853)、伤寒沙门氏菌(Salmonella typhiMTCC 1254)、霍乱弧菌(Vibrio choleraMTCC 3906)和产气肠杆菌(Enterobacter aerogensMTCC 111)的生长[26];牛粪源的乳酸菌(Lactobacillus salivariusC86 和Lactobacillus amylovorusC94)能够有效抑制沙门氏菌(Salmonella entericaspp.)的生长[27]。羔羊的体内试验证实,粪链球菌(Streptococcus faecium)单菌制剂,以及粪链球菌和嗜酸乳杆菌(Lactobacillus acidophilus)、干酪乳杆菌(Lactobacillus casei)、植物乳杆菌(Lactobacillus plantarum)和发酵乳杆菌(Lactobacillus fermentum)的混合制剂可以有效降低大肠杆菌O157:H7(Escherichia coliO157:H7)攻毒羔羊粪便中致病菌的数量[28];犊牛的体内试验同样发现,饲喂乳酸杆菌(Lactobacillusspp.)和芽孢杆菌(Bacillusspp.)混菌制剂的抗腹泻效果优于同期试验的抗生素组,因此微生态制剂可能作为抗生素替代物应用于反刍动物生产[29]。病原菌感染会引起幼龄反刍动物的免疫应答和炎症反应,从而影响共生微生物与宿主的相互关系。微生态制剂的免疫调节作用可能成为后续菌-宿主相互关系研究的重要手段。
2 影响微生物定植及其作用效果的可能因素
2.1 幼龄反刍动物的瘤胃环境 反刍动物在断奶过程中,瘤胃微生物逐渐从以消化简单碳水化合物为主,过渡到以消化复合碳水化合物为主,定植的主要类群则从兼性厌氧菌转变为严格厌氧菌[4-5]。因此,越来越多的研究者认为幼龄反刍动物的胃肠道微生物区系相对简单,提供了一个合适的调控窗口期[6]。但表1 中的微生态制剂的应用效果并不一致。近期Yohe 等[30]报道,犊牛出生后口服埃氏巨球菌制剂并不能使这一微生物在犊牛瘤胃中成功定植,从而不能发挥预想的作用。因此,微生态制剂中的微生物进入幼龄反刍动物的瘤胃之后如何生存、面临什么样的竞争、是否会随着大量的液体饲料被排出等未知的可能性都可能决定该微生物能否在瘤胃中有效定植。而相关的研究甚少且仍处于起步阶段。此外,幼龄反刍动物出生后不久没有开始摄入固体饲料,瘤胃中缺乏微生物定植所需要的底物条件,而测序的结果显示,出生后极短的时间内,部分纤维利用菌即在瘤胃中定植[31]。幼龄反刍动物瘤胃中底物的缺乏和其他早期定植微生物的竞争同样可能对具有相似功能的外源微生物的定植产生阻碍,这与原先所设想的有别于成年瘤胃系统的一种菌群组成相对简单、可塑性强的环境不完全符合。因此,进行微生态制剂干预的时间点尤其重要,既要保证足够的饲料底物供应,又要保证相对简单的瘤胃微生物组成,这可能是后续研究的关键。
2.2 微生态制剂的自身特性 微生物生态学中,环境中可利用的剩余资源和微生物与周围环境及其他微生物之间的相互关系共同决定该微生物能否在进入新环境之后生存[32]。结合人类肠道中的相关研究,如何选择合适种类的微生态制剂可能决定了该微生态制剂能否在幼龄反刍动物的胃肠道中成功定植并发挥作用(表2)。研究者们在使用微生态制剂进行早期调控时应尽可能考虑受体动物的胃肠道环境条件、微生态制剂的来源(供体动物)、制剂菌种之间的相互关系以及微生态制剂的环境适应性等不同因素,根据已知条件选择合适的微生态制剂从而提高其作用的发挥效率。
3 使用特殊微生物及其制剂提高活性微生物定植概率和作用效果
3.1 底物定量调控 利用底物调控微生物在动物胃肠道内的丰度可能是一种快速有效的调控方式。寡糖类化合物与微生物联合制备的合生制剂可成功让芽孢杆菌在犊牛肠道中定植49 d[38]。采用一种小鼠肠道中不存在的“紫菜多糖”,与编码该多糖降解基因的工程拟杆菌(Bacteroides plebeiusDSM 17135)联合,研究者成功地通过胃肠道中紫菜多糖的浓度调控了该工程拟杆菌在小鼠肠道中的丰度[34]。而且相比于长期饲喂含紫菜多糖的饲料,间歇性饲喂更能让该工程拟杆菌在小鼠肠道中长期定植[39]。随着酶工程技术的发展,通过在已有的微生物菌株上编码特定的底物利用基因,从而提高微生物的竞争能力已经成为可能,但这些特种工程菌在反刍动物中的研究应用还较少。在口服引入新型微生态制剂的同时,适当添加一些仅被目标微生物利用的底物或者间歇性饲喂含有这一底物的饲料,可以有效提高微生物进入胃肠道之后的竞争力,从而提高成功定植的概率。

表2 生态学概念、影响微生态制剂定植的可能因素及潜在微生态制剂的选择
3.2 群体响应(Quorum Sensing)调控 群体响应是微生物的重要生长机制,并与生物膜的形成息息相关,其通过一系列信号分子的传导,刺激下游基因的表达,同时产生更多的信号分子,形成链式反应,继续刺激更多的微生物增殖,其中信号分子主要包括高丝氨酸内酯类化合物以及乳酸链球菌素(Nisin 和Lactococcin A)等细菌素[40]。在早期试验中,研究者检测到体外培养的瘤胃微生物(如溶纤维丁酸弧菌和普雷沃式菌属)的培养物中存在AI-2(Autoinducer-2)群体响应的信号分子,其中普雷沃式菌中也检测到S-核糖高半胱氨酸裂解酶基因(luxS)的同源基因序列[41]。然而,近期在山羊瘤胃的体内试验中却无法检测到相关的活性信号分子,只能检测到luxS的同源基因[42]。尽管瘤胃内天然存在的群体响应需要后续的试验进一步验证,但是相关基因的存在至少能够说明群体响应在瘤胃微生物的相互关系中发挥一定的作用。Kong 等[43]通过在乳酸菌中编码转入完整的Nisin 增殖信号通路,可以让微生物的链式反应促进下游同种微生物的增殖,大大增加乳酸菌的生长速度;而且用同样的方法在体外构建的代表多种菌-菌互作关系的不同类型的工程菌,可用于构建特殊的微生物群体并进行整体移植来提高定植的效率。而Miyazaki 等[44]报道了一些病原菌也会通过群体响应来形成生物膜而感染机体,部分乳酸菌的引入也可能会产生信号分子,意外地促进大肠杆菌等病原菌的生物膜形成,这反而不利于发挥所预想的益生作用。针对这种情况,Zhou 等[45]在鱼肠引入能够产生降解对应信号分子的酶的微生物来终止群体响应,最终抑制病原菌的增殖。饲喂特定的微生物,同时外源添加群体响应的信号分子促进有益微生物的增殖,这类微生态制剂可能在反刍动物生产中具有特殊的应用价值。但是在使用过程中选择合适的信号通路及信号分子对于能否实现既定效果至关重要,亟待后续研究者针对反刍动物胃肠道中存在的群体响应机制进行研究。
3.3 瘤胃微生物移植 相比于外源微生物,原本来自于瘤胃中的微生物理论上更适合在同一物种的瘤胃中定植,因此将成年反刍动物的瘤胃液移植给同种幼龄动物是一种非常直接且高效的试验方法。在羔羊出生后28 d开始口腔灌服新鲜或者冻干后的母羊瘤胃液都能显著提高移植后羔羊1 周和28~84 日龄的平均日增重[36]。而在犊牛的试验中,灌服新鲜、冻干、高压灭菌或者离心之后的瘤胃上清液都能降低犊牛的腹泻率[46]。不仅如此,成年动物的瘤胃也是一个高效的训练发酵固体饲料的微生物容器,通过在供体的饲料中添加与开食料相同的饲料原料,在受体羔羊饲喂开食料的同时,移植来自供体羊的瘤胃液,可能是一种更有效的瘤胃微生物移植方法[47]。然而,尽管在表观上观测到了瘤胃微生物移植的积极作用,但是移植物中残余的细胞组分、挥发性脂肪酸等都会对最终结果的解释造成偏差,研究者还未完全确定这些瘤胃液移植物中具体哪一类微生物能被成功移植进入受体的瘤胃中定植并发挥作用。来自供体的“成熟”瘤胃液作为一种复杂的微生态制剂,其中存在着许多成年瘤胃微生物区系所包含的菌-菌互作关系,配合开食料的采食,瘤胃中的微生物定植过程可能会被“重新定向”,具有巨大的研究和应用价值。
4 小 结
口服微生态制剂是调控反刍动物胃肠道微生物的重要手段,虽然某些微生态制剂可以有效提高反刍动物的生产性能并降低健康风险,但无效的应用结果也层出不穷,有些即使有效也并不持久。总体上,微生态制剂在幼龄反刍动物中的应用效果优于成年反刍动物,但是也存在调控后无效的可能性。微生物在胃肠道中成功定植与否是其发挥作用的首要前提,而定植受到宿主基因、底物等多种因素的影响。关于活性微生物在幼龄反刍动物胃肠道中定植的情况,国内外的研究较少,因此,需要后续的研究者针对几个关键方向展开研究:①活性微生物进入幼龄反刍动物瘤胃后的丰度变化过程;②幼龄反刍动物瘤胃内可利用底物与活性微生物的相互关系;③瘤胃微生物与外源活性微生物之间的互作。随着这些关键的研究基础越来越扎实,可以有效结合生态学理论,根据不同的受体特性及其胃肠道环境条件设计不同功能的工程益生菌,并通过相应的手段调控微生物的增殖,从而提高微生态制剂的调控效果,最终为生产者提供切实有效的微生态制剂产品。

