甲状腺乳头状癌组织中p-Akt及VEGF-C的表达及临床意义
郭灵敏 冯伟兆 李林株

[摘要] 目的 探讨甲状腺乳头状癌(papillary thyroid carcinoma)组织磷酸化蛋白激酶B(p-Akt)、血管内皮细胞生长因子-C(VEGF-C)表达水平,及其与甲状腺乳头状癌临床病理特征和颈部淋巴结转移的关系。 方法 选取我院2012年1月~2018年12月的甲状腺乳头状癌病理标本70例(研究组),另选取正常甲状腺组织31例(对照组),应用免疫组化SP法测定p-Akt、VEGF-C、D2-40在两组中的表达情况,并分析其与临床病理的关系。 结果 甲状腺乳头状癌组织中p-Akt、VEGF-C、D2-40(MLVD)的阳性表达率分别为60.0%、66.0%、(10.37±2.61),均显著高于正常甲状腺组织的9.7%、6%、(3.08±0.93)(P<0.01)。p-Akt、VEGF-C在甲状腺乳头状癌组织的表达和临床分期、颈部淋巴结转移及MLVD有关,且差异有统计学意义(P<0.05),与肿瘤大小、年龄及性别无关,差异无统计学意义(P>0.05)。甲状腺乳头状癌组织中p-Akt、VEGF-C蛋白表达水平呈正相关(r=0.455,P<0.05),有颈部淋巴结转移患者的MLVD显著高于无颈部淋巴结转移患者,差异有统计学意义(P<0.01)。 结论 甲状腺乳头状癌组织中p-Akt、VEGF-C呈过表达状态,共同参与淋巴结的侵袭与转移,两个通路可能存在相关性,阻断PI3K/Akt通路有望为甲状腺乳头状癌的靶向治疗提供一种新的思路。
[关键词] 甲状腺乳头状癌;血管内皮细胞生长因子-C;磷酸化蛋白激酶B;淋巴结转移
[中圖分类号] R736.1 [文献标识码] A [文章编号] 1673-9701(2020)26-0012-04
[Abstract] Objective To investigate the expression levels of phosphorylated protein kinase B(P-PKB, also p-Akt) and vascular endothelial growth factor-C(VEGF-C) in papillary thyroid carcinoma tissues, and their relationships with clinicopathological features of papillary thyroid carcinoma and cervical lymph node metastasis. Methods 70 pathological specimens of papillary thyroid carcinoma in our hospital from January 2012 to December 2018 were selected as the study group and another 31 cases of normal thyroid tissues were selected as the control group. The expressions of p-Akt, VEGF-C and D2-40 in the two groups were tested by immunohistochemical SP method, and the relationships with clinical pathology were analyzed. Results The positive expression rates of p-Akt, VEGF-C and D2-40(MLVD) in papillary thyroid carcinoma tissues were 60.0%, 66.0% and(10.37±2.61), respectively, which were significantly higher than 9.7%, 6.0% and(3.08±0.93) in normal thyroid tissues(P<0.01). The expressions of p-Akt and VEGF-C in papillary thyroid carcinoma tissues were related to clinical stage, cervical lymph node metastasis and MLVD, with statistically significant differences(P<0.05), but not related to tumor size, age and gender, and the differences were statistically insignificant(P>0.05). The protein expression levels of p-Akt and VEGF-C in papillary thyroid carcinoma tissues were positively correlated(r=0.455, P<0.05). The MLVD of the patients with cervical lymph node metastasis was significantly higher than that of the patients without cervical lymph node metastasis, and the difference was statistically significant(P<0.01). Conclusion P-Akt and VEGF-C were over-expressed in papillary thyroid carcinoma tissues, and they were jointly involved in the invasion and metastasis of lymph nodes. There may be correlation between the two pathways, and blocking PI3K/Akt pathway is expected to provide a new idea for targeted treatment of papillary thyroid carcinoma.
[Key words] Papillary thyroid carcinoma; Vascular endothelial growth factor-C; Phosphorylated protein kinase B; Lymph node metastasis
甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是甲状腺癌中最多见的组织类型[1],尽管生物学行为良好,恶性程度不高,但由于周围区域富含淋巴结,早期便可淋巴转移而影响长期生存,提示临床可以增大手术清扫范围,但由于缺少客观指标的支持,手术医生对是否可淋巴结清扫一直是持有争论的,故与甲状腺乳头状癌起病、侵袭和转移有关的因素成为近些年研究的焦点。PI3K/Akt信号传导通路在肿瘤细胞生长、侵袭等步骤起着重要作用[2],而磷酸化蛋白激酶B(phosphorylated protein kinase B,p-Akt)作为一种胞质信号传导蛋白,在通路中扮演关键的效应因子。血管内皮细胞生长因子-C(vascular endothelial growth factor C,VEGF-C)是第一个被研究的淋巴管生成促进因子,关系到甲状腺乳头状癌的淋巴转移[3]。研究肿瘤组织分泌淋巴管生长因子的始发因素报道不多,且p-Akt与VEGF-C两者的关系对侵袭、淋巴转移的影响在PTC更是甚少,因而本研究采用免疫组织化学法检测PTC组织中p-Akt与VEGF-C蛋白的表达,旨在分析二者在PTC进展中的变化规律及意义,同时检测微淋巴管密度(micro lymphatic vessel density,MLVD),讨论与淋巴转移的相关性,现报道如下。
1 资料与方法
1.1 一般资料
选取我院2012年1月~2018年12月70例根治术切除PTC标本作为研究组。患者年龄20~74岁,中位年龄42岁;男20例,女50例;颈部淋巴结转移25例,无转移45例;临床病理分期Ⅰ~Ⅱ期48例,Ⅲ~Ⅳ期22例。另选取31例因甲状腺良性疾病行手术切除患者的正常甲状腺(normal thyroid,NT)组织作对照组,患者年龄18~77岁,中位年龄38岁;男7例,女24例。两组一般情况比较差异无统计学意义(P均>0.05),具有可比性。本研究经我院伦理委员会批准,病患均签署知情同意书。
1.2 纳入及排除标准
纳入标准:据2017年修订的第二版《NCCN甲状腺肿瘤指南》[4]为参考,术前经细针穿刺或术中冰冻诊断为PTC,且经根治术后病理诊断一致。排除标准:①术前放疗或化疗;②仅细针穿刺细胞诊断无术后诊断;③未行根治手术的标本;④病历不完整者。
1.3 方法
所有手术标本均通过10%甲醛固定、脱水包埋、4 μm厚度连续切片后进行免疫组化SP三步法染色,着色流程按商品规范进行,常规脱蜡水化,EDTA缓冲液(pH 9.0)95℃下进行抗原热修复,3%过氧化氢阻断剂阻断内源性过氧化物酶,加抗体,经DAB显色后,苏木素复染,中性树胶封片。p-Akt兔抗人多克隆抗体购于美国Cell Signaling公司,VEGF-C兔抗人多克隆抗体、D2-40鼠抗人单克隆抗体、S-P法试剂盒均来源福州迈新生物公司,DAB显色剂购于丹麦Dako公司,采用试剂包提供的阳性组织作为阳性对照,以PBS缓冲液替代一抗作为阴性对照。
1.4 观察指标
p-Akt及VEGF-C以胞浆呈黄色为阳性。在病变典型区域连续阅览10个高倍视野(×400)计1000个肿瘤细胞,并计算肿瘤细胞的平均阳性率,采用双评分半定量计分法[5]判断着色结果:以多数细胞的着色情况为指标评分,无色为0分,浅黄色1分,棕黄色2分,棕褐色3分;陽性率≤5%记0分,6%~25%记1分,26%~50%记2分,≥51%记3分。两评分乘积≥3分为阳性。D2-40为胞浆和(或)胞膜呈黄色为阳,MLVD计算依据Choi等[6]方法,选取5个脉管高密度的视野,用高倍(×200)计算每个视野中的微淋巴管目,取均值。微淋巴管的判定标准:任何被染成黄色的内皮细胞或簇,或条索状管状的细胞团,均作为一个微淋巴管。
1.5 统计学方法
采用SPSS17.0统计软件分析,计数资料比较采用χ2检验,计量资料以均数±标准差(x±s)表示,两组独立样本计量资料比较采用t检验,计量资料相关性分析采用Pearson相关,计数资料相关性分析采用Spearman相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 p-Akt、VEGF-C和D2-40在PTC及正常甲状腺组织中表达特点及差异
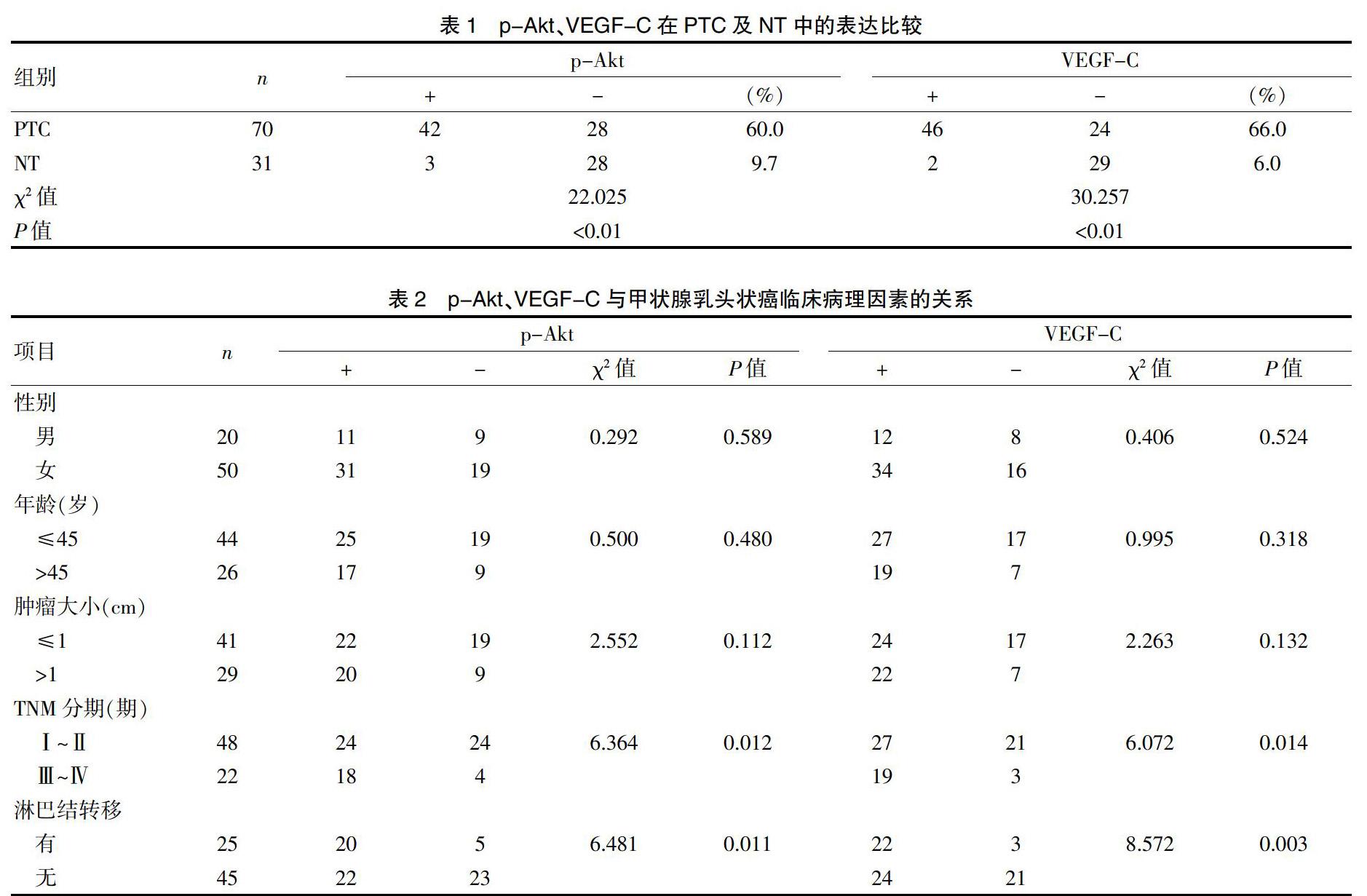
研究组p-Akt、VEGF-C胞浆着色,特别是在肿瘤的外围区域及坏死周边细胞表达多,对照组多阴性,且仅为散在弱阳着色。PTC组织中p-Akt和VEGF-C的阳性表达率分别为60.0%和66.0%,显著高于正常组织的9.7%和6.0%,差异有统计学意义(P均<0.01)(表1)。D2-40多表达在肿瘤周围的脉管,在肿瘤中央的脉管较少表达,可能是受肿瘤的物理挤压等缘由[7],PTC的MLVD为(10.37±2.61)明显高于正常甲状腺的(3.08±0.93),差异有统计学意义(t=15.097,P<0.01)。
2.2 p-Akt、VEGF-C与甲状腺乳头状癌临床病理因素的关系
p-Akt、VEGF-C阳性表达与患者的TNM分期及颈部淋巴结转移有关,差异有统计学意义(P<0.05),而与性别、年龄、肿瘤大小无相关性(P>0.05)(表2)。
2.3 甲状腺乳头状癌中p-Akt、VEGF-C与MLVD的相关性
42例p-Akt阳性表达的甲状腺乳头状癌组织MLVD为(11.79±3.11),28例p-Akt阴性表达的MLVD为(7.01±1.81),p-Akt阳性表达与MLVD呈正相关(r=0.523,P<0.05)。46例VEGF-C阳性表达的甲状腺乳头状癌组织MLVD为(12.58±3.17),24例VEGF-C阴性表达的MLVD为(6.97±1.75),VEGF-C阳性表达与MLVD呈正相关(r=0.556,P<0.01)。
2.4 甲状腺乳头状癌中p-Akt、VEGF-C的相关性
经Spearman相关分析,p-Akt、VEGF-C蛋白表达水平呈正相关(r=0.455,P<0.05),见表3。
2.5 甲状腺乳头状癌中MLVD与淋巴结转移的关系
25例有颈部淋巴结转移的MLVD为(16.56±3.93),45例无颈部淋巴结转移的MLVD为(7.11±1.69),两者比较,差异有统计学意义(t=14.022,P<0.01)。
3 讨论
甲状腺癌的发病率相对来说较高,且每年的发生率都在增长,作为研究一种主要涉及多个癌基因且抑癌基因失活的病变,遗传信息的突变与缺失、通路中各信号蛋白的异常可以表达在甲状腺癌的起始、进展及侵犯能力转移过程中扮演着非常重要的作用,尽管在国内甲状腺乳头状癌患者5年的生存率有90%以上,但因为较高的局部和远处转移率,肿瘤治疗后复发可能是影响预后产生不良的首要原因。
PI3K/Akt信号转导通路广泛存在于人体的各类细胞中,主要是调控细胞增长的一个关键信号,可用于激发生存信号,从而保持人体细胞的生长。在通路中Akt作为一个重要节段而被重视,在PI3K通路中,信号激活后所产生的蛋白与Akt的PH区结合,被磷酸化为具有磷酸激酶活性的p-Akt,所以p-Akt数量的增多可以作为信号传导处于正向作用的激活标志,通过激活Bcl-2家族、eNOS、NF-κB、mTOR、S6蛋白激酶等下游靶蛋白,或者磷酸化凋亡调节蛋白从而阻止细胞的凋亡来反向发挥激活作用[8],并且促进脉管生成和扩张,加速了肿瘤细胞的侵犯转移。VEGF-C已在多个研究中明确是一种主要的淋巴管生长促进因子,在许多不同组织来源的肿瘤细胞中能分泌VEGF-C,在容易通过淋巴管发生转移的肿瘤中发现VEGF-CmRNA转录的发生及蛋白的表达明显是高于通过新生血管转移的[9]。淋巴管内皮细胞可表达受体VEGFR-3,VEGF-C可与VEGFR-3受体结合形成二聚反应活化,并启动介导MAPK信号传导,从而促进淋巴管内皮细胞的增生,并增加淋巴管内皮细胞及基底膜的通透性,活化细胞骨架Paxillin蛋白,从而加速脉管内皮细胞的变形及转移,最终影响淋巴管的形成和性状,肿瘤细胞便通过结构和性状均不完整的新生微淋巴管浸润而侵入淋巴系统并发生转移,还可以依靠各种细胞因子的分泌来改变局部微环境等方式,使肿瘤细胞转移后更有可能在淋巴系统中生存[10]。D2-40是近些年发现的一种强特异性和高敏感性的淋巴管内皮细胞标志[11],通过D2-40染色来统计MLVD,在肿瘤新生微淋巴管的量化研究中是一种实用的方法,肿瘤细胞的淋巴结转移不可缺少的一个因素就是微淋巴管的产生,因此可以将MLVD来作为肿瘤刺激淋巴管生成能力的标识。
本研究发现,研究组中p-Akt及VEGF-C的阳性表达率明显高于对照组,提示p-Akt及VEGF-C主要存在肿瘤组织细胞中,可作为反映PTC的标志物。在与临床病理的特征中,p-Akt及VEGF-C与肿瘤大小、患者年龄和性别无关,而与肿瘤的TNM分期以及颈部淋巴结转移相关,显示出明显的淋巴结侵犯性;此外肿瘤组织p-Akt及VEGF-C的表达与MLVD均呈相关性,提示p-Akt及VEGF-C的过度表达导致肿瘤中微淋巴管的新生;在淋巴结转移组中MLVD明显高于无淋巴结转移组。以上结果表明二者的过度表达临床可以作为推测肿瘤淋巴结转移及预后不良评测的重要指标。本研究还发现,甲状腺PTC组织p-Akt、VEGF-C蛋白表达水平具有相关性,提示p-Akt可增加VEGF-C的表达。p-Akt通过Akt信号通路的激活得以产生,VEGF-C则通过MAPK信号通路来表达,說明两者的通路可能具有相关,存在Akt/VEGF-C通路,p-Akt的过度表达一方面推动肿瘤细胞的增生,或抑制肿瘤细胞的凋亡;再一方面促进VEGF-C的相关基因启动子的活力来加速表达[12],导致肿瘤微淋巴管新生,管腔扩大,管壁基底膜通透率增加,方便肿瘤细胞游走侵袭进入脉管而淋巴结转移,并向远处扩张。其他相关研究同样显示,PI3K/Akt与VEGF通路是有协同作用存在关联的[13,14],但其具体分子机制有待更深层的研究。两通路相互协同共同作用PTC发生早期浸润及转移,提示阻断两信号传导通路对治疗有利,Wortmannin(渥曼青霉素)属经典的PI3K/Akt信号传导途径抑制剂,其主要抑制PI3K的催化亚基p110的激酶活性来阻止下游的传导,抑制瘤组织增长及脉管的形成[15]。也有研究显示,通过内含子MicroRNAs-27b抑制VEGF-C蛋白可降低淋巴结转移[16],而淋巴结受累则影响着患者临床预后,伴有淋巴结受累的PTC患者术后易复发[17]。因此,笔者考虑探讨任何疾病包括PTC的抗转移机制和处理方法将是未来有针对性研究的重点,对于改善病变的后果,改善患者的预后具有重要的临床意义。然而,由于肿瘤的产生内部关系复杂,各个通路间息息相关,所以现在研究多只能局限于个别简单的靶点治疗。因此,若在这两个通路传导途径抑制剂能组合使用,则能更高效地阻碍肿瘤的快速生长,当然也争取寻求更有效的、强的肿瘤特异性靶向药物疗法。
总之,在甲状腺PTC患者的标本中VEGF-C、p-Akt这两个蛋白表现出超常的表达能力,早期过程便在淋巴管转移起重要影响,作为新的治疗手段和方法,针对性的阻断这两个蛋白产生的过程是可行的,同时联合其他检测手段比如触诊、B超等能更准确地评估淋巴结是否处于病变的状态,有利于临床制定个性化的手术方案。
[参考文献]
[1] 王晓庆,魏玮,魏玺,等.甲状腺乳头状癌的超声表现及其与颈部中央区淋巴结转移的关系[J].中华肿瘤杂志,2018, 40(3):196-200.
[2] Cai J,Xu L,Tang H,et al.The Role of the PTEN/PI3K/Akt pathway on prognosis in epithelial ovarian cancer:A Meta-analysis[J].0ncologist,2014,19(5):528-535.
[3] 栾宁,王雪峰.VEGF-C与肿瘤转移的研究进展[J].现代肿瘤医学,2009,17(9):1805-1807.
[4] 郑向前,侯秀坤,高明.2017年第二版NCCN甲状腺肿瘤指南解读[J].中国肿瘤临床,2018,45(1):14-17.
[5] 许良中,杨文涛.免疫组化反应结果的判定[J].中国癌症杂志,1996,6(4):229-231.
[6] Choi WWL,Lewis MM,Lawson D,et a1.Angiogenic and lymphangiogenic microvessel density in breast carcinoma:Correlation with clinicopathologic parameters and VEGF-family gene expression[J].Mod Pathol,2005,18(1):143-152.
[7] Nagamine M,Okumura T,Tanno S,et a1.PPAR gamma ligand-induced apoptosis through a p53-dependent mech-anism in human gastric cancer cells[J].Cancer Sci,2003, 94(4):338-343.
[8] Wu DD,Tian WK,Li JM,et al.Peptide P11 suppresses the growth of human thyroid carcinoma by inhibiting the PI3K/AKT/mTOR signaling pathway[J].Molecular Biology Reports,2019,46(3):2665-2678.
[9] Li G,Dong T,Yang D,et al.Progranulin promotes lymphangiogenesis through VEGF-C and is an independent risk factor in human esophageal cancers[J].Hum Pathol,2018,75:116-124.
[10] He Y,Rajantie I,Pajusola K,et al.Vascular endothelial cell growth factor receptor 3-mediated activation of lymphatic endothelium is crucial for tumor cell entry and spread via lymphatic vessels[J].Cancer Res,2005,65(11):4739-4746.
[11] 張佳.D2-40和CD34在口腔鳞癌淋巴结微转移中的表达及其临床及病理学意义[C]//2019年中华口腔医学会口腔病理学专业委员会第十三次全国口腔病理学术会议论文汇编,2019.
[12] Hill MM,Hemmings BA.Inhibition of protein kinase B/Akt:Implications for cancer therapy[J].Phannacol Ther,2002,93(2-3):243-251.
[13] Pan HM,Lang WY,Yao LJ,et al.shRNA-interfering LSD1 inhibits proliferation and invasion of gastric cancer cells via VEGF-C/PI3K/AKT signaling pathway[J].World Journal of Gastrointestinal Oncology,2019,11(2):91-101.
[14] Yuan ZQ,Feldman RI,Sussman GE,et a1.AKT2 inhibition of cisplatin-induced JNK/p38 and Bax activation by phosphorylation of ASK1:Implication of AKT2 in chemoresistance[J].J Biol Chem,2003,278(26):23 432-23 440.
[15] Lee TK,Park JY,Yu JS,et al.7 alpha, 15-Dihydroxydehydroabietic acid from Pinus koraiensis inhibits the promotion of angiogenesis through downregulation of VEGF,p-Akt and p-ERK in HUVECs[J].Bioorganic and Medicinal Chemistry Letters,2018,28(6):1084-1089.
[16] Ye J,Wu X,Wu D,et al.miRNA-27b targets vascular endothelial growth factor C to inhibit tumor progression and angiogenesis in colorectal cancer[J].PLoS One,2013, 8(4):e60 687.
[17] Beasley NJ,Lee J,Eski S,et a1.Impact of nodal metastases on prognosis in patients with well-dierentiated thyroid cancer[J].Arch Otolaryngol Head Neck Surg,2002, 128(7):825-828.
(收稿日期:2020-05-25)

