肿瘤坏死因子-α和白细胞介素-17A对骨关节炎患者成纤维样滑膜细胞作用的生物信息学分析
邱志伟 梅阳阳 仲卫红 付长龙 谢新宇 牛晓敏 叶银燕


【摘 要】目的:利用生物信息学方法分析肿瘤坏死因子-α(TNF-α)和白细胞介素-17A(IL-17A)对骨关节炎患者成纤维样滑膜细胞的作用机制。方法:从GEO数据库中下载GSE93720基因芯片数据集,利用GEO2R筛选出差异表达基因。用DAVID 6.8在线数据库对差异表达基因进行GO分析和KEGG信号通路分析,String数据库构建蛋白质间相互网络,导入Cytoscape 3.7.1软件进行可视化编辑,筛选出网络中的核心基因,然后用MCODE插件进行子网络模块分析。结果:共筛选出差异表达基因256个,其中上调基因213个,下调基因43个。差异最显著的5个基因是C15orf48、CXCL8、CCL20、CXCL3、CXCR4。上调的差异基因GO分析主要涉及免疫反应、炎症反应、信号转导、细胞因子活性、趋化因子活性等。上调的差异基因KEGG信号通路分析主要涉及细胞因子-细胞因子受体相互作用、肿瘤坏死因子信号通路、趋化因子信号通路等。结论:利用生物信息学方法分析TNF-α和IL-17A诱导的骨关节炎成纤维样滑膜细胞的基因表达谱变化,为探究骨关节炎的发病机制提供指导。
【关键词】 骨关节炎;肿瘤坏死因子-α;白细胞介素-17A;成纤维样滑膜细胞;生物信息学
【ABSTRACT】Objective:To analyze the mechanism of TNF-α and IL-17A on fibroblast-like synoviocytes in patients with osteoarthritis by bioinformatics.Methods:Microarray data set GSE93720 was downloaded from the GEO database and deferentially expressed genes were screened by GEO2R.Go analysis and KEGG signal pathway analysis of deferentially expressed genes were carried out using the online database David 6.8.The inter protein network was constructed by String database.The core genes in the network were screened out by using the software of Cytoscape 3.7.1.Then the sub network module was analyzed by plug-in MCODE.Results:A total of 256 differentially expressed genes were screened,including 213 up-regulated genes and 43 down-regulated genes.The five genes with the most significant difference were C15orf48,CXCL8,CCL20,CXCL3 and CXCR4.The GO analysis for the up-regulated differential genes mainly involved immune response,inflammatory response,signal transduction,cytokine activity and chemokine activity.The KEGG signaling pathway analysis for the up-regulated differential genes mainly involves cytokine-cytokine receptor interaction,tumor necrosis factor signaling pathway and chemokine signaling pathway.Conclusion:The analysis of the gene expression profile of fibroblast-like synoviocytes in osteoarthritis induced by TNF-α and IL-17A by bioinformatics method can provide guidance for exploring the pathogenesis of osteoarthritis.
【Keywords】 osteoarthritis;TNF-α;IL-17A;fibroblast-like synoviocytes;bioin-formatics
骨关节炎(osteoarthritis,OA)是临床上最常见的关节炎,主要表现为疼痛、关节软骨退变、结构变化,以及功能下降。本病受体质量、外伤、年龄、性别、基因、环境等多种因素影响[1-2],60岁以上人群患病率为24%,其中女性是男性的3倍[3]。OA难以彻底治愈且易反复,对患者造成很大的困扰。以往的研究发现,滑膜在OA中发挥着重要的作用[4],在OA发病过程中,滑膜细胞大量增生,滑膜显著增厚。滑膜细胞分为A、B两型,A型包括巨噬细胞样具有吞噬功能的细胞;B型如成纤维样滑膜细胞(FLS),主要功能是分泌透明质酸,为关节提供润滑和营养作用。此外,FLS还可产生多种生长因子、趋化因子以及细胞因子如核转录因子κB受体活化因子配体(RANKL),促进破骨细胞形成和软骨破坏,参与OA的发病机制[5-6]。
肿瘤坏死因子-α(TNF-α)是造成關节炎软骨破坏的重要因子,可诱发基质金属蛋白酶和前列腺素进而影响软骨的破坏,也可通过调节FLS的神经生长因子影响OA患者的关节疼痛,因此,已经被广泛应用于关节炎的治疗中[7-8]。白细胞介素-17(IL-17)是介导OA的一种重要炎性因子,阻断IL-17信号通路可有效缓解疼痛[9]。IL-17家族可分为6个亚型,IL-17A在其中占主导作用[10]。IL-17介导的炎症可导致FLS线粒体功能障碍,进而刺激炎性淋巴细胞浸润[11]。TNF-α和IL-17A在OA的发展过程中均扮演重要角色,且相关研究证明这两者之间有协同作用。例如,IL-17A和TNF-α可通过对成骨基因如骨形态发生蛋白-2(BMP-2)、Wnt5a和Runx2的影响,诱导FLS向成骨细胞分化[12]。FISCHER等[13]发现,联合阻断IL-17A和TNF-α对于抑制细胞因子、趋化因子以及阻止OA的发展更有效。本研究通过选取经过TNF-α和IL-17A联合处理的OA患者FLS芯片,利用生物信息学方法分析该基因表达谱数据,探究TNF-α和IL-17A联合作用于OA患者FLS作用的分子机制,为未来OA的临床治疗提供方向和证据。
1 材料和方法
1.1 GEO基因芯片数据的获取 GEO是一个庞大的公共基因数据集存储库,储存着众多的基因数据以及相应的原始系列和来源平台[14]。从该数据库中下载基因芯片数据集GSE93720,该数据集基于Affymetrix Human Genome U133 Plus 2.0 Array平台,包括2例OA和2例RA患者的FLS,取自美国Brigham and Womens Hospital滑膜切除术或关节置换手术后丢弃的组织中分离出的FLS,共有48个样本(包括未经处理、TNF-α单独处理,以及TNF-α和IL-17A共同处理的样本),为了分析TNF-α和IL-17A联合作用对OA发生发展的影响,取6个OA-FLS未经处理样本作为对照组,6个TNF-α和IL-17A共同处理的样本作为实验组。该样本第1天在含体积分数为10%的胎牛血清的培养基中,以每孔50 000个细胞的速度培养。第2天用含体积分数为1%的胎牛血清的培养基进行血清饥饿。第3天对照组不受刺激,实验组TNF-α(1 ng·mL-1) + IL-17A(1 ng·mL-1)刺激约20 h,之后用TRizol试剂(Life Technologies)收集样本。该芯片的平台文件为GPL570。
1.2 差异基因的筛选 基因表达分析工具GEO2R是基于R语言应用t检验或者方差分析寻找差异表达基因(DEGs)的软件,利用GEO2R(http://www.ncbi.nlm.nih.gov/geo/geo2r)对2组FLS基因进行差异分析,筛选出DEGs,并且设置筛选范围为P < 0.05,差异倍数|log2FC| ≥ 2。
1.3 功能富集分析 注释分析工具DAVID 6.8(https://david.ncifcrf.gov)在线数据库对DEGs进行基因本体(GO)富集分析和京都基因与基因组百科全书(KEGG)信号通路分析,GO分析包括生物学过程、细胞组分和分子功能。富集分析过程中,校正P < 0.05为差异有统计学意义。
1.4 蛋白-蛋白相互作用(PPI)网络构建和分析 基于STRING数据库(https://string-db.org/)构建PPI网络,通过Cytoscape 3.7.1软件获取PPI网络中的核心基因。
2 结 果
2.1 DEGs筛选结果 通过GEO2R对GSE93720进行筛选,首先去除没有Gene Symbol注释的条目,并设置筛选范围为P < 0.05,差异倍数|log2FC|≥2。
筛选后,由于探针和基因可能出现一对多与多对一的关系,当一个探针对应多个基因时,说明探针不能特异定位到某个基因上,不能说明是某个特定基因的表达量,因此删除;当多个探针对应一个基因时,取这些探针的均值作为基因的最终表达值。同样,在GEO数据库中下载矩阵文件,将探针名转化为基因名,取重复基因探针的均值,为绘制聚类分析热图做准备。共筛选出差异表达基因256个,其中上调基因213个,下调基因43个。上调的DEGs中,差异最显著的5个基因有C15orf48、CXCL8、CCL20、CXCL3、CXCR4。利用R语言对DEGs构建火山图和热图,如图1、图2。
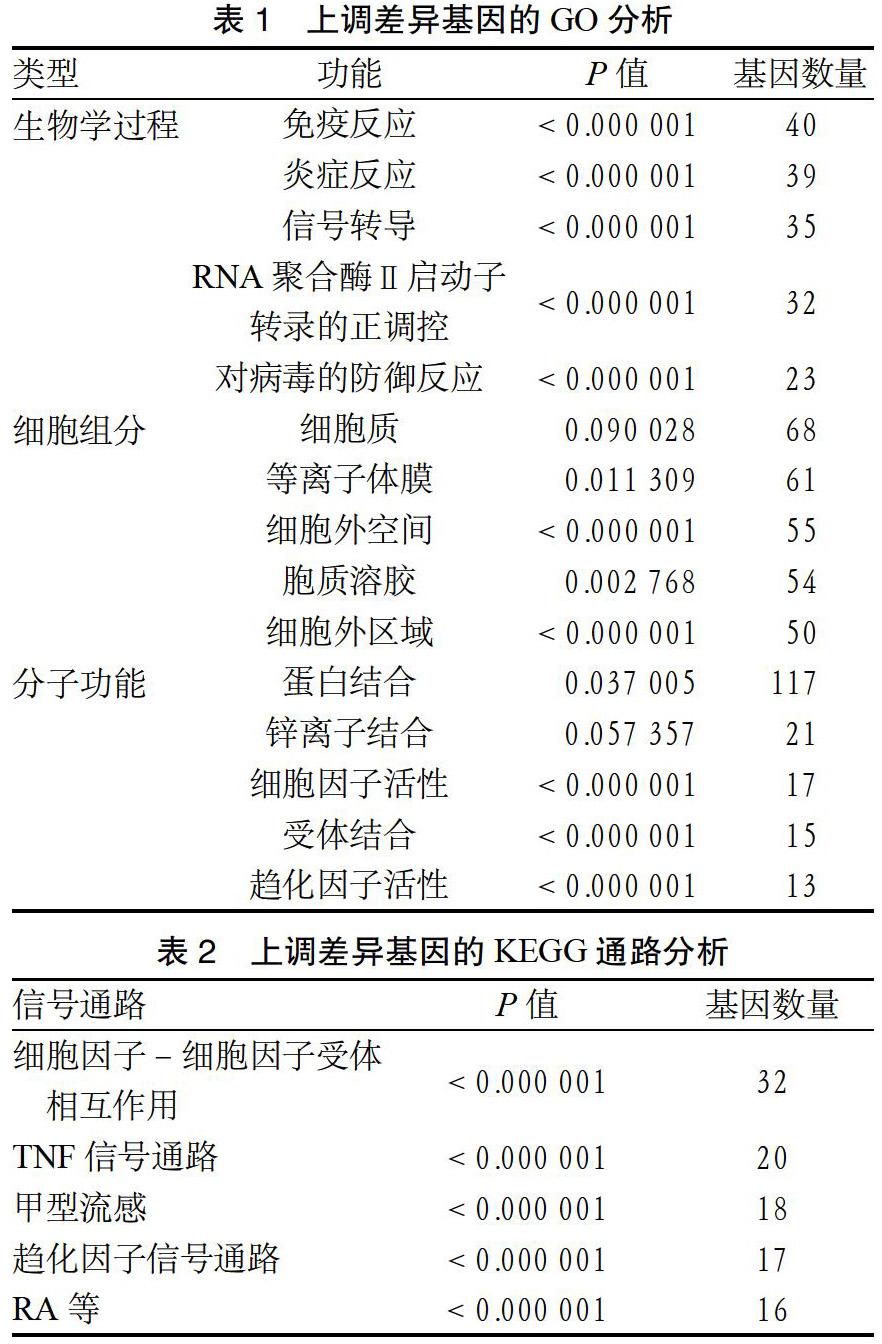
2.2 DEGs的GO分析和KEGG通路分析 取上调基因进行GO分析和KEGG通路分析,选取最显著的前5个,包括生物学过程:免疫反应、炎症反应、信号转导、RNA聚合酶Ⅱ启动子转录的正调控、对病毒的防御反应。细胞组分:细胞质、等离子体膜、细胞外空间、胞质溶胶、细胞外区域。分子功能:蛋白结合、锌离子结合、细胞因子活性、受体结合、趋化因子活性。见表1。上调差异基因的KEGG通路分析主要集中在细胞因子-细胞因子受体相互作用、TNF信号通路、甲型流感、趋化因子信号通路、类风湿关节炎(rheumatoid arthritis,RA)等。见表2。
2.3 DEGs的PPI网络建设 将筛选出的256个差异基因上传到STRING在线数据库中,得到差异基因编码蛋白的相互作用网络,将该PPI网络导入Cytoscape 3.7.1中进行可视化,网络共有204个节点和1613条邊,见图3。用cytoHubba 插件计算PPI网络拓扑结构中每个节点的度值(degree),选取度值最高的5个当作核心基因,分别是IL-6、CXCL10、IL-1β、CCL8和TLR2,关系网见图4。MCODE插件对PPI网络进行子模块分析,模块得分最高的有2个,见图5。分别是模块一30.3分,32个节点,470条边。模块二19.5分,22个节点,205条边。2个模块的基因均为上调基因。
3 讨 论
在OA发病过程中滑膜产生炎症且继发增生,FLS作为滑膜的主要组成部分,大量存在于增生的滑膜组织中,加速关节和关节软骨的破坏,与OA的发展紧密相关。以往的研究表明,IL-17A与TNF-α皆可促进滑膜炎症的发展,且两者有协同作用。
本研究通过GEO数据库筛选出GSE93720基因芯片,利用生物信息学方法把OA患者FLS经过TNF-α和IL-17A处理与未经处理的细胞进行对比,筛选出差异基因256个,包括上调的213个和下调的43个。上调的DEGs中,差异最显著的5个基因有C15orf48、CXCL8、CCL20、CXCL3、CXCR4。有研究表明,CXCL8对OA患者软骨细胞具有促炎作用;CXCL8可通过增强其他炎性因子的表达,促进细胞的凋亡,加重OA进程[15]。GUAN等[16]发现,CCL20在OA患者滑膜液中的水平与K-L分级呈显著相关;且CCL20可通过CCR6激活关键的信号通路,促进FLS中促炎性介质的合成,可将抗CCL20作为OA药物治疗研究的潜在目标[17]。CXCL3作为强中性粒细胞趋化因子,在OA中表达增加[18],FLS产生大量的趋化因子(包括CXCL8和CXCL3),参与了滑膜组织炎症细胞的浸润[19]。CXCR4参与了基质细胞衍生因子诱导的OA-FLS中IL-6的表达[20],且基质细胞衍生因子与CXCR4相互作用会导致软骨变性,进一步加重关节损伤[21]。说明TNF-α和IL-17A作为OA发展过程中重要的促炎因子,主要通过激活趋化因子促进FLS中炎性介质的合成,进一步导致软骨的变性以及关节的炎症反应。
GO分析顯示,FLS相关基因除了与免疫反应和炎症反应有关外,还可通过信号转导识别周围环境的各种信号,进而改变细胞内的分子活性以及细胞的某些代谢过程,甚至影响细胞的生长与凋亡。分子功能包括蛋白结合、受体结合、细胞因子活性和趋化因子活性等。KEGG信号通路分析发现这些上调差异基因主要参与了细胞因子-细胞因子受体相互作用、TNF-α信号通路、趋化因子信号通路等。CAI等[22]通过对比OA和RA患者FLS的差异基因,发现OA和RA的发展中均有TNF-α信号通路和趋化因子通路的参与,且TNF-α信号通路主要参与OA的发展,与本研究的结论相似。说明在IL-17A和TNF-α的影响下,细胞因子之间相互作用,OA-FLS中TNF-α信号通路和趋化因子通路被激活,通过大量趋化因子如CXCL8、CCL20、CXCL3、CXCR4,促使FLS释放更多炎性因子,加快滑膜炎症的发展。
在差异基因PPI网络中利用cytoHubba插件得出5个度值最高的核心基因:IL-6、CXCL10、IL-1β、CXCL8和TLR2。已经有大量研究表明,IL-6和IL-1β是参与OA软骨退行性变的重要炎性细胞因子。PEARSON等[23]发现,OA软骨细胞和FLS之间具有交互作用,FLS分泌IL-6是由软骨细胞来源的IL-6诱导产生的。在OA患者的滑膜液和FLS中IL-6过表达,IL-6浓度与OA的放射学严重程度和基质金属蛋白酶水平相关[24-25]。IL-1β由滑膜中的巨噬细胞产生,可刺激滑膜细胞降钙素样受体的表达,诱导降钙素基因相关肽信号通路,进而导致OA产生疼痛[26]。IL-1β也可刺激FLS产生外泌体,导致软骨细胞基因表达模式的改变和软骨退化[27]。MCGARRY等[28]证明激活Toll样受体(TLR2)可导致RA-FLS的线粒体功能障碍,影响线粒体呼吸功能与细胞的代谢活动;与IL-17A共同影响线粒体功能,促进炎性细胞的浸润[11]。RANKL是在FLS上表达的细胞因子,可激活破骨细胞,造成关节软骨的损伤,TLR2可增加由IL-17介导的RANKL表达,进一步加深关节炎症与软骨的破坏[6,29]。
综上所述,TNF-α和IL-17A共同作用于OA患者FLS,主要是通过上调IL-6、IL-1β等炎性细胞因子以及大量的趋化因子如CXCL8、CCL20、CXCL3、CXCR4加重软骨退行性变和滑膜炎症,从而加深OA的病情发展。未来OA治疗可针对TNF-α和IL-17A的抑制,或者阻断两者之间的联系作为研究方向。但本文尚存在不足之处,例如筛选差异表达基因来源的样本量较少,且样本源自于美国OA患者,与国内OA患者存在一定的种族差异,今后需要获取更多的国内样本进行验证。
参考文献
[1] JOHNSON VL,HUNTER DJ.The epidemiology of osteoarthritis[J].Best Pract Res Clin Rheumatol,2014,28(1):5-15.
[2] ZENGINI E,FINAN C,WILKINSON JM.The Genetic Epidemiological Landscape of Hip and Knee Osteoarthritis:Where Are We Now and Where Are We Going?[J].J Rheumatol,2016,43(2):260-266.
[3] WOOLF AD,PFLEGER B.Burden of major musculoskeletal conditions[J].Bull World Health Organ,2003,81(9):646-656.
[4] SCANZELLO CR,GOLDRING SR.The role of synovitis in osteoarthritis pathogenesis[J].Bone,2012,51(2):249-257.
[5] ROBINSON WH,LEPUS CM,WANG Q,et al.Low-grade inflammation as a key mediator of the pathogenesis of osteoarthritis[J].Nature Reviews Rheumatology,2016,12(10):580-592.
[6] DANKS L,KOMATSU N,GUERRINI MM,et al.RANKL expressed on synovial fibroblasts is primarily responsible for bone erosions during joint inflammation[J].Ann Rheum Dis,2016,75(6):1187-1195.
[7] WANG T,HE C.Pro-inflammatory cytokines:The link between obesity and osteoarthritis[J].Cytokine Growth Factor Rev,2018,44(10):38-50.
[8] TAKANO S,UCHIDA K,MIYAGI M,et al.Nerve Growth Factor Regulation by TNF-α and IL-1β in Synovial Macrophages and Fibroblasts in Osteoarthritic Mice[J].J Immunol Res,2016,2016(11):1-8.
[9] LIU Y,PENG H,MENG Z,et al.Correlation of IL-17 Level in Synovia and Severity of Knee Osteoarthritis[J].Medical Science Monitor,2015,15(21):1732-1736.
[10] SARKAR S,JUSTA S,BRUCKS M,et al.Interleukin(IL)-17A,F and AF in inflammation:a study in collagen-induced arthritis and rheumatoid arthritis[J].Clin Exp Immunol,2014,177(3):652-661.
[11] KIM EK,KWON JE,LEE SY,et al.IL-17-mediated mitochondrial dysfunction impairs apoptosis in rheumatoid arthritis synovial fibroblasts through activation of autophagy[J].Cell Death Dis,2018,8(1):e2565.
[12] OSTA B,ROUX J,LAVOCAT F,et al.Differential Effects of IL-17A and TNF-α on Osteoblastic Differentiation of Isolated Synoviocytes and on Bone Explants from Arthritis Patients[J].Front Immunol,2015,7(6):151.
[13] FISCHER JA,HUEBER AJ,WILSON S,et al.Combined inhibition of tumor necrosis factor α and interleukin-17 as a therapeutic opportunity in rheumatoid arthritis:development and characterization of a novel bispecific antibody[J].Arthritis Rheumatol,2015,67(1):51-62.
[14] BARRETT T,WILHITE SE,LEDOUX P,et al.NCBI GEO:archive for functional genomics data sets-update[J].Nucleic Acids Res,2013,27(41):D991-D995.
[15] YANG P,TAN J,YUAN Z,et al.Expression profile of cytokines and chemokines in osteoarthritis patients:Proinflammatory roles for CXCL8 and CXCL11 to chondrocytes[J].Int Immunopharmacol,2016,40(8):16-23.
[16] GUAN J,LI Y,DING L,et al.Relationship between serum and synovial fluid CCL20 concentrations with disease severity in primary knee osteoarthritis[J].J Musculoskelet Neuronal Interact,2019,19(3):326-332.
[17] ALAAEDDINE N,HILAL G,BADDOURA R,et al.Fibroblast-like Synoviocytes Through a MAP Kinase-dependent Process with CCL20 Stimulates Proinflammatory Mediator Synthesis in Human[J].J Rheumatol,2011,38(9):1858-1865.
[18] KARLSSON C,DEHNE T,LINDAHL A,et al.Genome-wide expression profiling reveals new candidate genes associated with osteoarthritis[J].Osteoarthritis Cartilage,2010,18(4):581-592.
[19] SATO H,MURAOKA S,KUSUNOKI N,et al.Resistin upregulates chemokine production by fibroblast-like synoviocytes from patients with rheumatoid arthritis[J].Arthritis Res Ther,2017,19(1):263.
[20] CHEN H,TSOU H,HSU C,et al.Stromal cell-derived factor-1/CXCR4 promotes IL-6 production in human synovial fibroblasts[J].J Cell Biochem,2011,112(4):1219-1227.
[21] WEI F,MOORE DC,WEI L,et al.Attenuation of osteoarthritis via blockade of the SDF-1/CXCR4 signaling pathway[J].Arthritis Res Ther,2012,14(4):R177.
[22] CAI P,JIANG T,LI B,et al.Comparison of rheumatoid arthritis(RA)and osteoarthritis(OA)based on microarray profiles of human joint fibroblast-like synoviocytes[J].Cell Biochem Funct,2019,37(1):31-41.
[23] PEARSON MJ,HERNDLER-BRANDSTETTER D,TARIQ MA,et al.IL-6 secretion in osteoarthritis patients is mediated by chondrocyte-synovial fibroblast cross-talk and is enhanced by obesity[J].Sci Rep,2017,7(1):3451.
[24] YANG F,ZHOU S,WANG C,et al.Epigenetic modifications of interleukin-6 in synovial fibroblasts from osteoarthritis patients[J].Sci Rep,2017,7(1):43592.
[25] LAAVOLA M,LEPP?NEN T,H?M?L?INEN M,et al.IL-6 in Osteoarthritis:Effects of Pine Stilbenoids[J].Molecules,2018,24(1):109.
[26] TAKANO S,UCHIDA K,MIYAGI M,et al.Synovial macrophage-derived IL-1β regulates the calcitonin receptor in osteoarthritic mice[J].Clin Exp Immunol,2016,183(1):143-149.
[27] KATO T,MIYAKI S,ISHITOBI H,et al.Exosomes from IL-1β stimulated synovial fibroblasts induce osteoarthritic changes in articular chondrocytes[J].Arthritis res ther,2014,16(4):R163.
[28] MCGARRY T,BINIECKA M,GAO W,et al.Resolution of TLR2-induced inflammation through manipulation of metabolic pathways in Rheumatoid Arthritis[J].Scientific Reports,2017,7(1):43165.
[29] MILANOVA V,IVANOVSKA N,DIMITROVA P.TLR2 elicits IL-17-mediated RANKL expression,IL-17,and OPG production in neutrophils from arthritic mice[J].Mediators Inflamm,2014,2014(16):643406-643414.
收稿日期:2020-02-28;修回日期:2020-04-15