介孔交联阳离子淀粉的特性表征
孙倩,马云翔,李海燕,俞力月,苟丽娜,张盛贵
(甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
淀粉是一种天然的聚合高分子化合物,是自然界中第二大可重生碳水化合物.淀粉应用的限制源于其低表面积[1],为了克服这些不足,人们研究了各种变性淀粉,近年来多孔淀粉是备受关注的一类材料[2].多孔淀粉是一种由淀粉颗粒表面向中心延伸的具有丰富微孔(1 μm)的新型变性淀粉,淀粉的总体积约为微孔总体积的两倍[3].多孔淀粉通过物理、化学和生物方法可以获得,是一种经济且可生物降解的吸附剂[4],广泛用于食品,医药,农业,纸浆和造纸等行业[5].介孔材料是由国际纯粹与应用化学联合会(IUPAC)定义的一类多孔材料,其孔径在2~50 nm之间[6],淀粉颗粒中有直链淀粉和支链淀粉两种聚合物链,由于其天然能力有所不同,组装成一个含结晶区和非晶区且有组织的纳米级片层结构[7].由于其不同的表面功能,它们有许多应用,如催化[8],吸附[9]和医药[10]等.
阳离子淀粉可以作为吸附剂[11]和絮凝剂[12],Deimante等人研究发现阳离子淀粉可吸附特定酚酸类物质比如咖啡酸、绿原酸、迷迭香酸等[13],Dovile等人研究发现阳离子淀粉在吸附绿原酸后抗氧化性高于不吸附绿原酸的阳离子淀粉[14].絮凝和吸附效果的改善取决于更高的取代度(DS).DS在0.2~0.9之间的阳离子淀粉作为絮凝剂和吸附剂更有利[12],因此,具有高DS的阳离子淀粉越来越受到人们的关注.阳离子淀粉的通过醚化剂制备,常用的有2-羟丙基三甲基氯化铵(CHPTAC)和2-3环氧丙基三甲基氯化铵(GTAC),但受反应条件限制,CHPTAC只能用于合成季铵盐含量低的阳离子淀粉(DS<0.1),GTAC的应用可以提高DS以及反应效率[15].多孔淀粉增加了羟基的裸露,有利于底物间相互反应,Chen等人以GTAC为阳离子化试剂多孔淀粉为原料,制备阳离子淀粉,扫描电镜可观察到孔洞良好[16].
有研究以酶法制的多孔淀粉为原料,阳离子化制备后用于控制即时出血的材料[16],目前文献中没有关于溶剂交换法制备介孔淀粉后进行阳离子交联化的探究;同时大多制备得到的阳离子淀粉的应用局限于其取代度和比表面积低且无孔.本实验以溶剂交换法制备的介孔淀粉为材料,通过交联化提升其“骨架”的稳定性[17],进一步对阳离子化,试图制备一种具有较高取代度和吸附能力的材料,为变性淀粉的应用提供新的路径.
1 材料与方法
1.1 材料
马铃薯淀粉(BR;购于上海源叶生物科技有限公司),乙醇(纯度99%)、2-3环氧丙基三甲基氯化铵(GTAC)、NaOH、环氧氯丙烷(EPI)、其他试剂和溶剂均为分析级,试验用水均为蒸馏水.
1.2 仪器设备
电子天平(AE5003 AE11003,湘仪天平仪器设备有限公司);pH计(pHSJ-4A 0.000~14.000 pH,上海子期实验设备有限公司);微波消解仪(YMW微波消解仪,长沙永乐康仪器设备有限公司);凯式定氮仪(ATN-l00,上海洪纪仪器设备有限公司);扫描电子显微镜(JSM-6701F,日本);全自动静态化学吸附仪(ASAP 2020 plus;美国);冷冻离心机(H-1850R,长沙湘仪离心机仪器有限公司)傅里叶变换红外光谱仪(FTIR920,天津市拓普仪器有限公司);热重分析仪(TGA55,美国TA);X射线衍射分析仪(D/max IIIAX);激光粒度分布仪(Bettersize2600,中国);差示扫描量热仪(HSC-1,北京恒久实验设备有限公司).
1.3 试验方法
1.3.1 交联阳离子淀粉的制备 参照Clark的方法并略作修改[18].将5 g马铃薯淀粉添加到150 mL蒸馏水中,并将混合物在40 ℃下连续搅拌40 min,加热到90 ℃,持续搅拌并保持60 min以完全糊化淀粉.然后在4 ℃储存48 h以获得淀粉凝胶.以无水乙醇浸入凝胶切块(约0.5~1 cm3)3次,每次浸泡约1.5 h,完成后在50 ℃下干燥8 h,获得介孔淀粉白色固体研磨以备下一步试验用.
参照Kavaliauskaite的方法并作修改[19].介孔淀粉悬浮在水中以获得浓度为15 %的浆液,加入环氧氯丙烷(EPI)并调节其pH值达到11,45 ℃下连续搅拌进行交联,反应24 h后取出,50 ℃下干燥8 h后,用于阳离子化.
参照Deimante的方法并做修改[13],加入0.25~1.25 g GTAC和0.1~0.5 g NaOH到3 g交联淀粉的水溶液并充分混合,45 ℃下均匀化并保持反应24 h,用异丙醇洗涤阳离子淀粉5次,50 ℃下干燥.最终得到交联阳离子淀粉(CCS).
1.3.2 取代度(DS)的测定 丙酮进行索氏提取(CCS)20 h,凯氏定氮法测定阳离子淀粉中的氮含量:
式中,N为凯氏定氮测得的氮含量,%;162为脱水葡萄糖苷单元的分子质量(AGU),151.5为GTAC的分子量.
1.3.3 扫描电子显微镜(SEM)形态学研究 扫描电压显微镜在15 kV的加速电压下观察样品表面的形貌.用金溅射涂覆微球4 h后进行观察试验.
1.3.4 氮气吸-脱附分析 在80 ℃下进行真空加热预处理之后,在氮气温度下进行吸附,用于分析样品的比表面积和孔径.
1.3.5 傅立叶变换红外(FTIR)光谱测定 FT-IR光谱技术用于分析样品粉末的化学结构,实验中使用FTIR-KBr纯化合物在20 MPa下压制5 min以获得使用FTIR研究的片剂,扫描范围500~4 000 cm-1.
1.3.6 液态核磁(1HNMR)测定 参考Cai的方法[20]用Bruker DRX-500 型谱仪在500.13 MHz下测定,温度为(25±0.5)℃.将20 mg /mL的浓度的样品溶解在D2O溶液中,于5 mm直径管中进行光谱测量.
1.3.7 差示扫描量热(DSC)测定 称量样品粉末(约2.0 mg)并密封在铝DSC盘中.以20 ℃/ min的加热速率从20 ℃至100 ℃进行DSC扫描,以相同空白铝盘坩埚作为参考.
1.3.8 热稳定性(TG)分析 在高纯氮氛围条件下测试,进样质量(约6.0 mg),升温范围为 20~600 ℃,升温速率为25 ℃/min,氮气流量:30 mL/min.
1.3.9 X射线衍射(XRD)分析 试验条件为:铜靶,工作电压和电流分别为40.0 kV、 40 mA,发射及防反射狭缝为0.5 °,接受狭缝隙为0.3 mm,扫描速度17.7 S/S,扫描范围5 °~50 °,采样间隔为0.02°.
1.3.10 粒度分布测定 将少量样品粉末分散在蒸馏水中,加样品量至合适范围内遮光度,粒度表示为平均体积尺寸D[4,3](De Brouckere平均直径),即具有相同体积的球体的平均直径,并进行分析.
1.4 统计分析
该研究中的所有数据采用Origin软件进行作图和数据处理分析.
2 结果与讨论
2.1 取代度(DS)分析
如图1所示,当添加0.75 g GTAC,40 mL H2O时,选取0.1、0.2、0.3、0.4和0.5 g NaOH不同量进行阳离子化制备得到CCS,并分别测定其DS,当NaOH的用量为0.2 g时,取代度达到最高值为0.59;当使用0.2 g NaOH,H2O 40 mL时,选取0.25、0.50、0.75、1.0和1.25 g GTAC不同量进行阳离子化制备得到CCS,并分别测定其DS,当GTAC的用量为0.75 g时,取代度达到最高值为0.60;当使用0.2 g NaOH,水0.75 g GTAC时,选取10、20、30、40、50 mL不同量的H2O进行阳离子化制备得到CCS;当H2O的用量为30 mL时,取代度达到最高值为0.63.
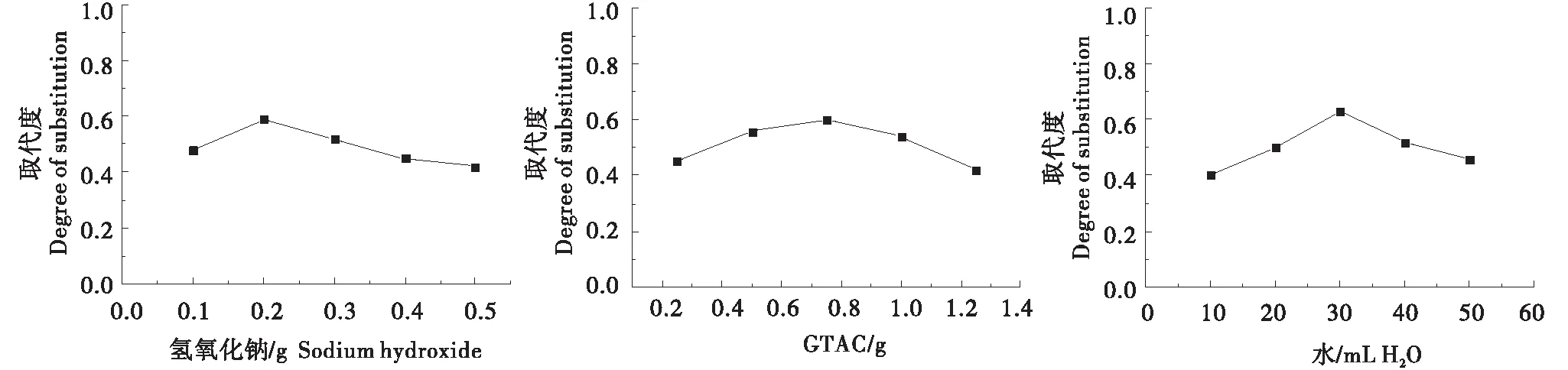
图1 催化剂(NaOH)、GTAC和H2O用量对取代度的影响Figure 1 Effect of catalyst dosage(NaOH)、GTAC and H2O on degree of substitution
通过单因素试验可得在进行阳离子化时,选取备用淀粉3 g,加入0.2 g NaOH,30 mL H2O,0.75 g GTAC时,阳离子化后淀粉取代度达到最高值0.63.Klimaviciute、Chen等人用马铃薯淀粉以及多孔淀粉制备交联阳离子淀粉的取代度为分别为0.56[19]、 0.42[16].可以看出,以介孔淀粉制备的交联阳离子淀粉具有取代度高的优势.
2.2 SEM形态结构分析
如图2所示,观察到马铃薯淀粉(图2-A)的颗粒分布不均匀,马铃薯淀粉主要多为椭圆形,有光滑的表面,颗粒较为完整[21];与原淀粉相比较,介孔淀粉(图2-B)丧失了其原有结构,表面呈粗糙状,颗粒形态结构发生肉眼可见的明显变化,布满了大量细小的孔洞,且孔洞深入淀粉内部形成连接不断的网状结构,周围有细小的孔洞分布,其整体孔径分布不均匀;而交联阳离子淀粉(图2-C)与介孔淀粉相比,孔径明显增大,较为均匀,区别于介孔淀粉的蜂窝状.
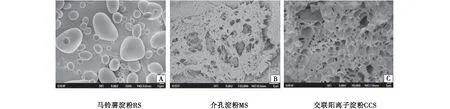
图2 马铃薯淀粉RS(A)、介孔淀粉MS(B)以及交联阳离子淀粉CCS(C)的SEMFigure 1 SEMS of potato starch,mesoporous starch and cross-linked cationic starch
2.3 氮气吸-脱附分析
介孔材料是由国际纯粹与应用化学联合会(IUPAC)定义的一类多孔材料,其孔径在2~50 nm之间[6].氮气物理吸-脱附分析结果显示(表1),试验制备的介孔淀粉孔径为22.66 nm,介孔交联阳离子淀粉的孔径为48 nm,均符合介孔材料孔径要求;而马铃薯淀粉制备的交联阳离子淀粉的孔径为10 640 nm,可以判断其并无微孔形成,其“孔径”主要是颗粒间的堆积产生的.介孔淀粉BET(14.392 cm3/g)显著高于马铃薯淀粉BET(0.021 9 m2/g),表明以介孔淀粉为材料制备阳离子淀粉的优势;介孔淀粉BET(14.392 m2/g)和孔体积(0.073 0 cm3/g)显著高于介孔交联阳离子淀粉BET(1.077 5 m2/g)和孔体积(0.002 8 cm3/g),表明在交联和阳离子化反应过程中,介孔虽有保存,但大部分被破坏,这可能与淀粉颗粒本身相对较脆弱有关.介孔交联阳离子淀粉BET(1.077 5 m2/g)与马铃薯淀粉为原料制备的交联阳离子淀粉BET(0.000 3 m2/g)相比明显高出,加之其较高的DS(0.63)和较好的孔形态(图1-C),表明以介孔淀粉为原料制备交联阳离子淀粉仍具有优势,但最大可能保存孔的方法需进一步研究.

表1 马铃薯淀粉、介孔淀粉、马铃薯交联阳离子淀粉以及介孔交联阳离子淀粉氮气吸-脱附分析
2.4 FTIR分析
如图3所示,RS与 MS相比未出现新的特征峰,CCS在1 478 cm-1处出现一个新峰.MS的制备没有化学改性过程,只是淀粉糊化破坏了其致密的生物聚合物网络[20],在回生重结晶[22]过程中用较低表面张力的溶剂交换(通常是乙醇)防止在干燥过程中网络结构崩溃从而形成新的孔隙[23],干燥后得到介孔淀粉.CCS中有C-H在-N+(CH3)3中的振动吸收[20]产生新峰,峰值强度较弱.
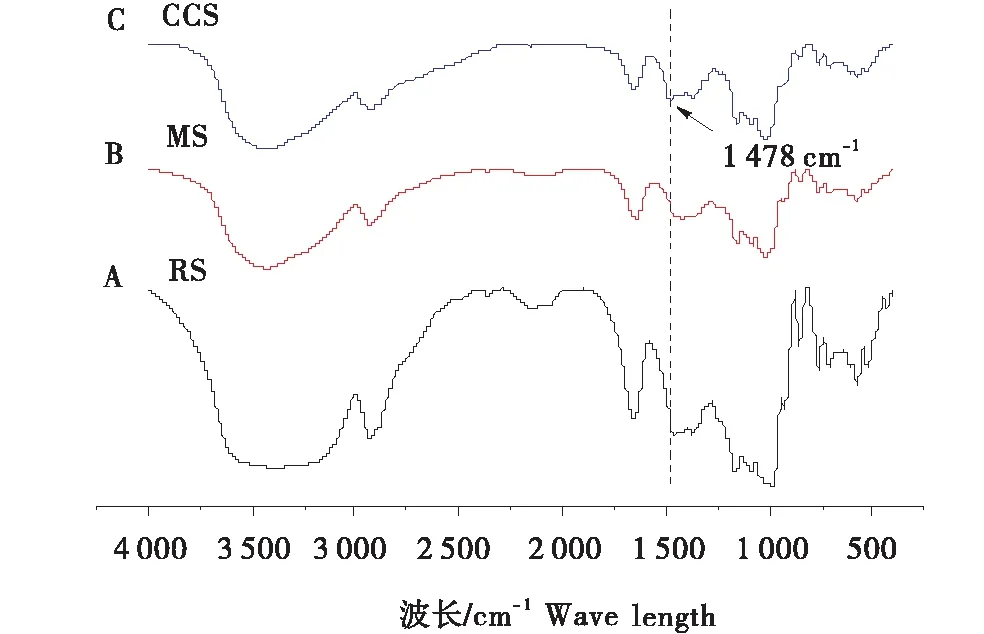
图3 马铃薯淀粉RS、介孔淀粉MS以及交联阳离子淀粉CCS红外光谱图Figure 3 FTIR of potato starch,mesoporous starch and cross-linked cationic starch
2.5 1HNMR分析
如图4所示为MS与CCS的1HNMR谱图,出现了2个新的峰分别为4.36 ppm和3.15 ppm,2个峰分别为亚甲基和甲基[24],证实了介孔淀粉成功使用GTAC进行了阳离子化后制备得到交联阳离子淀粉(MS的制备并无化学改性过程,RS与MS的1HNMR谱图相同不再重复).
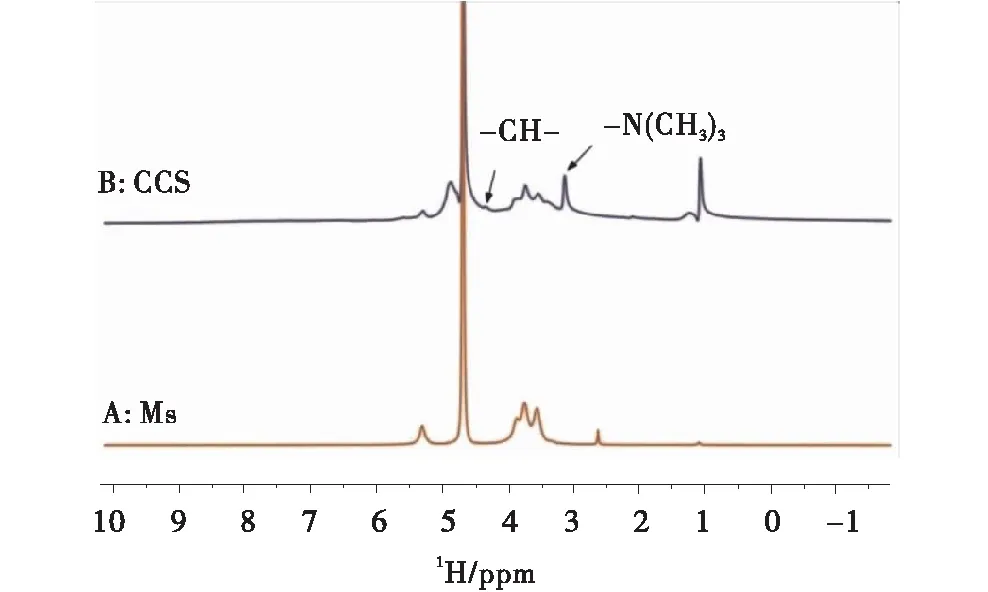
图4 介孔淀粉MS、交联阳离子淀粉CCS的1HNMR谱图Figure 4 1HNMR spectra of potato,mesoporous and cross-linked cationic starch starch
2.6 DSC分析
如图5所示,起始温度由高至低为CCS 、MS、RS,MS通过溶剂交换法得到,以乙醇置换出水分[20],含水量较低,相对于RS开始进行焓变时,分解更加容易.CCS阳离子化过程中氢键破裂,粘度下降,增强了之间的颗粒强度[25],进行焓变时需要更高的温度.其余峰值温度,终止温度以及焓变值,RS、MS、CCS都呈现递增的趋势,其中,CCS的焓变值最高,即吸热峰更宽,明阳离子化改性增加了淀粉间的孔隙率,吸收了更多的水分[25],从而发生质变,这表明了CCS在110 ℃左右比RS、MS更加的稳定.
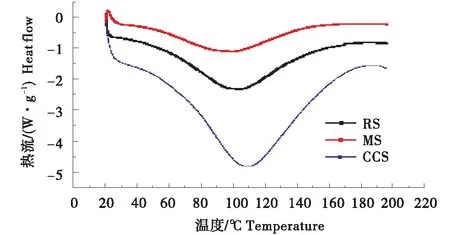
图5 马铃薯淀粉RS、介孔淀粉MS以及交联阳离子淀粉CCS的DSC图Figure 5 DSC of potato starch,mesoporous starch and cross-linked cationic starch
2.7 TGA分析
如图6所示,在0~100 ℃之间, RS、MS、CCS 3种淀粉均有微弱的损失,此变化为水分的蒸发,变化较小[26];当温度到达200 ℃时,交联阳离子淀粉的质量开始快速下降,当温度达到310 ℃时,RS,MS质量也开始了快速下降,此时样品开始分解.

图6 马铃薯淀粉RS、介孔淀粉MS以及交联阳离子淀粉CCS的TGA图Figure 6 TGA of potato starch,mesoporous starch and cross-linked cationic starch
RS、MS、CCS三者分解结束时质量损失分别为4.076、5.106、5.767 mg.RS、MS、CCS质量变化的起始温度呈递减的趋势,介孔淀粉和交联阳离子淀粉相对于马铃薯淀粉更加不稳定,重量损失有递增的趋势,重量损失率也是递增的,说明相对于马铃薯淀粉以及介孔淀粉交联阳离子淀粉在高温高于200 ℃时更加不稳定.
如图7所示,可观察到,在温度50 ℃左右,马铃薯淀粉、在介孔淀粉和介孔交联阳离子淀粉的DTG曲线中,出现了一个较弱的热损失峰,这是样品中残留的水含量(物理吸附的水和结晶水)微弱析出的阶段.在100~200 ℃范围内,样品以几乎恒定的质量进行预热.介孔交联阳离子淀粉在282.5 ℃开始出现快速的下降,在327.7 ℃热降解反应逐渐平稳.而马铃薯淀粉和介孔淀粉热降解反应的反应温度大约都为310 ℃,其热降解区约为310~410 ℃.RS、MS、CCS在N2环境下进行热降解反应,热降解产物最终为碳,淀粉化学改性利用热分析法得到的结果与此相同[27].RS、MS以及CCS最大质量损失率所对应的温度分别为330 ℃、323 ℃、303 ℃,进一步说明了交联阳离子淀粉在高温时不稳定.交联阳离子淀粉制备过程中经历了交联和阳离子化,导致分子之间和分子内部的氢键结构被破坏,更加有利于热降解,键强度降低,导致结合力降低[26].
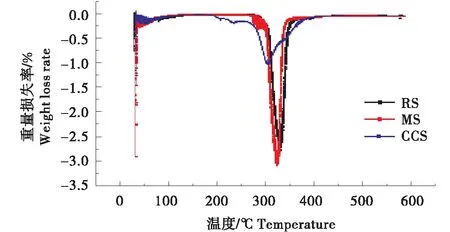
图7 马铃薯淀粉RS、介孔淀粉MS以及交联阳离子淀粉CCS的DTG图Figure 7 DTG of potato starch,mesoporous starch and cross-linked cationic starch
2.8 XRD分析
从图8可以看出, RS在5.6 °,17.2 °,22.4 °有明显的特征峰,为典型的B-型结构的特征峰[28].介孔淀粉制备过程中经过了高达90 ℃的糊化,失去了它原有的结晶结构,变成非晶态无定形结构,特征吸收峰消失.交联阳离子淀粉特征衍射峰基本消失的原因有,交联过程中会形成会网络,破坏分子链的有序性,淀粉分子结晶过程受到阻碍,结晶能力被抑制[25];在醚化过程中,GTAC和碱性催化剂共同作用进入渗透淀粉的孔径内部,并且反应在孔径和表面同时进行,淀粉分子之间的氢键被醚化反应破坏,这进一步破坏了分子链的顺序,使阳离子淀粉结晶度再次降低[26]后基本以无定形存在.CCS非晶区比例增加,晶区比例减少,即MS和CCS的结晶度低于RS,由结晶度高低可推断,MS和CCS更易溶解,在应用中应引起重视[29].
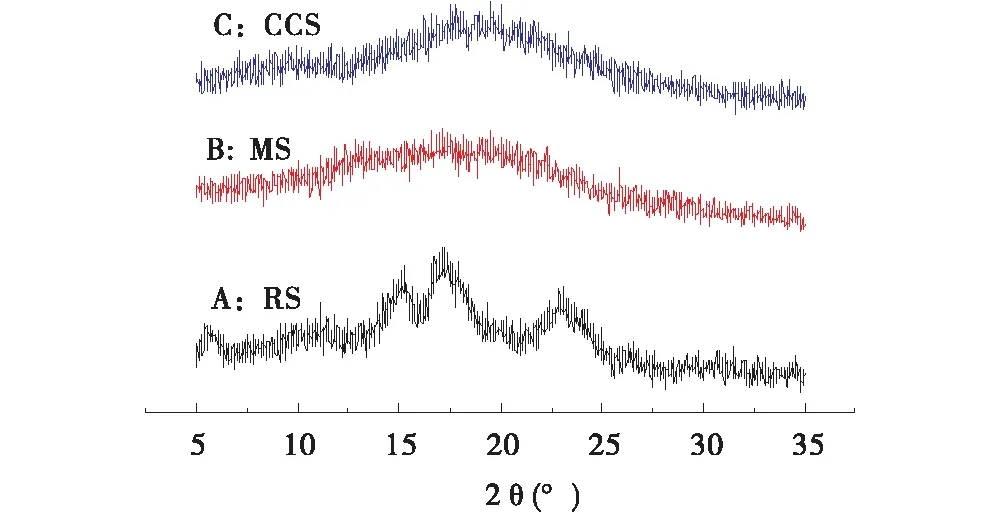
图8 马铃薯淀粉RS、介孔淀粉MS以及交联阳离子淀粉CCS的XRD图Figure 8 XRD of potato starch,mesoporous starch and cross-linked cationic starch
2.9 粒度分布
马铃薯淀粉的粒经区间为15~100 μm,平均粒径约为33 μm[30].表2中,试验测得RS的平均粒经为19.57 μm[30].其中D[4,3]呈现的是递增的趋势,RS、MS、CCS的粒经是逐渐增大的,这可能是由于介孔淀粉以及交联阳离子淀粉表面有孔洞,且孔洞致密且较大时,其整个淀粉颗粒则变大,因而粒经增大.
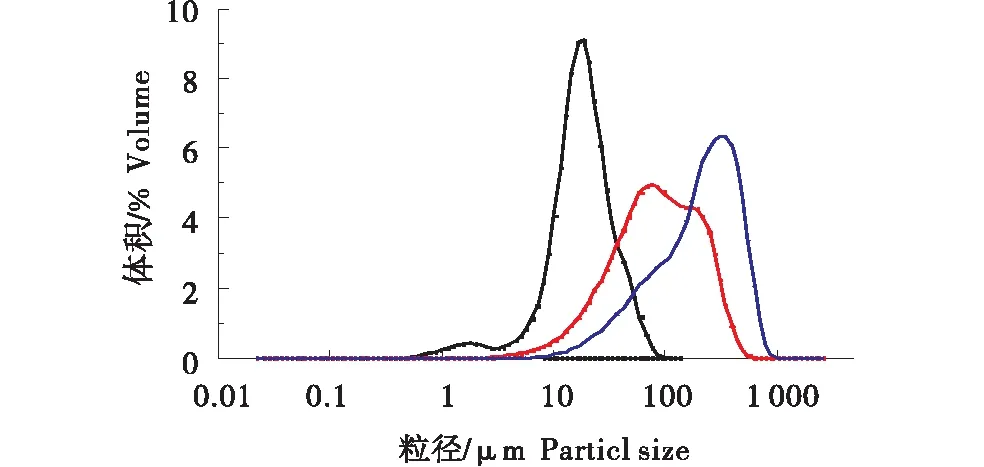
图9 马铃薯淀粉RS、介孔淀粉MS以及交联阳离子淀粉CCS粒径分布Figure 9 Particle size distribution of potato starch,mesoporous starch and cross-linked cationic starch
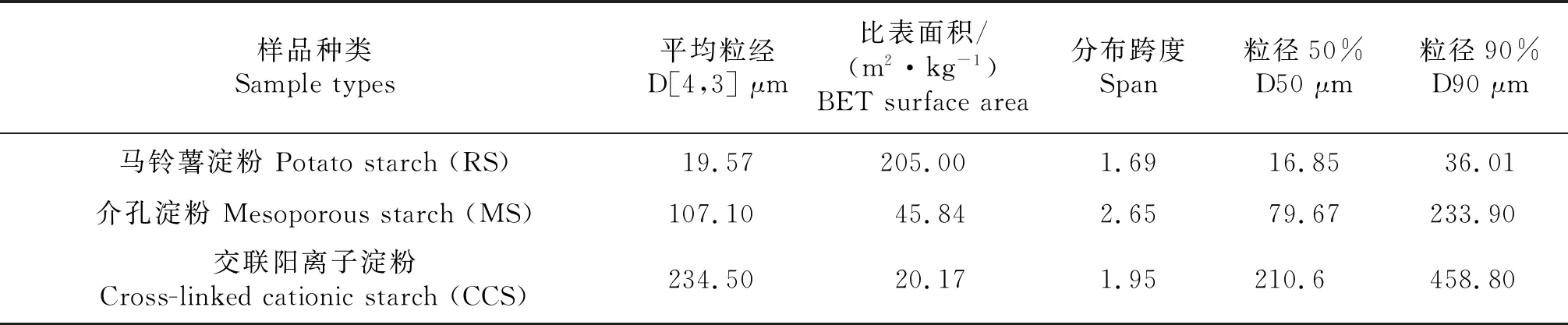
表2 马铃薯淀粉、介孔淀粉以及交联阳离子淀粉粒径分布
3 结论
马铃薯原淀粉用溶剂法制备出孔径为22.66 nm的介孔淀粉,以环氧氯丙烷(EPI)为交联剂制备得到介孔交联淀粉,在3 g介孔交联淀粉,0.2 g NaOH,30 mL H2O和0.75 g GTAC的条件下制得取代度为0.63的介孔阳离子交联淀粉,FTIR以及1NMR也证明了含有正电荷的介孔阳离子交联淀粉制备成功,虽然孔径变大,依然在介孔淀粉孔径范围内;DCS和TGA研究表明,用介孔淀粉制备而成的阳离子淀粉其稳定性和温度有关,高温下介孔淀粉和阳离子交联淀粉不稳定;阳离子淀粉的粒经变大,结晶度消失,成为无定形非晶态结构状态.

