外源硅根施对连作基质栽培黄瓜生长生理的影响
吕剑,郁继华,张国斌,金宁,唐中祺,张婧,张潇丹
(甘肃农业大学园艺学院,甘肃 兰州 730070)
黄瓜(CucumissativusL.)为葫芦科甜瓜属植物,是我国设施栽培面积最大的蔬菜之一[1].戈壁农业是指在非耕地(包括戈壁滩、砂石地和盐碱地等)上,以高效节能日光温室为载体,以基质栽培为核心技术,强调发展节水灌溉,培育高产优质蔬菜瓜果等农产品的新型农业[2].因此,戈壁农业生产中多以有机基质栽培代替天然土壤栽培进行设施蔬菜生产,基质栽培本是缓解设施土壤重度连作障碍的有效途径之一.但因在栽培过程中,需要不断更换基质,从而造成了人力、物力的大量消耗,生产成本增加,农民为片面追求高收益,使得设施基质栽培中黄瓜复种指数过高,由此造成的基质连作障碍已成为设施黄瓜栽培的关键制约因素[3]
Mitani和Ma认为,硅在地上部的积累可能与蒸腾作用、植株生长状态及生长速率等有关,其中根系吸收能力是最重要因素[4].硅可以促进植物生长发育,其对植物生长的促进主要通过增加叶绿素含量、提高叶片光合作用、增强根系活力等途径实现[5].夏石头等的研究表明,硅能使水稻叶片增厚、维管束加粗,穗轴直径增大,叶片细胞内线粒体数量、片层结构及基粒增多,叶绿素含量增加,净光合速率提高[6].硅还提高植物对生物胁迫和非生物胁迫的抵抗能力,主要体现在硅还可沉积在角质层下部,形成角质-硅双层结构,可减少角质蒸腾作用,减轻萎焉现象,从而增强抗旱和抵御病虫害的能力[7-8];外源施硅还可提高土壤栽培下连作黄瓜幼苗抗氧化酶活性、增加其光合作用进而增强黄瓜幼苗对连作障碍的抗性[9].
目前关于外源硅缓解连作障碍的研究主要集中在其他作物[10-11]或黄瓜的土壤连作栽培模式下[9],关于硅对基质栽培黄瓜连作的缓解效应却鲜见报道,而基质栽培相较于土壤栽培存在差异,其持水性、缓冲性较弱,且易干易湿.因此,本试验以‘博耐882’黄瓜幼苗为试材,用酒泉连作8 a黄瓜已产生明显连作障碍的基质作为栽培基质,研究根施不同浓度硅对连作基质栽培黄瓜幼苗生长生理的影响,旨在筛选出适宜的缓解基质栽培黄瓜连作障碍的硅浓度,阐明缓解机制,并为基质栽培黄瓜连作障碍的克服提供新的理论依据.
1 材料与方法
1.1 材料
试验于2019年3~5月在甘肃农业大学现代温室与蔬菜生理实验室进行.采用黄瓜品种‘博耐882’(CucumissativusL.)种子为试验材料,基质取自酒泉连作8 a黄瓜已产生明显连作障碍的连作基质.供试外源硅为化学试剂硅酸钠(Na2SiO3·9H2O;AR,源叶生物).
试验设硅处理浓度分别为CK(0)、A(0.25 mmol/L)、B(0.50 mmol/L)、C(0.75 mmol/L)、 D(1.00 mmol/L)、E(1.50 mmol/L)、F(2.00 mmol/L).黄瓜定植后浇水时将Na2SiO3·9H2O溶入水中,每次处理每盆的灌水量均为1 L,每隔7 d处理1次.
1.2 方法
1.2.1 生长指标的测定 株高:采用卷尺测定子叶下方1 cm至植株生长点.茎粗:采用电子游标卡尺测定子叶下方1 cm处.叶片数:从第一片真叶开始计数,真叶叶长和叶宽大于2 cm时均可计入;干鲜质量测定:定植20 d后,在每组处理中挑选3株测定其干鲜质量,测量地上部及地下部鲜质量后装入信封,然后放入烘箱中调至105 ℃杀青,之后在80 ℃烘至恒质量后用0.001 g的电子天平称其干质量.
根系体积和主根长度的测定:根系体积采用排水法测定,测定时取20 mL量筒,注入10 mL左右的水,记下读数后将干净的根系放入量筒中,当根系完全沉入水中后再次计数,两次之差即为根系体积;主根长度使用直尺测量,测量时将根系拉直,测定茎基部到主根根尖的距离.
1.2.2 生理指标的测定 叶绿素含量的测定:采用乙醇-丙酮混合液比色法[12];丙二醛(MDA)和脯氨酸(Pro)含量的测定:丙二醛(MDA)含量的测定方法采用TBA法(硫代巴比妥酸法),脯氨酸(Pro)含量采用磺基水杨酸提取法[13-14];抗氧化酶活性的测定:超氧化物歧化酶(SOD)测定方法采用NBT(氮蓝四唑)法[15];过氧化物酶(POD)活性测定方法采用愈创木酚(guaiacol)法;过氧化氢酶(CAT)活性测定方法采用紫外吸收法[16].
1.3 数据分析
运用Excel 2010对据进行处理及作图,并用SPSS 19.0进行单因素方差分析,并运用Duncan’s检验法对显著性差异(P<0.05)进行多重比较.
2 结果与分析
2.1 外源硅根施对连作基质栽培黄瓜植株生长的影响
2.1.1 外源硅根施对连作基质栽培黄瓜株高、茎粗、叶片数的影响 由图1可知,随着根施外源硅浓度的增加,黄瓜幼苗株高、茎粗、叶片数均呈现出先上升后下降的趋势.株高、茎粗及叶片数均以处理C最大且显著高于CK,较CK的增幅分别为48.3%、24.4%和47.8%.其中,处理C的株高显著高于其他处理;处理D的茎粗及叶片数与处理C无显著性差异;处理C的叶片数显著高于处理A、B、E和F.说明在一定的浓度范围内,黄瓜的生长指标随着根施外源硅浓度的增加,生长指标呈逐渐上升的趋势,超过一定的范围,则表现为下降的趋势,以硅浓度为0.75 mmol/L时,株高、茎粗和叶片数表现最优.
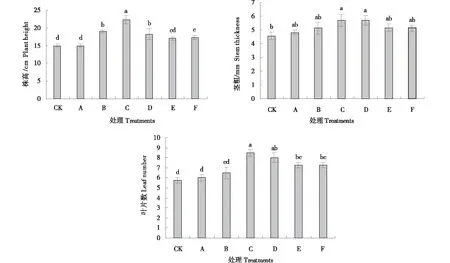
图1 外源硅根施对连作基质栽培黄瓜株高、茎粗、叶片数的影响Figure 1 Effects of exogenous silicon root application on plant height,stem diameter and leaf number of cucumber cultivated in continuous cropping substrate
2.1.2 外源硅根施对连作基质栽培黄瓜植株干鲜质量及根冠比的影响 由表1可知,根施不同浓度的外源硅,黄瓜植株的地上部和地下部的干鲜质量与CK相比均有所提升.其中,处理C地上部鲜质量最大且显著高于CK,较CK增加了1.1倍;且处理C显著高于处理A、B、D、E、F,增幅分别为45.8%、23.7%、24.6%、15.2%、28.2%;处理B、D、E、F之间无显著性差异.各处理的地下部鲜质量均显著高于CK,其中处理C地下部鲜质量最大,是CK的2.9倍;且处理C均显著高于处理A、B、D、E和F.处理C地上部干质量最大且与CK差异显著,较CK增加了104.5%,处理C与处理D、 E之间无显著差异.地下部干质量中处理C最大且显著高于CK,是CK的2.2倍.处理C鲜质量根冠比最高且显著高对照CK,较CK增幅为45.8%;处理A、B、D、E、F与CK无显著性差异;另外,处理C与处理A、D、E、F均无显著差异.

表1 外源硅根施对连作基质栽培黄瓜植株干鲜质量及根冠比的影响
2.1.3 外源硅根施对连作基质栽培黄瓜根系体积和主根长度的影响 由图2可知,不同浓度外源硅处理的黄瓜根系体积均显著高于CK,其中,处理C的根系体积最大,为4.36 ml,与CK相比,处理A、B、C、D、E、F分别提高了28.1%、34.2%、76.0%、72.2%、65.8%、53.2%,但处理C、D、E、F间无显著性差异.不同浓度外源硅处理下的黄瓜根系长度也均显著高于CK,其中处理C分别较处理CK、A、B、D、E、F相比,分别增加了55.0%、25.2%、19.4%、14.0%、12.1%、11.5%;处理B与处理D、E、F无显著性差异.说明随着根施外源硅的浓度增大,其对连作基质栽培黄瓜根系生长抑制作用的缓解效果呈先上升后下降的趋势,当浓度增加到0.75 mmol/L时,缓解效果最好.

图2 外源硅根施对连作基质栽培黄瓜根系体积和主根长度的影响Figure 2 Effect of exogenous silicon root application on root volume and main root length of cucumber cultivated in continuous cropping substrate
2.2 外源硅根施对连作基质栽培黄瓜叶片生理的影响
2.2.1 外源硅根施对连作基质栽培黄瓜叶片叶绿素含量的影响 由图3可知,硅处理C黄瓜叶片叶绿素a、叶绿素b和叶绿素a+b的含量最高,较CK相比,3个指标的增幅分别为68.7%、63.6%和67.3%,与处理B无显著性差异,但二者均显著高于其他5个处理.而类胡萝卜素含量以处理B最大且显著高于CK,较CK提高了46.2%,但与处理C无显著性差异,且处理C较CK的增幅为35.6%,类胡萝卜素从含量最大到小依次为B>C>F>D>E>CK>A.
2.2.2 外源硅根施对连作基质栽培黄瓜叶片MDA和Pro的影响 如图4所示,随着根施外源硅浓度的增加,连作基质栽培黄瓜叶片中的MDA含量呈先下降后上升的趋势,处理B、C的MDA含量无显著性差异,均显著低于对照CK,降幅为30.1%、26.7%.随着根施外源硅浓度的增加,连作基质栽培黄瓜叶片中的Pro含量变化趋势与MDA相似,处理A、B、C、D、E的Pro含量均显著低于与对照CK,分别较CK减少了26.6%、48.3%、49.4%、54.8%和27.4%,处理F与CK差异不显著.以上结果显示,在外源硅浓度为0.75 mmol/L左右时,有效缓解了连作基质栽培所造成的氧化胁迫产物MDA的积累以及渗透调节物质Pro的过量产生.
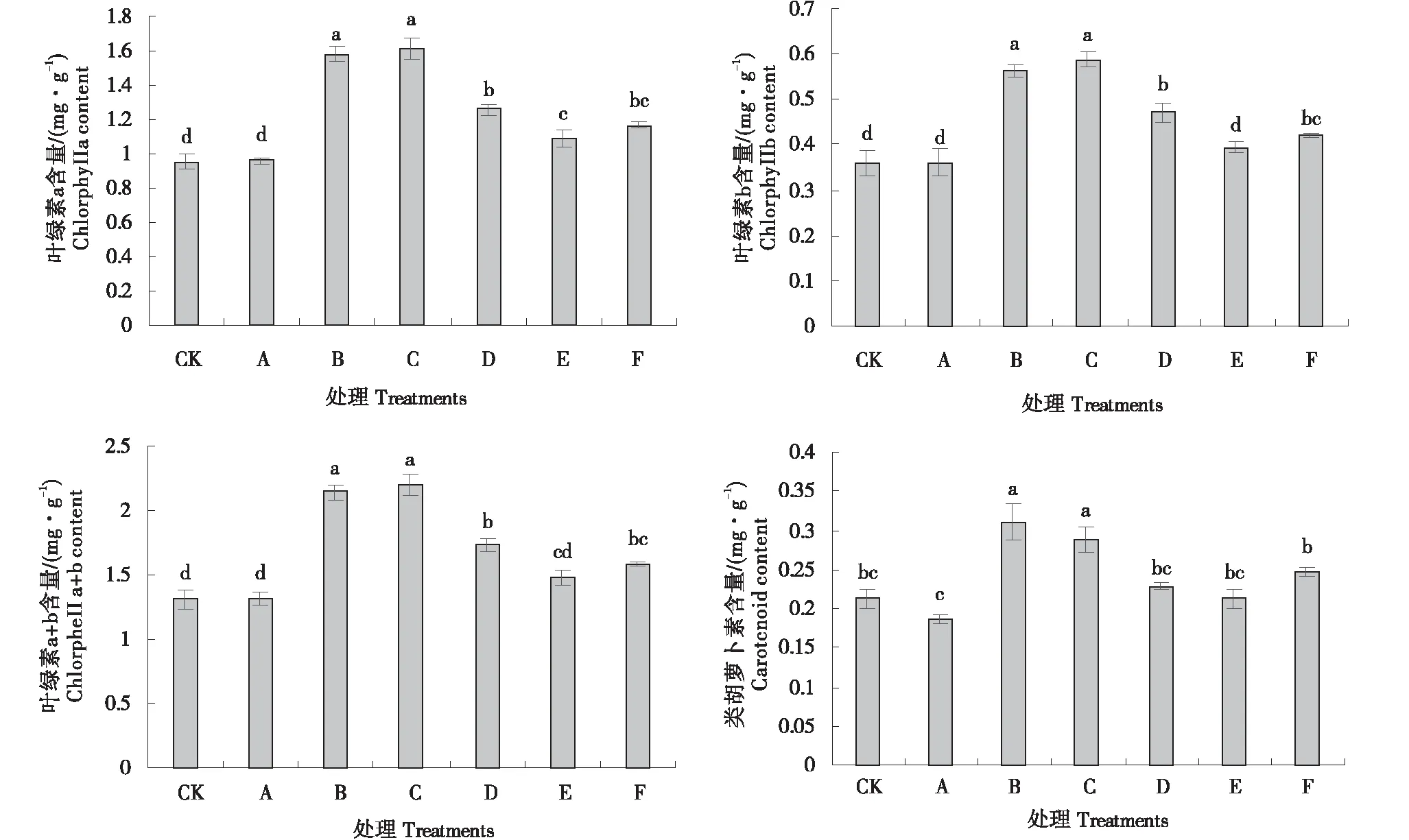
图3 外源硅根施对连作基质栽培黄瓜叶片叶绿素含量的影响Figure 3 Effect of exogenous silicon root application on chlorophyll content of cucumber leaves cultivated in continuous cropping substrate
2.2.3 外源硅根施对连作基质栽培黄瓜叶片抗氧化酶活性的影响 由图5可知,随着根施外源硅浓度的增加,连作基质栽培黄瓜叶片SOD、POD和CAT酶活性均呈先上升后下降的趋势.其中,硅处理B、C、D、E和F的SOD、POD及CAT酶活性均显著高于CK,且均以处理C的酶活性最高,SOD酶活性较CK的增幅为70.9%,POD酶活性是CK的4.5倍,CAT酶活性是CK的3.9倍;处理A的SOD、POD及CAT酶活性均与CK无显著性差异.
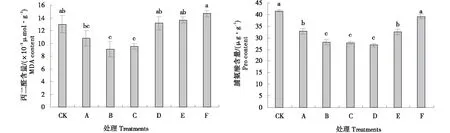
图4 外源硅根施对连作基质栽培黄瓜叶片MDA和Pro的影响Figure 4 Effects of exogenous silicon root application on MDA and pro of cucumber leaves cultivated in continuous cropping substrate

图5 外源硅根施对连作基质栽培黄瓜叶片抗氧化酶活性的影响Figure 5 Effects of exogenous silicon root application on antioxidant enzyme activities of cucumber leaves cultivated in continuous cropping substrate
3 讨论
植株长势强弱的最直观形式就是通过株高、茎粗、叶片数和地上部干鲜质量等生长指标反映的[17].本试验以连作8 a黄瓜的已产生明显连作障碍的基质种植黄瓜,研究表明,外源硅根施能够显著缓解连作障碍对黄瓜植株生长指标的影响,与对照CK相比,各浓度硅处理的黄瓜株高、茎粗、叶片数、地上部干鲜质量均有所提升,且随着根施外源硅浓度的增加,以上指标均表现为先上升后下降的趋势,其中浓度为0.75 mmol/L的硅处理缓解效果最为显著,说明外源硅浓度并不是越高越有利于黄瓜植株的生长,超过一定的浓度范围则表现为抑制植株的生长,这与前人在小麦及生姜上的研究结果一致[18-19].在基质栽培中,连作障碍产生的主要原因是基质理化性质恶化,单一养分的过度消耗,自毒物质的过量积累,因此采用连作基质栽培最先影响的便是植物的根系[20].本试验研究表明,外源硅根施对连作黄瓜的根系体积、主根长度和地下部鲜重均有不同程度的促进作用,其中浓度为0.75 mmol/L的硅处理的根系体积、主根长度及地下部干鲜重较对照CK增幅最大,缓解效果最为显著.
光合色素是植物进行光合作用的物质基础,叶绿素含量的高低决定着植物的代谢水平和有机物的合成能力[21].Mateos-Naranjo等[22]的研究表明,Si能增加高盐胁迫下盐生牧草的株高、茎粗和叶面积,提高叶绿素和类胡萝卜素含量,促进光合作用.本试验中,同样表明,根施不同浓度外源Si可不同程度提高黄瓜叶片中叶绿素和类胡萝卜素含量,其中,以处理浓度为0.75 mmol/L时,黄瓜叶片的叶绿素a、叶绿素b、叶绿素a+b及类胡萝卜素含量最高.Si可提高光合还可能存在的原因有:一是植物吸收的Si在体表面聚集形成硅化细胞,其对散射光的透过量为绿色细胞的10倍,能增加植物叶片对光能的吸收,从而促进光合作用[19];二是,Si沉积于细胞壁与角质层之间,形成角质-硅双层结构,可降低水分散失,而且Si可降低木质部汁液的流速,以此降低蒸腾作用,提高光合速率[23];三是施Si可减少光合“午休”时的谷值,使午休现象不明显,有利于光合产物的积累,进而有利于植株生长[24].
当植物遭受逆境胁迫时,细胞膜结构受损,膜脂过氧化产物MDA含量增多,电解质渗漏率(EL)增加,因此EL和MDA含量可间接作为判断植物受逆境胁迫或细胞膜受伤害程度的指标[25].过量产生脯氨酸等渗透调节物质是植物对环境胁迫一个常见的抗逆机制.这些渗透调节物质在植物中的积累可能涉及一个或多个过程,例如渗透调节、活性氧物质的解毒和蛋白质或酶的稳定,从而有助于提高植物的抗逆性[26].SOD是植物体内清除ROS的第一道防线,可将植物细胞中的O2-歧化为H2O2和O2,H2O2又可在CAT和POD等酶的共同作用下被消除,从而防止水分胁迫等应激条件下造成的细胞损伤[27].其中,CAT可直接分解生成水和分子氧来消除H2O2,因此这种酶不需要还原力,反应速率较高,但对H2O2的亲和力较低,因此只能去除高浓度的H2O2[28].硅缓解环境胁迫的一个重要机制在于它能够增强植物体内的活性氧清除系统活性,能够有效清除活性氧,从而减少植物伤害[29].在水稻上的研究发现,叶面施加纳米硅可增强其SOD、POD和CAT的活性[30],在棉花上的研究发现,施加外源硅能同时增强棉花根和叶中SOD、POD和CAT的活性[31].李清芳等[32]研究发现,施Si使干旱胁迫下玉米叶片POD、SOD和CAT活性提高,抑制了叶片细胞膜透性的增加和MDA含量的升高,从而减轻了自由基对玉米叶片的伤害作用.本试验结果亦表明,与对照相比,施加外源Si可有效降低黄瓜叶片MDA及Pro含量,提高了抗氧化酶SOD、POD及CAT的酶活性,说明根施外源硅可有效清除连作障碍所造成的活性氧的增加,避免细胞受到氧化胁迫,维持细胞膜的完整性.同时本试验中,可以看出,只有外源硅在一定的浓度范围内,才能对基质连作障碍起到一定的缓解作用,以硅处理浓度为0.75 mmol/L时缓解效果最佳,超过则表现为抑制作用,这与金莉等[33]关于外源添加硅对连作基质浸提液抑制黄瓜种子萌发的缓解效应上的研究结果相似.
4 结论
硅处理浓度为0.75 mmol/L黄瓜幼苗株高、茎粗、叶片数、地上地下部干鲜重、根系体积及主根长度的生长指标最优;0.75 mmol/L硅处理的黄瓜叶片的叶绿素a、叶绿素b、叶绿素a+b及类胡萝卜素含量较CK的增幅明显,分别为68.7%、63.6%、67.3%和35.6%;且0.75 mmol/L硅处理的MDA、Pro含量较低且抗氧化酶活性最高,表明0.75 mmol/L硅处理可通过促进黄瓜幼苗的生长,提高叶绿素含量,进而提高光合作用及降低连作造成的氧化胁迫等途径,有效缓解连作基质栽培对黄瓜幼苗生长的抑制作用.综上可知,外源硅根施可有效缓解基质栽培黄瓜的连作障碍,且当外源硅处理浓度为0.75 mmol/L时对黄瓜连作障碍的缓解效果最好,以上研究结果可为黄瓜基质栽培连作障碍的克服提供一定的理论依据.

