术前MRI评估软组织肉瘤根治术后预后
朱汇慈,李晓婷,孙应实
(北京大学肿瘤医院暨北京市肿瘤防治研究所医学影像科,恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142)
软组织肉瘤(soft tissue sarcomas, STS)主要见于四肢和躯干,年发病率约为5/100 000,首选治疗方法是根治手术[1-3]。大部分STS根治术病灶切缘可达到阴性,但部分患者术后仍发生局部复发和转移[4-6],即发生进展,及早识别这部分患者可改善其预后。MRI组织分辨率高,是术前评估STS的最佳方法[1,2,7]。国外已有研究[4,8-9]分析STS术前MRI征象与预后的相关性,国内STS研究更多关注MRI诊断和鉴别诊断。本研究观察MRI评估可切除STS根治术后预后的价值。
1 资料与方法
1.1 一般资料 收集2013年2月—2018年10月70例于北京大学肿瘤医院经手术病理确诊的STS患者,男33例,女37例,年龄8~80岁,平均(46.2±17.8)岁。纳入标准:①接受根治性STS切除术,手术切缘均为阴性,且术后病理除外腹腔/腹膜后STS、韧带样纤维瘤病、腺泡状STS等治疗方案与预后明显不同的病理类型[1,2,10];②术前接受MR检查;③术前影像学检查未发现远处转移[3]。记录患者年龄、性别、手术时间、病理类型、病理分级(G1、G2、G3)、肿瘤部位(上肢、下肢、其他)、术前和术后治疗、随访时间和复发/转移时间。
1.2 仪器与方法 采用Siemens Magnetom Aera 1.5T超导型MR仪或GE Discovery MR 750 3.0T MR仪,配备体部正交线圈或四肢关节专用线圈。以双股骨为例,平扫采用FSE序列,层厚7 mm,层间距1.2 mm,FOV 360 mm×360 mm,矩阵320×192。轴位T1WI:TR 440 ms,TE 8.6 ms;轴位、冠状位和矢状位T2WI:TR 4 400 ms,TE 88 ms;轴位脂肪抑制T2WI:TR 5 470 ms,TE 63 ms,激励次数2。以流率1.5~2.5 ml/s经肘静脉推注对比剂钆喷酸葡胺0.2 mmol/kg体质量后行增强扫描,以Lava-Flex序列采集轴位和冠状位T1WI。
1.3 图像分析 由2名具有5年以上影像学诊断经验的主治医师采用双盲法进行分析。①测量肿瘤长径和短径,取2名医师测量均值;②肿瘤深度:根据轴位T2WI所示浅筋膜位置评估肿瘤深度(皮下或浅筋膜以外、浅筋膜深方)[11];③病灶T2信号均匀程度:于轴位压脂T2WI上评价病灶T2信号均匀程度(分为<50%不均匀和≥50%不均匀);④以增强图像评价肿瘤强化程度(分为强化区域<50%和强化区域≥50%);⑤评价肿瘤边缘是否清晰(分为<50%边缘清晰和≥50%边缘清晰)、是否存在中央坏死(分为不存在、<50%区域坏死和≥50%区域坏死);⑥评价有无瘤周水肿(T2WI上肿瘤周围存在长T2信号区,与肿瘤分界清楚,无占位效应)、瘤周强化(增强图像上肿瘤边缘外存在强化区域)、血管/神经/骨质侵犯(血管/神经侵犯:肿瘤侵犯血管/神经超过180°);评价骨质侵犯:侵犯骨皮质/髓质并出现MRI信号改变)、筋膜尾征(肿瘤边缘超过2 mm厚度的强化筋膜)[4,12-13];⑦评价肿瘤是否存在不同区域浸润(如深部肿瘤侵犯至浅筋膜,后方肌群肿瘤侵犯至前方肌群)[14]。
1.4 随访 术后第1~3年每3~4个月随访1次,复查内容包括查体、胸部X线或CT、对可疑转移部位行MR或超声检查。肿瘤局部复发均经病理证实,肿瘤转移均为影像学检查证实。以患者发生局部复发或转移为观察终点,无复发和转移患者以最后1次随访为终点。
1.5 统计学分析 采用SPSS 22.0统计分析软件。符合正态分布的计量资料以±s表示,否则以中位数(上下四分位数)表示;计数资料以频数表示。以Kappa检验评价2名医师分析结果的一致性,Kappa≥0.75为一致性好,0.40≤Kappa<0.75为一致性中等,Kappa<0.40为一致性差。采用Kaplan-Meier法观察无进展生存期(progression free survival, PFS),以Log-Rank检验及Cox模型(后退法最大似然比)对影响STS根治术后PFS的因素进行单因素和多因素分析。P<0.05为差异有统计学意义。
2 结果
2.1 临床、病理及影像学 70例STS中,16例(16/70,22.86%)发病部位为上肢,46例(46/70,65.71%)为下肢,8(8/70,11.43%)例见于腰背部、肩部、臀部等部位。9例(9/70,12.86%)肿瘤位于浅筋膜以外,61例(61/70,87.14%)位于浅筋膜深方。70例中,滑膜肉瘤16例(16/70,22.86%),多形性未分化肉瘤15例(15/70,21.43%),恶性外周神经鞘瘤10例(10/70,14.29%),纤维肉瘤及原始神经外胚层肿瘤各7例(7/70,10.00%),血管内皮肉瘤4例(4/70,5.71%),去分化脂肪肉瘤4例(4/70,5.71%),恶性纤维组织细胞瘤及平滑肌肉瘤各3例(3/70,4.29%),透明细胞肉瘤1例(1/70,1.43%)。其中8例(8/70,11.43%)病理分级G1,19例(19/70,27.14%)G2,43例(43/70,61.43%)G3。肿瘤平均长径(83.22±46.53)mm,短径(48.08±27.62)mm。
2.2 PFS分析结果 总随访时间12~100个月,中位随访时间28(19,40)个月。随访期间34例(34/70,48.57%)无复发转移,14例(14/70,20.00%)局部复发,22例(22/70,31.43%)远处转移。2例疾病进展时间分别为90和96个月,其余34例中位进展时间为22个月,第1、2、3年PFS患者占比分别为62.86%(44/70)、51.43%(36/70)及51.43%(36/70),见图1。

图1 STS患者根治术后生存曲线
2.3 影响STS根治术后PFS的单因素分析 2名医师分析MRI结果的一致性好(Kappa均>0.75,P均<0.05)。年龄、病理分级、术前有无治疗、肿瘤长径、T2信号均匀程度、瘤周水肿、瘤周强化、血管/神经/骨质侵犯、筋膜尾征、是否存在不同区域浸润均为STS根治术后肿瘤发或转移的影响因素(P均<0.05),见表1。
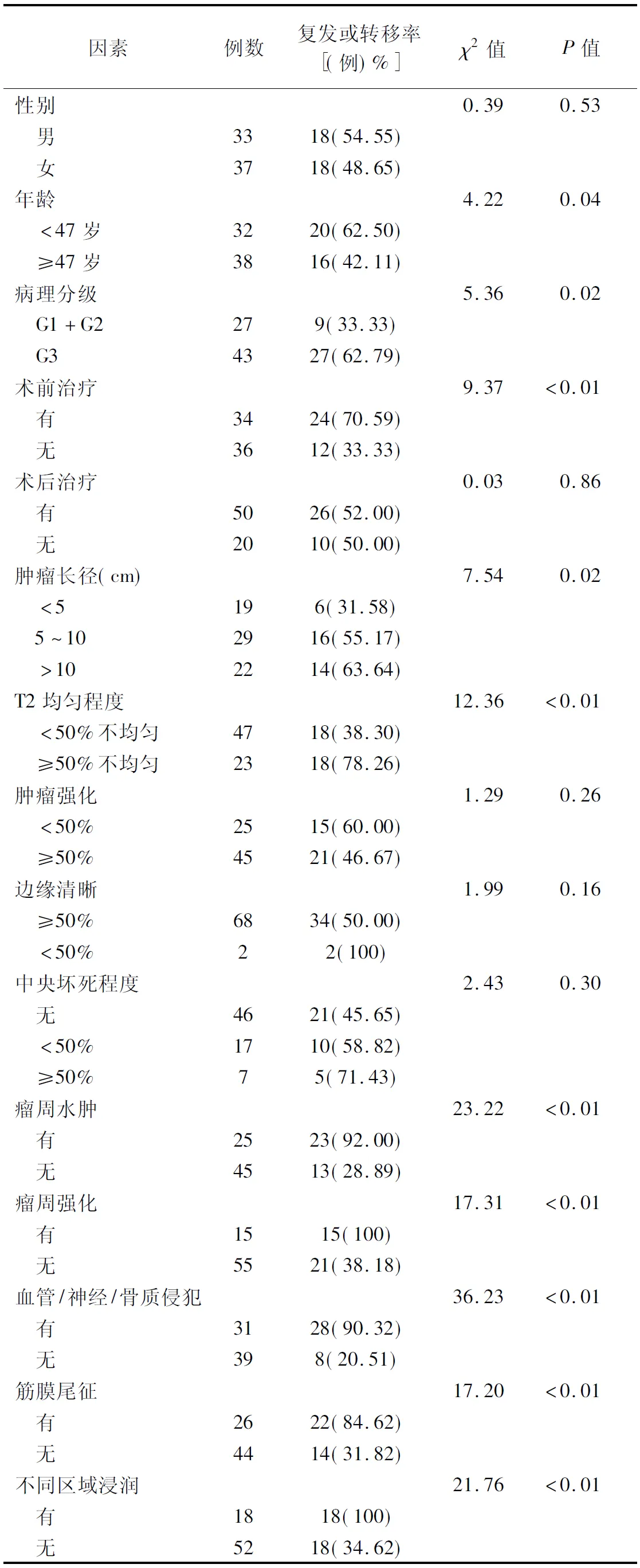
表1 影响STS根治术后肿瘤复发或转移的单因素分析结果
2.4 STS根治术后PFS的多因素分析 肿瘤长径、有无瘤周强化、血管/神经/骨质侵犯是STS根治术后PFS的独立影响因素(P均<0.05),见表2。肿瘤长径越大,术后局部复发和转移机率越高。存在瘤周强化(15/15,100%)或血管/神经/骨质侵犯者(28/31,90.32%)术后局部复发和转移机率明显高于无瘤周强化(21/55,38.18%)或血管神经/骨质侵犯者(8/39,20.51%)。见图2、3。

图2 患者男,52岁,左肩G3级多形性未分化肉瘤 轴位(A)和冠状位(B)增强T1WI示肿瘤(黄色区域)周围左侧斜方肌弥漫强化(箭),伴瘤周强化,术中证实肿瘤广泛侵及周围组织
3 讨论
软组织肉瘤是一类可发生于身体任何部位的恶性肿瘤,包含多种病理类型,术后局部复发率约19.2%~48.9%,远处转移率约19.6%~41.0%[15]。除肿瘤美国癌症联合会分期外[3],患者年龄、病理类型、病变位置和深度、术前/术后放化疗等因素均可能与STS局部复发、转移和生存率密切相关[16]。准确评估STS术后复发/转移危险有助于筛选可能获益于新辅助/术后放化疗或临床试适应证。腹腔/腹膜后STS体积较大,手术较难完整切除,术后较易复发;韧带样纤维瘤病属于良性,临床往往在病灶持续进展时方予药物干预,本研究均予排除。
MRI广泛用于术前诊断STS和术后随访[1,2,4,8]。本研究发现年龄、病理分级、术前有无接受治疗、肿瘤长径、T2信号均匀程度、有无瘤周水肿、瘤周强化、血管/神经或骨质侵犯、筋膜尾征及不同区域浸润均为STS根治术后PFS的影响因素,临床因素分析结果与既往研究[6,15-16]基本一致;肿瘤长径、有无瘤周强化、血管/神经或骨质侵犯是STS根治术后PFS的独立影响因素,与既往研究[15,17]相符,原因可能在于随病变体积增大,肿瘤负荷增加,侵犯邻近结构可能性增大,手术切缘达阴性的可能性降低。

图3 患者女,27岁,左下肢G3级滑膜肉瘤 A、B.轴位增强T1WI示正常右侧股静脉(箭头,A),左侧股静脉内软组织明显强化(箭,B);C.冠状位增强T1WI示肿块(箭头),左侧股静脉内充盈缺损(箭)经病理证实为瘤栓形成
ZHAO等[12]发现MRI所示瘤周强化可能有助于术前鉴别高级别与低级别肉瘤。CROMBÉ等[4]提出3个MRI征象(瘤周强化、坏死、T2信号不均匀>50%)中至少2个阳性提示STS预后较差,本研究结果与之基本一致。本组15例术前MRI存在瘤周强化,术后均出现局部复发或转移(15/15,100%),而无瘤周强化患者术后复发或转移率为38.18%。瘤周强化提示肿瘤呈侵袭性生长,周围生成血管增多,部分血管内可能存在瘤栓,术后复发/转移机会增加。既往研究[18-19]对血管/神经或骨质侵犯的评价标准不一,本研究参考HOLZAPFEL等[13]的标准进行评价。SETSU等[20]认为肿瘤侵犯血管存在独立机制,血管内皮细胞包裹肿瘤细胞可能是术后高复发/转移率的原因之一。
本研究中病理分级G1和G2肿瘤复发/转移率明显低于G3,与既往研究[5-6,15]结果一致,提示分级越高,局部复发和远处转移的风险越高;但多因素分析结果提示病理分级并非STS预后的独立预测因素,与上述研究结果不同,推测原因可能在于本组病例较小,G1+G2与G3分布不均;且部分病理分级是通过术前穿刺或新辅助放射化学治疗后根治手术获得,有所降低[4],导致结果偏差。
综上所述,MRI对可切除STS预后具有重要预测价值;肿瘤长径、有无瘤周强化、血管/神经或骨质侵犯是术后PFS的独立影响因素。

