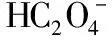分布系数在电解质溶液中的应用
云南 李海春
应用分布系数图判断电解质溶液中粒子浓度的关系是近几年高考常见的考查方式,其中不同条件下粒子浓度关系的判断是高考的亮点和热点。解题的关键是正确判断溶液中溶质的成分及其量的关系,以及粒子的电离程度和水解程度的大小的比较。该题型综合性强、难度较大,主要考查学生的分析推理能力,复习备考中应特别关注。
一、弄清分布系数及分布曲线两个概念
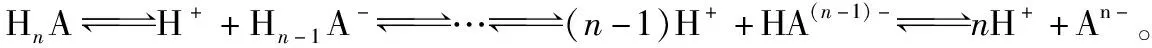
分布系数决定于该物质的性质和溶液的酸碱度,而与其总浓度(又称分析浓度)无关,各种型体的分布系数之和为1。δ仅是pH和pKa的函数,与酸碱的浓度c无关,对于给定弱酸(碱),δ仅与pH有关。
2.分布系数曲线:指以pH为横坐标,分布系数(即组分的平衡浓度占总浓度的分数)为纵坐标的关系曲线。在分布系数图像中,可选取粒子浓度相等的点计算电离常数。
3.示例分析
(1)一元弱酸(以醋酸为例)
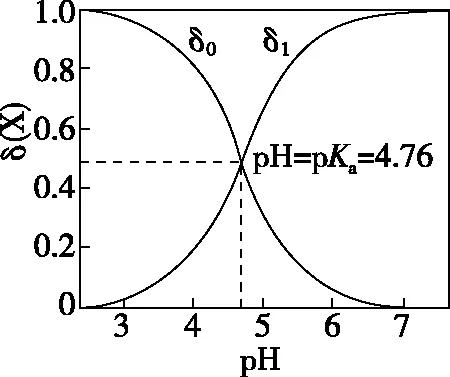
注:pKa为电离常数的负对数
对于总溶质浓度为c的CH3COOH溶液,溶液中与CH3COOH相关的微粒有CH3COOH和CH3COO-两种,则c=c(CH3COOH)+c(CH3COO-),从图中得出:CH3COOH分布系数为δ0,δ0随着pH的升高而减小;CH3COO-分布系数为δ1,δ1随着pH的升高而增大。当pH
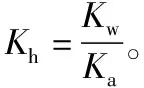
这一结论可应用于任何一元弱酸(碱)的型体分布,只是图中曲线的交点随pKa的不同而左右移动。同时,只要知道某一元弱酸(碱)在一定pH的分布系数和酸(碱)的浓度,就能计算出它在该pH时的各组分平衡浓度。
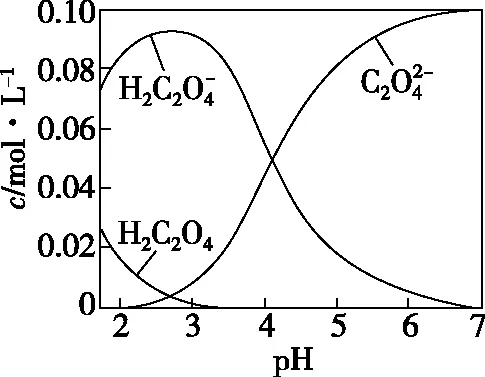
(2)二元弱酸:以草酸为例(碳酸与之相似),其δ与pH曲线如图所示。
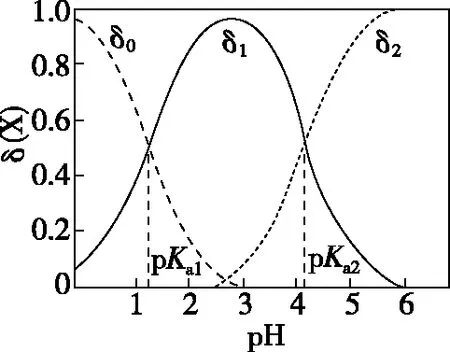
注:pKa为电离常数的负对数
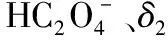
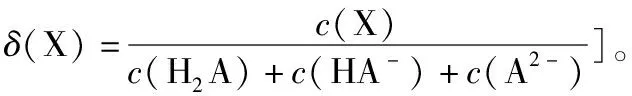
( )
A.pH=1.2时,c(H2A)=c(HA-)
B.lg[K2(H2A)]=-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D.pH=4.2时,c(HA-)=c(A2-)=c(H+)
【答案】D
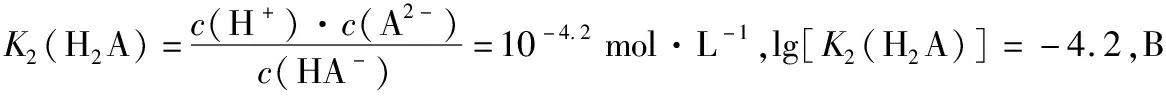

( )

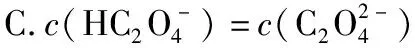
【答案】BD
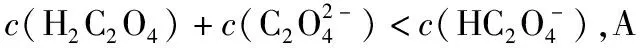
二、考虑两大平衡微弱且竞争的因素
电离平衡和水解平衡是电解质在水溶液中的两大平衡,它们有时单独存在,有时又在溶液中同时存在。若同时存在,电离和水解互相竞争,为确定究竟哪个平衡占优势,要应用化学反应类型,化学计算,甚至还要用到“守恒”进行判断。
1.电离平衡

2.水解平衡

室温下,等体积且物质的量浓度相等的CH3COOH、CH3COONa混合溶液中,由于CH3COOH的电离常数Ka=1.8×10-5,所以CH3COO-的Kh≈5.6×10-10。通过比较Ka与Kh的相对大小知道,CH3COOH的电离占优势,因而混合溶液显酸性。

( )
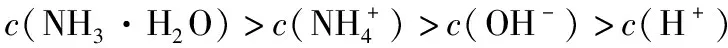
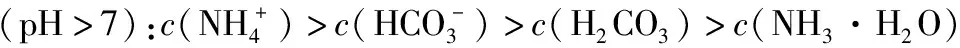
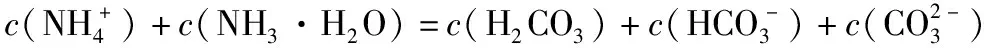
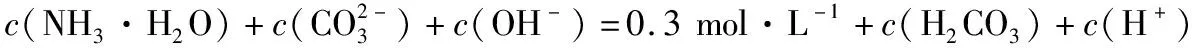
【答案】BD

三、酸碱中和滴定的五个关键点
1.原点:根据原点的pH,可判断酸或碱的酸(碱)性的强弱。
2.“一半”点:判断是什么溶质的等量混合。生成的溶质是什么?根据Ka与Kh的相对大小判断溶液的酸碱性。
3.“恰好反应”点:根据盐类的水解知识判断溶液的酸碱性。
4.“中性”点:生成什么溶质,哪种物质过量或不足。
5.“过量”点:溶液中的溶质是什么。判断哪种物质过量。
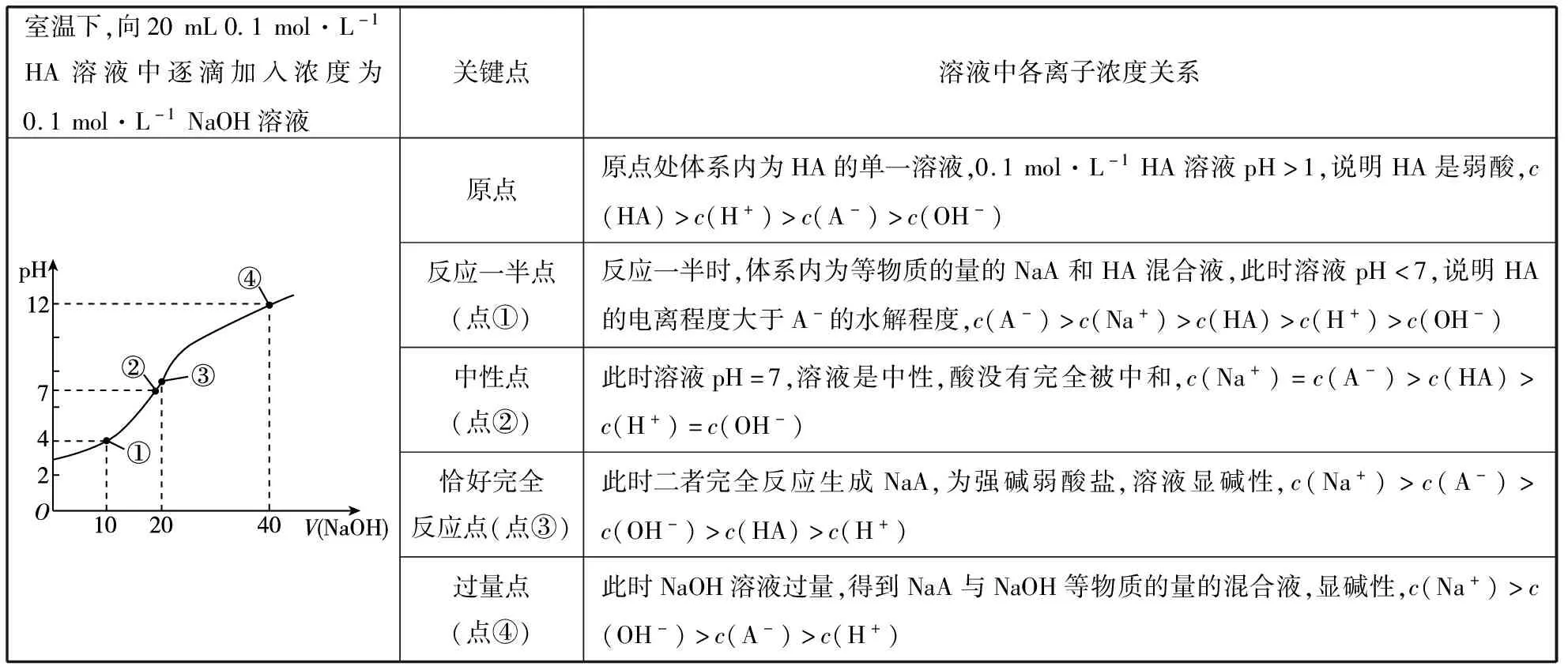
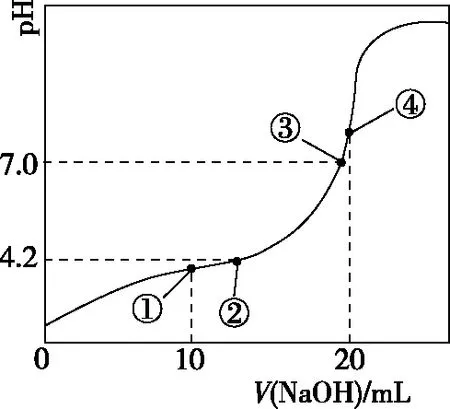
室温下,向20mL0.1mol·L-1HA溶液中逐滴加入浓度为0.1mol·L-1NaOH溶液关键点溶液中各离子浓度关系原点原点处体系内为HA的单一溶液,0.1mol·L-1HA溶液pH>1,说明HA是弱酸,c(HA)>c(H+)>c(A-)>c(OH-)反应一半点(点①)反应一半时,体系内为等物质的量的NaA和HA混合液,此时溶液pH<7,说明HA的电离程度大于A-的水解程度,c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-)中性点(点②)此时溶液pH=7,溶液是中性,酸没有完全被中和,c(Na+)=c(A-)>c(HA)>c(H+)=c(OH-)恰好完全反应点(点③)此时二者完全反应生成NaA,为强碱弱酸盐,溶液显碱性,c(Na+)>c(A-)>c(OH-)>c(HA)>c(H+)过量点(点④)此时NaOH溶液过量,得到NaA与NaOH等物质的量的混合液,显碱性,c(Na+)>c(OH-)>c(A-)>c(H+)
【例4】常温下,Ka1(H2C2O4)=10-1.3,Ka2(H2C2O4)=10-4.2。用0.100 0 mol·L-1NaOH溶液滴定10.00 mL 0.100 0 mol·L-1H2C2O4溶液所得滴定曲线如图。下列说法正确的是
( )
【答案】B