盖斯定律联动Born-Haber循环在高考化学反应热中的应用
云南 刘 芬
盖斯定律在高考中的考查相对比较简单,主要的考查角度为热化学方程式中焓变的判断和计算,以简单的盖斯定律模型解决生产生活中的热化学问题。盖斯定律作为一种抽象的模型或认知模型,可以帮助学生在对热化学现象的解释和研究过程中,对陌生反应的反应热做出推理和预测。通过对工业上涉及的陌生反应进行改编,高考试题在考查学生运用盖斯定律计算反应焓变能力的同时,以新能源的开发利用作为点缀,逐步提升学生的科学态度和社会责任这一核心素养。在盖斯定律的理论基础上,1919年玻恩和哈伯设计出了Born-Haber循环,将一个反应设计成多个分步反应,最终用盖斯定律计算未知的反应热数据。由于该循环与盖斯定律紧密联系,尤其是各部分反应热的含义与《普通高中化学课程标准(2017年版2020年修订)》选择性必修课程模块2物质结构与性质部分知识紧密联系,高考化学的命题会选择比较经典的Born-Haber循环为题干信息或试题情境,设计成考题,考查学生对相关概念的理解和对盖斯定律的运用。Born-Haber循环在全国卷中的考查较少,主要出现在浙江卷中,通过设计多个分步反应,形成一个循环,可以计算、比较分步反应或总反应的反应热。Born-Haber循环体现出的证据推理与模型认知核心素养,联合了化学反应原理和物质结构与性质部分的内容,可以加深学生对基本概念的理解,体现学生接受、吸收、整合化学信息的能力。
1.盖斯定律在高考试题中的考查
1.1 盖斯定律在近3年全国卷中考查的内容
盖斯定律在各地高考题中都有出现,考查频次较多,笔者以近3年全国卷中盖斯定律的考查为例统计分析盖斯定律的考查方式。通过对比,可以发现盖斯定律在全国卷各卷区中都有考查,其中全国卷I的考查方式不固定。2019年全国卷Ⅰ28题(3)联合能垒(活化能)图判断化学反应为吸热反应还是放热反应,2017年全国卷Ⅰ28题(2)考查热化学方程式的书写。全国卷Ⅱ和卷Ⅲ仍以计算焓变为主,在2018年全国卷Ⅱ28题(1),考查盖斯定律联动吉布斯自由能变判断化学反应自发进行的条件。在高考复习中,仍然要注重盖斯定律的应用,尤其在计算反应热方面。
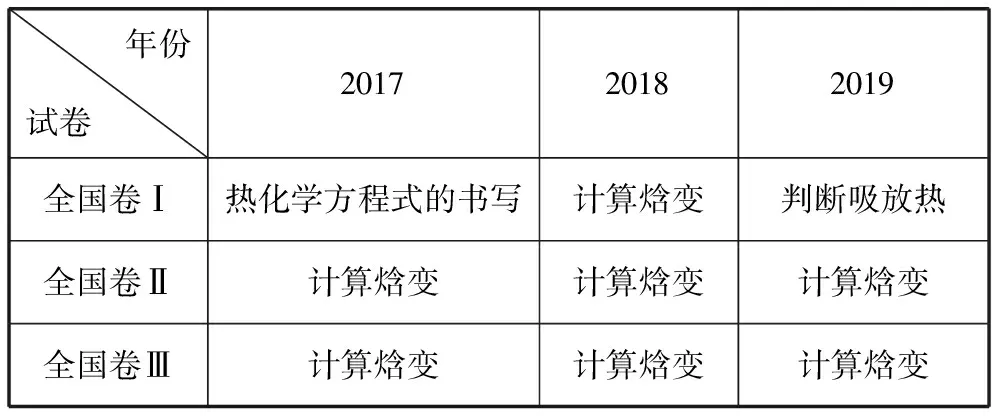
表1 盖斯定律在近3年全国卷中的考查内容
1.2 盖斯定律考查的方式及应对方法
盖斯定律的主要内容为:不管化学反应是一步完成或分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。基于此,高考试题考查了学生运用盖斯定律进行计算的能力,考查学生计算中间反应或总反应的反应热、判断总反应的吸放热情况。
盖斯定律在计算反应热的过程中,常见的有两种方法:观察法和消除法。观察法是通过对比目标方程式与分步方程式中各物质的系数,确定分步反应中相同物质的系数变化,从而确定分步反应的反应热加减情况。消除法主要应用于同一物质出现在多个分步反应中的情境,这时无法通过目标方程式中物质的系数确定分步反应中相同物质的系数变化,只能用消掉中间产物的方法逐步确定各分步反应的反应热加减情况。
【例1】(2018年·全国卷Ⅱ·27题节选)



该催化重整反应的ΔH=________kJ·mol-1。
【答案】247
【解析】目标反应中CH4(g)系数为1,是反应物,在方程式左边,只涉及反应①,故①×(-1)。同理,CO2(g)系数为1,是反应物,在方程式左边,只涉及反应②,故②×(-1)。CO(g)系数为2,是生成物,在方程式右边,只涉及反应③,故③×2。则目标反应的ΔH=-ΔH1-ΔH2+2ΔH3=+247 kJ/mol。
【例2】(2018年·全国卷Ⅰ·28题节选)



【答案】53.1
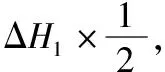
在高考题中为减少学生的思维负担,更倾向于选择第一种类型出题。对于应用消除法的类型,考题也相对简单,涉及2~3个方程式的系数变化。高考中,盖斯定律也会关联其他知识模型来考查学生预测、验证的能力,例如与吉布斯自由能结合起来判断反应进行的方向、推导多重平衡中平衡常数的表达和计算等。
2.Born-Haber循环在高考试题中的考查
2.1 Born-Haber循环在全国卷中的考查
Born-Haber循环是在盖斯定律基础上的延伸和补充,打破盖斯定律的限制,不再局限于实际存在的各种反应间的反应热问题,而是将范围扩大化,可以将一个陌生的、比较复杂的、可能并不存在的反应设计成多个分步的反应途径,对科学研究、实际生产有很重要的指导意义。在近5年的全国卷中,Born-Haber循环出现的顺次并不多,只在2018年全国卷I选修部分35题的(4)中出现。
【例3】(2018年·全国卷Ⅰ·35节选)(4)Li2O是离子晶体,其晶格能可通过图a的Born-Haber循环计算得到。
图a 基于Li2O晶格能的Born-Haber循环

【答案】520 498 2 908
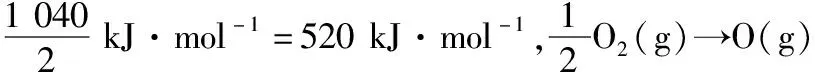
教学过程中,教师可以引导学生自主设计其他晶体(如NaCl)为载体的Born-Haber循环(见图b),加深对各个化学概念的理解,体会科学探究的过程,提升学习化学的热情。
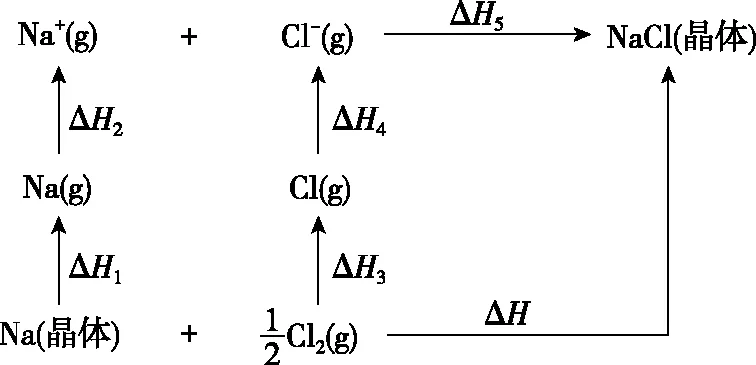
图b 基于NaCl晶体设计的Born-Haber循环
2.2 盖斯定律联动Born-Haber循环在浙江卷中的考查
在近几年的浙江省化学选考卷中,盖斯定律或Born-Haber 循环多次出现在选择题中,一般为第19题、21题或第23题,命题形式多样,多数将两者联合命题,包括晶格能、氢化物水溶液的酸性等,考查焓变大小的比较、各分步反应反应热之间的关系,检测学生对基础概念知识的理解以及运用模型分析、论证的思维方法,体现选拔人才的特性。
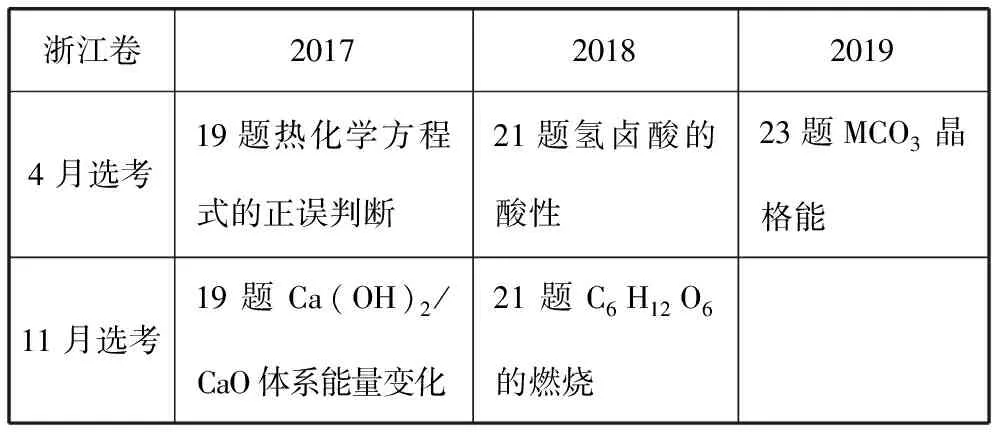
表2 盖斯定律联动Born-Haber循环在2017—2019年浙江卷中的考查
【例4】(2019年4月浙江选考23题)MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):
已知:离子电荷相同时,半径越小,离子键越强。下列说法不正确的是
( )
A.ΔH1(MgCO3)>ΔH1(CaCO3)>0
B.ΔH2(MgCO3)=ΔH2(CaCO3)>0
C.ΔH1(CaCO3)-ΔH1(MgCO3)=ΔH3(CaO)-ΔH3(MgO)
D.对于MgCO3和CaCO3,ΔH1+ΔH2>ΔH3
【答案】C

该题以MCO3的晶格能为载体,设计了Born-Haber循环,通过比较各分步反应热的大小、判断各反应热之间的关系,旨在考查学生灵活应用盖斯定律模型解决问题的能力,也让学生初步了解Born-Haber循环在无机化学中的应用。在高中化学选择性必修课程部分模块1或模块2的教学过程中,可以适当选择相对简单的Born-Haber循环类型,例如以物质的燃烧、晶格能为载体,引导学生理解每一步反应热的含义,学会自主设计简单的Born-Haber循环,逐步学会比较反应热的大小和判断各分步反应间的反应热关系。
3.结语


