品高考真题 探“硫氏盐”的考查方向
江苏 季宗宝 赵王侠
随着新高考改革的不断深化,学科核心素养已经慢慢深入化学教学中,试题也围绕着核心素养的方向进行命制,不再是单纯地知识点的记忆和重复,更多的是以联系生产生活的情境题形式出现,实验探究类题目更加注重“证据推理与模型认知”素养的考查。硫元素作为非金属的代表元素,笔者在对近几年全国卷和地方卷统计分析时发现,直接以单质硫、二氧化硫及硫酸盐形式呈现的命题越来越少,取而代之的是以亚硫酸钠、硫代硫酸钠、焦亚硫酸钠等物质为信息和素材出现,它们是硫氏盐的代表物,在生产生活中有着重要的用途,有逐渐加大考查力度的趋势。下面笔者就三种物质的性质及其用途进行归纳,对三种物质在近三年各地高考试题中的考查情况和命题方向进行了梳理,最后结合真题进行分类解析,以期对各位读者有所帮助。
一、三种硫氏盐的性质及其用途
亚硫酸钠,化学式为Na2SO3,是常见的亚硫酸盐,白色单斜晶体或粉末。亚硫酸钠在空气中易风化并氧化为硫酸钠,在150℃时失去结晶水。受热分解生成硫化钠和硫酸钠,与强酸接触分解成相应的盐且放出二氧化硫。亚硫酸钠还原性极强,可以将铜离子还原为亚铜离子,亚硫酸根可以和亚铜离子生成配合物而稳定存在,也可以还原磷钨酸等弱氧化剂。亚硫酸钠对眼睛、皮肤、黏膜有刺激作用,可污染水源,受高热分解产生有毒的硫化物烟气。工业上主要用于制亚硫酸纤维素酯、硫代硫酸钠、有机化学药品、漂白织物等,还用作还原剂、防腐剂、去氯剂等。
硫代硫酸钠,又名大苏打、海波,化学式为Na2S2O3,常见的硫代硫酸盐,无色透明的单斜晶体或结晶性细粒,无臭,味咸,在干燥空气中有风化性,在湿空气中有潮解性,水溶液显微弱的碱性反应。硫代硫酸钠易溶于水,遇强酸反应产生硫单质和二氧化硫气体,可作为氰化物的解毒剂。主要用于照相业作定影剂,其次作鞣革时重铬酸盐的还原剂、含氮尾气的中和剂、媒染剂、麦秆和皮毛的漂白剂以及纸浆漂白时的脱氯剂。
焦亚硫酸钠,化学式为Na2S2O5,为白色或黄色结晶粉末或小结晶,带有强烈的SO2气味,相对密度为1.4,可溶于水,水溶液呈酸性,与强酸接触则放出SO2而生成相应的盐类,久置空气中会氧化成Na2S2O6,故该产品不能久存,高于150℃分解出SO2。
二、近几年关于硫氏盐的考查情况分析
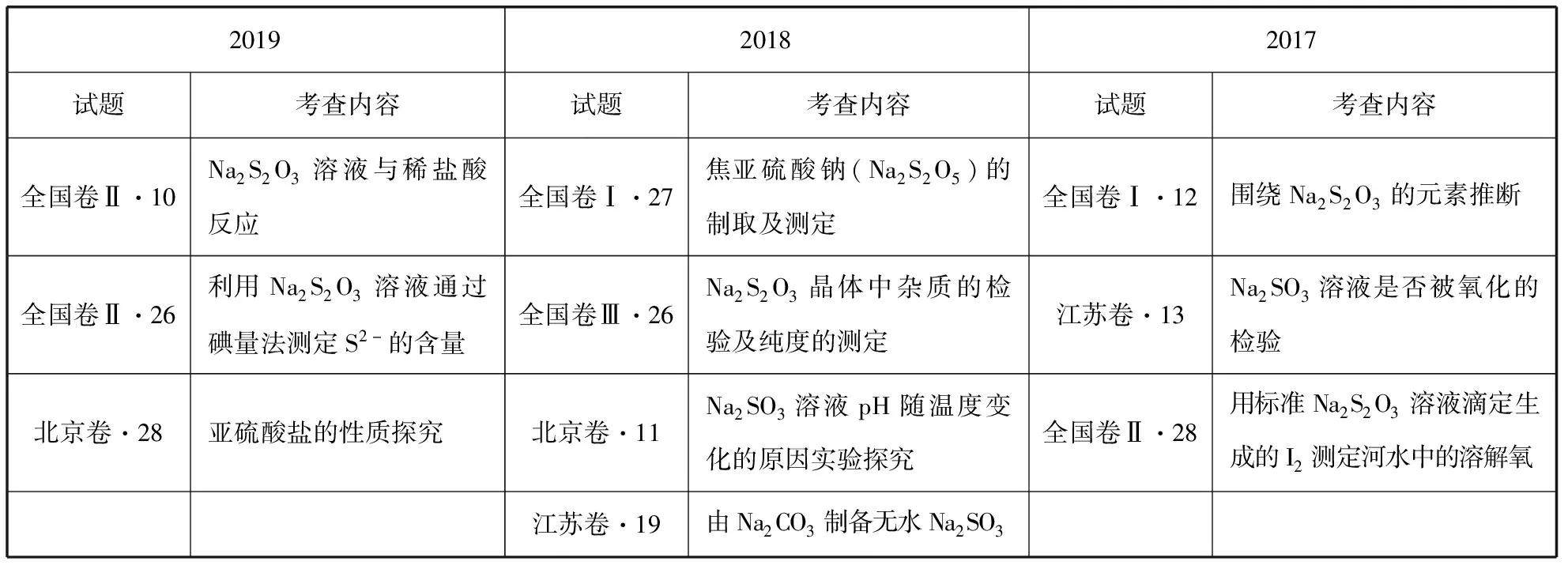
201920182017试题考查内容试题考查内容试题考查内容全国卷Ⅱ·10Na2S2O3溶液与稀盐酸反应全国卷Ⅰ·27焦亚硫酸钠(Na2S2O5)的制取及测定全国卷Ⅰ·12围绕Na2S2O3的元素推断全国卷Ⅱ·26利用Na2S2O3溶液通过碘量法测定S2-的含量全国卷Ⅲ·26Na2S2O3晶体中杂质的检验及纯度的测定江苏卷·13Na2SO3溶液是否被氧化的检验北京卷·28亚硫酸盐的性质探究北京卷·11Na2SO3溶液pH随温度变化的原因实验探究全国卷Ⅱ·28用标准Na2S2O3溶液滴定生成的I2测定河水中的溶解氧江苏卷·19由Na2CO3制备无水Na2SO3
三、命题方向
通过近几年各地试题统计分析可以看出,硫氏盐的考查一般在实验选择题、实验探究题以及工艺流程题中出现,其中Na2SO3主要以性质探究为主的实验综合题形式进行考查,Na2S2O3主要考查其与酸的反应或利用滴定进行定量分析,而Na2S2O5主要以其制备为情境在工艺流程题或实验题中结合其他知识进行考查。
四、试题分类解析
1.在实验操作题中进行考查
【例1】(2019·全国卷Ⅱ·10节选)下列实验现象与实验操作不相匹配的是
( )

实验操作实验现象C向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸有刺激性气味气体产生,溶液变浑浊
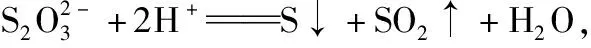
【点评】由此题可以看出对硫代硫酸钠的性质考查已经出现在高考试题中,如果不熟悉硫代硫酸钠的性质,对于此题的解答是有困难的,因此我们在高三复习时不能仅仅局限于单质硫、二氧化硫及硫酸盐等常规知识点的复习,对其衍生的重要化合物也要有所了解,这样才能以不变应万变。
【例2】(2017·江苏卷·13节选)根据下列实验操作和现象所得到的结论正确的是
( )
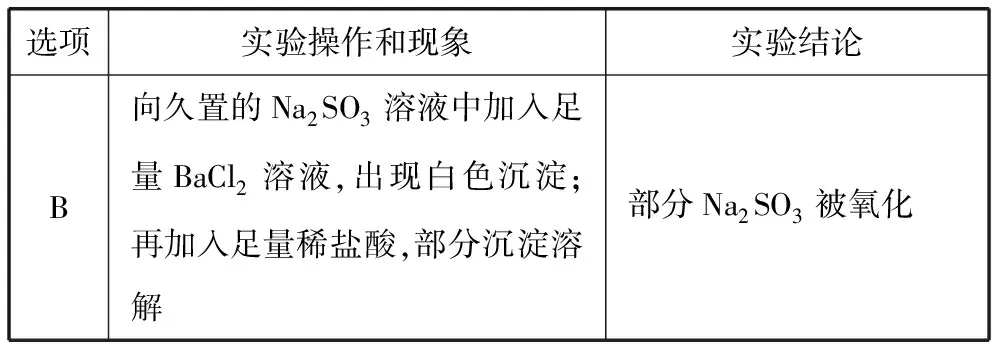
选项实验操作和现象实验结论B向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解部分Na2SO3被氧化
【解析】B项,沉淀部分溶解在足量稀盐酸中,溶解的部分是BaSO3,未溶解部分是BaSO4,说明样品中出现了硫酸钠,即部分样品被氧化,故B项正确。
【点评】Na2SO3溶液的性质是高考的高频考点,因为Na2SO3溶液中硫元素的化合价为+4,它与SO2在很多性质上是相似的,由于它特殊的化合价,使它既具有氧化性又具有还原性,因此很容易结合氧化还原反应知识进行考查。此外此题的考查充分体现了“证据推理与模型认知”的化学核心素养。
【例3】Na2S2O3·5H2O是常用的脱氧剂、定影剂和还原剂。它是无色易溶于水的晶体,不溶于乙醇,Na2S2O3·5H2O在40~45℃熔化,48℃分解。如图是有关物质的溶解度曲线。
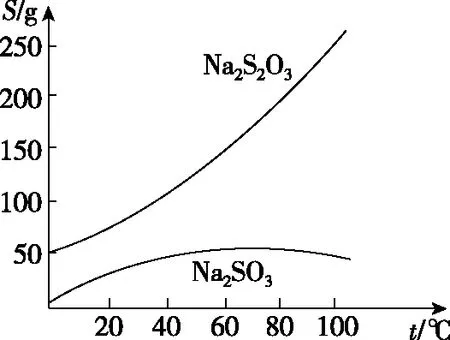
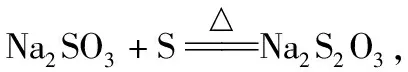
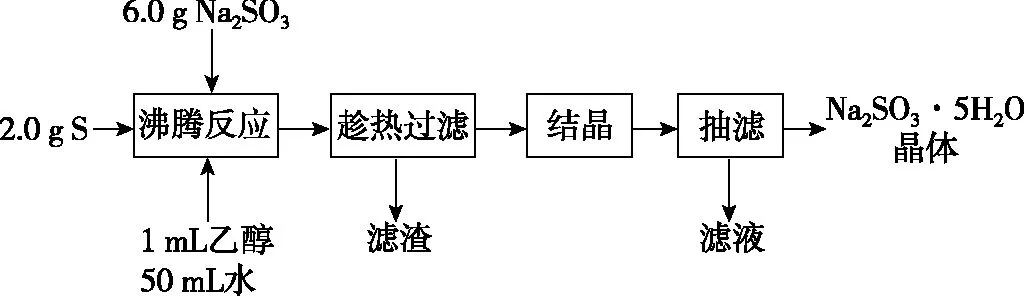
(1)趁热过滤的原因是____________________。趁热过滤后滤渣的主要成分是________(填化学式)。
(2)结晶的方法是______________(填“冷却结晶”或“蒸发结晶”)。
(3)抽滤过程中需要洗涤产品晶体,可采用的洗涤液是________(填字母)。
A.无水乙醇 B.饱和NaCl溶液 C.水
【答案】(1)防止温度降低而使Na2S2O3·5H2O析出 S
(2)冷却结晶
(3)A
【解析】(1)通过溶解度曲线可知,趁热过滤的原因是防止温度降低而使Na2S2O3·5H2O析出,结合题干中化学方程式可知,滤渣的主要成分是S。(2)由于Na2S2O3的溶解度随温度变化差异较大,因此采用冷却结晶的方法。(3)由题干信息“Na2S2O3·5H2O是无色易溶于水的晶体,不溶于乙醇”,可知应该采用无水乙醇来洗涤。
【点评】此题以制备Na2S2O3·5H2O为情境,通过Na2S2O3特殊的性质考查实验的一些基本操作,难度不大,属于基础题,主要考查考生的基本实验能力。
2.结合物质性质及其制备进行考查
【例4】(2018·全国卷Ⅰ·27节选)焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题:
(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式:________________________________________________。
(2)利用烟道气中的SO2生产Na2S2O5的工艺为:
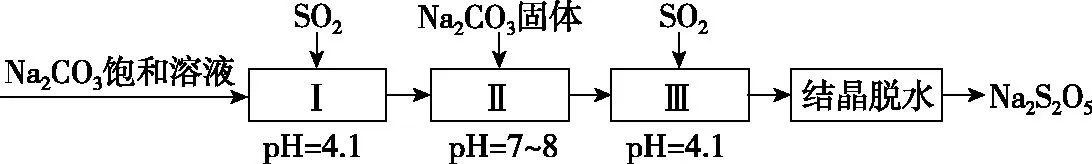
① pH=4.1时,Ⅰ中为________溶液(写化学式)。
②工艺中加入Na2CO3固体、并再次充入SO2的目的是________________________________________________。
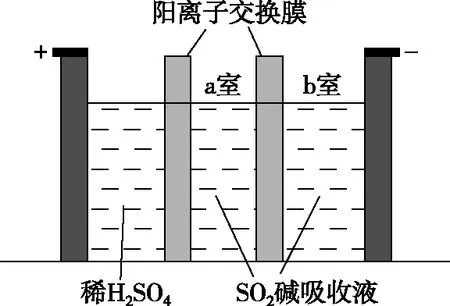
(3)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。阳极的电极反应式为________________________。电解后,________室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5。

(2)①NaHSO3②得到NaHSO3过饱和溶液


【点评】对于三种硫氏盐制备的考查越来越多,试题考查的知识点也越来向着多元化的趋势发展,有的通过化学反应原理结合化学方程式考查,有的结合氧化还原反应考查,还有的像此题结合电化学进行考查,这都要引起我们的注意,解答时要在掌握基本知识的基础上,认真读题,越陌生的题干信息越要读清题意,在题干中寻找蛛丝马迹,再细心答题。
3.利用滴定在化学计算中考查
【例5】(2018·全国卷Ⅰ·27节选)焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题:
(4)Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.010 00 mol·L-1的碘标准液滴定至终点,消耗10.00 mL。滴定反应的离子方程式为____________________,该样品中Na2S2O5的残留量为________g·L-1(以SO2计)。
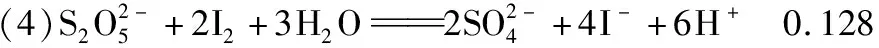

【例6】(2017·全国卷Ⅱ·28节选)水中溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化,滴定

回答下列问题:
(4)取100.00 mL水样经固氧、酸化后,用amol·L-1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为________________________;若消耗Na2S2O3溶液的体积为bmL,则水样中溶解氧的含量为________mg·L-1。
(5)上述滴定完成后,若滴定管尖嘴处留有气泡会导致测量结果偏________(填“高”或“低”)。
【答案】(4)当最后一滴标准液滴入时,溶液由蓝色变为无色,且半分钟内无变化 80ab(5)低
【解析】(4)第一空对滴定现象的考查,化学用语必须使用规范,应写成“当最后一滴标准液滴入时,溶液由蓝色变为无色,且半分钟内无变化”;第二空,根据得失电子守恒,写出关系式O2~2MnO(OH)2~2I2~4Na2S2O3,可得水中溶解氧的含量为[(ab×10-3)÷4×32×10-3]÷0.1=80ab。(5)终点读数时有气泡,气泡占据液体应占有的体积,会导致所测溶液体积偏小,最终结果偏低。
【点评】通过以上二题可以发现,利用Na2S2O3或Na2S2O5进行滴定来计算样品的含量已经成为高考化学常见的考查方式,在全国卷各卷区中几乎都会出现,并关联对滴定知识的考查,如滴定的现象、误差分析等。对于利用滴定来计算样品含量的解法,详见本文作者在《教学考试》杂志(2020高考化学1期)的《例谈化学计算题的类型及解题方法》,在这里就不展开叙述了。

——硫代硫酸钠

