平衡思想在高中化学试题中的体现
上海 樊亚军
平衡思想在高中化学中涉及很多,例如化学平衡、电离平衡、水解平衡、难溶电解质的溶解平衡等,这其中是以化学平衡为起点,化学平衡中所学习的勒夏特列原理是高中阶段判断平衡移动方向问题的重要手段,平衡常数经常用来解决定量问题。不同的平衡之间既有共性,也有不同,以下是高中化学学习中几种常见情况:
一、化学平衡
化学平衡是研究其他平衡问题的基础,具体分析问题过程中,首先应书写对应平衡,然后寻找影响化学平衡的条件,根据勒夏特列原理判断平衡的移动方向。
【例1】(2020·北京人大附中高三3月考试·14改编)某小组为探究AgNO3溶液和不同类型盐溶液反应的多样性,设计如下实验:
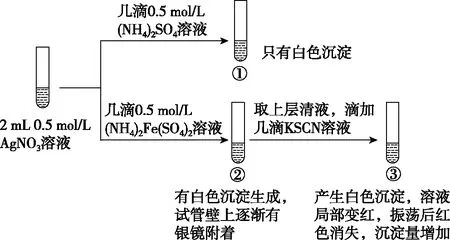
已知:AgSCN为白色难溶物;(SCN)2与卤素单质性质相似,(SCN)2为有色物质。
(5)对于③中红色褪去的原因及Ag+与SCN-反应的情况,小组进行以下分析和设计:
Ⅰ.甲同学认为,红色褪去的原因与平衡移动原理有关,解释为________________________________________________。


【备考提示】对于化学平衡问题,首先应找到题目所涉及的具体化学平衡及该平衡对应的反应,其次需要分析影响化学平衡的因素,如浓度、温度、压强等哪些发生了变化,最后用化学平衡移动原理进行解释分析。
【例2】(2018·四川成都外国语学校3月考试·11改编)为研究沉淀的生成及其转化,某小组进行了如下实验。

其中能证明Ag+(aq)和SCN-(aq)的反应为可逆反应的实验环节为
( )
A.实验① B.实验①②
C.实验①③ D.实验①②③
【答案】B
【解析】解题时要关注题目中所体现出的反应物的相对量,由于实验①中Ag+过量,则实验③中加入KI溶液一定会产生黄色沉淀,不能说明Ag+和SCN-的反应为可逆反应,实验②中溶液变红,说明在Ag+过量的情况下,依旧有SCN-剩余,进而说明Ag+和SCN-的反应为可逆反应。
二、电离平衡
针对电离平衡移动首先要用好“越稀越电离”“越热越电离”等规律,其次要分清楚物质的量变化与物质的量浓度变化的区别,尤其两者在加水稀释过程中的变化往往不同步。浓度比值是较难的部分,在通常情况下要将浓度之比转化成同溶液中的微粒物质的量之比进行判断。

( )
A.加水稀释或加入少量CH3COONa晶体时,CH3COOH电离程度变大
B.加水稀释或加入少量CH3COONa晶体时,都会引起溶液的pH增大
【答案】B、C
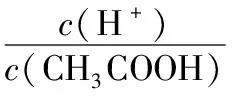
【备考提示】判断电离平衡相关问题时,应该先通过条件变化判断平衡移动方向,再分清主要影响因素和次要影响因素,即哪些是主要引起变化的量,哪些是“减弱”这种变化的量。分清楚具体的物质的量变化和浓度变化,两者在加水过程中往往不统一。在同一溶液中,由于离子浓度往往同时减小或同时变大,将浓度之比转化成物质的量之比往往有利于解决此类问题。

( )
A.加水,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH增大
C.滴加新制氯水,平衡向左移动,溶液pH减小
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
【答案】C
【解析】加水稀释,促进H2S电离,氢离子物质的量变大,但氢离子浓度减小,A错误;SO2与H2S反应生成S和H2O,平衡逆向移动,但相同条件下亚硫酸酸性强于氢硫酸,通入过量SO2,最终溶液pH比原来小,B错误;氯气和H2S反应生成S和HCl,H2S浓度降低,平衡逆向移动,体系中主要的溶质由弱酸变为强酸,pH减小,C正确;铜离子与硫离子生成硫化铜沉淀,平衡正向移动,酸性增强,氢离子浓度变大,D错误。
【例5】(2014·上海模高考·31节选)硫化氢具有还原性,可以和许多氧化剂反应。
(2)向ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加一定量的氨水后,生成ZnS沉淀,用电离平衡原理解释上述现象:________________________________________________。
【答案】饱和H2S溶液中电离产生的S2-浓度很低,因此没有沉淀。加入氨水后,发生反应消耗H+,H+浓度降低,H2S的电离平衡正向移动,S2-浓度增大,产生ZnS沉淀
【解析】与此问题类似还有CO2(或SO2)通入氯化钙(或氯化钡)溶液中无沉淀产生,再通入NH3,则产生白色沉淀碳酸钙(或碳酸钡)。
三、水解平衡
水解平衡移动要首先熟悉“越弱越水解”、“越稀越水解”、“越热越水解”等规律,其次应该根据题目中所涉及的条件改变,依据化学平衡移动原理分析平衡移动方向。如果要进行完全的双水解,一般需要生成两种沉淀或一种沉淀和一种气体。
【例6】(2017·上海虹口区高三二模·25)将硫化钠溶液滴入氯化铝溶液中,产生白色沉淀,同时有臭鸡蛋气味的气体生成,用平衡移动原理解释上述现象:________________________________________________。

【解析】S2-水解先产生HS-,HS-水解再产生H2S;Al3+水解产生Al(OH)3;一种可以产生沉淀,一种可以产生气体,符合进行彻底双水解的条件,两者水解产生的氢离子和氢氧根离子中和,水解平衡向右移动,使水解进行彻底,产生白色沉淀氢氧化铝和气体硫化氢。
【备考提示】对于水解问题,首先应该找到具体水解反应的物质,分清到底是一种微粒水解,还是双水解,是不完全的双水解,还是完全的双水解。对于一种微粒水解,应该找到对应影响水解平衡的条件,依据平衡移动原理,找到平衡移动的方向,对于完全的双水解,应该通过相互促进,进行彻底反应的分析。其次,具体解决问题时,还要依据题目意图,兼顾考虑双水解和直接生成沉淀的竞争情况。
【例7】(2016·甘肃永昌一中高三上学期期末·11)为除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后,再加入适量的盐酸,这种试剂是
( )
A.NH3·H2O B.NaOH C.Na2CO3D.MgCO3
【答案】D

四、难溶电解质的溶解平衡
难溶电解质的溶解平衡相比较其他几种平衡问题较为抽象,很多时候题目中所涉及的溶解平衡并不常见,往往是在一个具体工业生产或实验过程中所涉及的平衡,因此,大部分题目会将溶解平衡表达式列出,在分析具体问题时,应该结合题中信息,推测平衡移动的方向。


(1)盛装新制定影液的试管为________(填“A”或“B”),若继续向该试管中滴加AgNO3溶液,将出现的实验现象是
________________________________________________。
(2)结合化学平衡移动原理解释试管A中产生现象的原因:________________________________________________。
【答案】(1)B 随滴加AgNO3的量的增加,溶液中产生白色沉淀,然后变黑

【备考提示】溶解平衡相关试题一般会在题干信息中列出平衡表达式,只需要结合题目所给实验现象进行分析整理,判断出平衡移动方向,进而得出结论。需要注意的是,溶液中的反应往往是向着溶液中离子浓度降低的方向进行的,如果有两种都可以沉淀的反应,应该是以生成溶解度更小的沉淀反应为主。
【例9】(2018·北京西城区高三二模·27节选)工业上用含三价钒(V2O3)为主的某石煤为原料(含有Al2O3、CaO等杂质),钙化法焙烧制备V2O5。
转沉:将浸出液中的钒转化为NH4VO3固体,其流程如下:

已知CaCO3的溶解度小于Ca3(VO4)2。向Ca3(VO4)2沉淀中加入(NH4)2CO3溶液,可使钒从沉淀中溶出。结合化学用语,用平衡移动原理解释其原因:________________________________________________。




