siRNA介导Rsf-1/HBXAP对子宫内膜癌细胞生物学功能的影响
王孟君,刘从会,张娟,尹红
(安康市中心医院妇科,陕西 安康 725000)
子宫内膜癌是女性常见的恶性肿瘤之一,在生殖系恶性肿瘤中排名第二,仅次于子宫颈癌,近年来有上升趋势且年轻化,引起临床工作者和科研工作者的重视[1-2]。目前手术仍是子宫内膜癌的主要治疗方式,其他单纯放化疗及激素治疗效果欠佳,分子诊疗仍无明显进展[3-4]。染色体空间重组因子1(remodeling and spacing factor-1,Rsf-1;又名hepatitis BX-antigen associated protein,HBXAP)是人类核心组蛋白及染色质组装相关因子家族重要成员之一,位于人染色体11q13.5上,最早在人HeLa细胞核中发现,是人体肿瘤最常见扩增区域之一[5]。近年来研究发现,Rsf-1/HBXAP在乳腺癌、卵巢癌、子宫颈癌、胃癌及肺癌等恶性肿瘤中均高表达,多以“促癌基因”角色参与肿瘤的发生、发展[6-7]。但目前关于其与子宫内膜癌的研究较少见。本研究通过免疫组织化学(immunohistochemistry,IHC)和实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)检测子宫内膜癌组织和细胞中Rsf-1/HBXAP表达情况,利用小干扰RNA(small interfering RNA,siRNA)沉默Rsf-1/HBXAP并探讨其对子宫内膜癌细胞增殖、凋亡和侵袭的影响。
1 资料与方法
1.1一般资料 选取2016年2月至2018年3月安康市中心医院收治的80例子宫内膜癌患者作为研究对象,年龄25~68岁,TNM分期Ⅰ~Ⅱb期,患者均行手术治疗,且病理结果确诊为子宫内膜癌,病理科保存有癌组织和癌旁正常组织蜡块者;排除合并其他恶性肿瘤者。本研究通过安康市中心医院伦理委员会批准,患者均签署了知情同意书。
1.2试剂与仪器 子宫内膜癌细胞系Ishikawa细胞和HEC-1-A细胞均购自中国科学院上海生命科学院生化细胞所,脂质体Lipofectamine 2000、总RNA提取试剂盒、逆转录试剂盒和Applied BiosystemsTMSYBRTMGreen试剂盒均购自美国Thermo Fisher Scientific公司(批号:4368702);Rsf-1/HBXAP、兔抗人单克隆抗体和鼠抗兔二抗均购自美国Abcam公司;细胞计数试剂盒-8(cell counting Kit-8,CCK-8)和细胞凋亡试剂盒购自美国ABI公司(批号:EC008);Transwell小室购自美国BD公司;Rsf-1/HBXAP引物及对应siRNA均由山东维真生物科技有限公司完成。Light Cycle PCR仪购自瑞士Roche公司;IX51型号倒置荧光显微镜购自日本Olympus公司;CytoFLEX流式细胞仪购自美国Beckman公司。
1.3方法
1.3.1IHC检测Rsf-1/HBXAP蛋白表达 从石蜡包块中切取组织切片,并严格按照说明书进行脱蜡、水化、抗原修复、添加一抗(1∶300)、添加二抗、二氨基联苯胺染色、复染、脱水、透明及封片,最后由两名高级病理科医师进行镜检判断(始终保持双盲原则)。判断方法:由以上医师在每张玻片上选取具有代表性的5个高倍镜视野进行观察计数,Rsf-1/HBXAP蛋白主要位于细胞质,肿瘤细胞胞质呈棕黄色为阳性细胞,根据着色强度不同记分:棕褐色3分、棕黄色2分、淡棕黄色1分和无着色0分;根据着色细胞数不同记分:无阳性细胞0分、≤10% 1分、11%~50% 2分、51%~75% 3分和>75% 4分;将着色强度计分和着色细胞数计分相乘>3分者为阳性,阳性率=阳性例数/总例数×100%[8]。
1.3.2细胞培养 Ishikawa细胞和HEC-1-A细胞均接种于10%胎牛血清-高糖杜尔贝科改良伊格尔培养基上,并于5% CO2、37 ℃、饱和湿度培养箱进行培养。
1.3.3qRT-PCR检测Rsf-1/HBXAP mRNA表达 取对数生长期子宫内膜癌Ishikawa细胞和HEC-1-A细胞进行单细胞重悬,调整细胞密度为1×105个/L,取1 mL细胞重悬液检测Rsf-1/HBXAP mRNA,严格按照说明书进行总RNA提取、cDNA制备和qRT-PCR,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为参考基因,分析Rsf-1/HBXAP mRNA相对表达水平(2-ΔΔCt,ΔCt=Rsf-1/HBXAPCt-GAPDHCt),其中Rsf-1/HBXAP上游引物为5′-G ATACTATGCGTCTCCAGCCAA-3′,下游引物为5′-CAACTCGTGTTTCGATTTCTGACAA-3′。选取Rsf-1/HBXAP mRNA含量高的子宫内膜癌Ishikawa细胞进行后续实验。
1.3.4细胞分组和siRNA转染 将Ishikawa细胞共分为3组[9]:siRNA-Rsf-1/HBXAP组、阴性对照组和空白对照组,其中siRNA-Rsf-1/HBXAP组转染Rsf-1/HBXAP-siRNA,阴性对照组转染阴性对照-siRNA,空白对照组转染等量0.9%氯化钠溶液,转染具体步骤参照脂质体Lipofectamine 2000试剂说明书进行,转染完成后继续进行细胞培养,荧光显微镜下观察转染情况,并用qRT-PCR检测各组细胞Rsf-1/HBXAP mRNA表达水平以确认转染是否成功。
1.3.5CCK-8法检测细胞增殖 分别取转染完成后第1天、第3天和第5天对数生长期的siRNA-Rsf-1/HBXAP组、阴性对照组和空白对照组细胞进行单细胞重悬,并调整其密度,后将其置于96孔板上,保证每孔1×103个,严格按照说明书向每孔中添加10 μL CCK-8溶液,继续培养2 h后将其置于酶标仪450 nm处检测各孔吸光度值(optical density,OD)。实验重复3次。
1.3.6流式细胞仪检测细胞凋亡 分别取转染完成后第1天、第3天和第5天对数生长期的siRNA-Rsf-1/HBXAP组、阴性对照组和空白对照组细胞进行单细胞重悬,并调整其密度,后将其置于96孔板上,保证每孔1×105个,继续培养待细胞融合度为80%时参照操作说明书分别添加碘化丙啶和膜联蛋白进行染色(标记荧光素异硫氰酸荧光素),1 h后将其置于流式细胞仪中进行检测并计算细胞凋亡率。实验重复3次。
1.3.7Transwell法检测细胞侵袭 分别取转染完成后第1天、第3天和第5天对数生长期的siRNA-Rsf-1/HBXAP组、阴性对照组和空白对照组细胞进行单细胞重悬,并调整其密度为1×108个/L,将100 μL细胞置于Transwell小室上层(不含基质胶),将500 μL杜尔贝科改良伊格尔培养基溶液(含20%胎牛血清)置于Transwell小室下层,继续培养2 d,用棉签抹去小室上层细胞后将其固定,缓冲液洗涤后用0.1%结晶紫染色,后于倒置显微镜下随机选取10个视野进行细胞计数,取平均值为最终结果。实验重复3次。
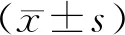
2 结 果
2.1子宫内膜癌癌组织和癌旁正常组织中Rsf-1/HBXAP蛋白比较 子宫内膜癌癌组织Rsf-1/HBXAP蛋白阳性率高于癌旁正常组织[77.50%(62/80)比18.75%(15/80)](χ2=55.303,P<0.001)。见图1。
2.2不同子宫内膜癌细胞系Rsf-1/HBXAP mRNA比较 子宫内膜癌Ishikawa细胞和HEC-1-A细胞Rsf-1/HBXAP mRNA表达水平分别为1.34±0.16和1.02±0.28,比较差异有统计学意义(t=9.923,P<0.001)。

1a:子宫内膜癌癌组织Rsf-1/HBXAP蛋白阳性;1b:子宫内膜癌癌组织Rsf-1/HBXAP蛋白阴性
2.3各组细胞Rsf-1/HBXAP mRNA比较 siRNA-Rsf-1/HBXAP组、阴性对照组和空白对照组细胞Rsf-1/HBXAP mRNA分别为0.22±0.04、1.37±0.17和1.30±0.15,3组比较差异有统计学意义(F=103.482,P<0.001),其中siRNA-Rsf-1/HBXAP组低于阴性对照组和空白对照组(P<0.01),说明转染成功,转染72 h后各组荧光显微镜下图见图2。
2.4沉默Rsf-1/HBXAP对子宫内膜癌细胞增殖的影响 第1天、第3天、第5天细胞OD值的主效应差异有统计学意义(P<0.05);不考虑测量时间,各组间细胞OD值的主效应差异有统计学意义(P<0.05);细胞OD值的组间和时点间存在交互作用(P<0.05),各组第3天、第5天细胞OD值呈升高趋势,siRNA-Rsf-1/HBXAP组各时点间OD值低于空白对照组和阴性对照组(P<0.05)。见表1。
2.5沉默Rsf-1/HBXAP对子宫内膜癌细胞凋亡的影响 第1天、第3天、第5天细胞凋亡率的主效应差异有统计学意义(P<0.05);不考虑测量时间,各组间细胞凋亡率的主效应差异有统计学意义(P<0.05);细胞凋亡率的组间和时点间存在交互作用(P<0.05),空白对照组和阴性对照组第3天、第5天的细胞凋亡率呈下降趋势,siRNA-Rsf-1/HBXAP组呈升高趋势,siRNA-Rsf-1/HBXAP组各时点间细胞凋亡率均高于空白对照组和阴性对照组(P<0.05)。见表2。

siRNA:小干扰RNA;Rsf-1/HBXAP:染色体空间重组因子1
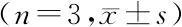
表1 各组细胞OD值比较
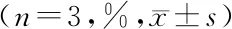
表2 各组细胞凋亡率比较
2.6沉默Rsf-1/HBXAP对子宫内膜癌细胞侵袭的影响 第1天、第3天、第5天侵袭细胞数的主效应差异有统计学意义(P<0.05);不考虑测量时间,各组间侵袭细胞数的主效应差异有统计学意义(P<0.05);侵袭细胞数的组间和时点间存在交互作用(P<0.05),空白对照组和阴性对照组第3天、第5天的侵袭细胞数呈升高趋势,siRNA-Rsf-1/HBXAP组呈下降趋势,siRNA-Rsf-1/HBXAP组各时点间侵袭细胞数均低于空白对照组和阴性对照组(P<0.05)。见表3。
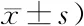
表3 各组侵袭细胞数比较 (n=3,个,
3 讨 论
近年来,随着分子生物技术的不断进步,学者们对子宫内膜癌的分子机制研究逐渐增多,其发生、发展是多基因改变和信号转导通路异常互相作用的复杂连锁过程,但仍未明确可服务临床的有效标志物[10-11]。Rsf-1/HBXAP最早于HeLa细胞核中发现,随后在人类各肿瘤组织中均有报道,且多高表达,是近年来发现的新型肿瘤标志物之一[12-13]。Rsf是一种复合物,包括Rsf-1和人类不发酵蔗糖蛋白2同源物两种亚型,且均定位于细胞核,可调节染色质结构以适应各种生长信号和环境变化需求,若Rsf异常升高可导致细胞在基因水平上失去对细胞生长的正常调控而出现异常增生,进而形成局部肿块[14-15]。目前研究提示,Rsf-1主要作为一个致癌基因参与细胞增殖及恶性转化过程,这是因为其可与人类不发酵蔗糖蛋白2同源物在细胞核内结合成染色质重塑复合物Rsf,以促进肿瘤细胞的修复与重构,从而逃避死亡,Rsf-1还与肿瘤细胞增殖能力、侵袭能力、恶性程度、耐药及染色体稳定性相关[16-17]。Choi等[18]在卵巢癌研究中发现Rsf-1/HBXAP可通过与细胞周期蛋白E结合促进癌细胞增殖。Liu等[19]在乳腺癌研究中发现干扰Rsf-1表达能有效抑制乳腺癌MCF-7和SKBR-3细胞增殖,促进其凋亡,有望成为乳腺癌治疗的新靶点。Wang等[20]通过IHC、Kaplan-Meier分析及siRNA等方法发现RSF-1参与宫颈癌的肿瘤进展,可作为癌症发展和临床结局的早期预后指标,且认为抗RSF-1活性治疗对RSF-1过表达宫颈癌患者有益。
在本研究中,通过IHC检测发现Rsf-1/HBXAP蛋白在子宫内膜癌组织中阳性率显著高于癌旁正常组织,提示Rsf-1/HBXAP主要作为一个癌基因存在于子宫内膜癌细胞,以促进其发生发展,为后续研究提供了临床理论基础。目前,已有大量研究证明Rsf-1/HBXAP可提高肿瘤细胞增殖及侵袭能力,并同时抑制其凋亡能力,使用Rsf-1/HBXAP拮抗剂或Rsf-1/HBXAP-siRNA可帮助抑制细胞增殖、促进凋亡[21-22]。本研究采用qRT-PCR法选取较高表达Rsf-1/HBXAP的Ishikawa细胞进行后续探讨,并通过siRNA介导沉默Rsf-1/HBXAP以分析其对子宫内膜癌生物学功能的影响,结果显示,空白对照组和阴性对照组细胞增殖、侵袭能力比较差异无统计学意义,排除了转染本身对癌细胞的影响;siRNA-Rsf-1/HBXAP组水平最弱,提示沉默Rsf-1/HBXAP可明显抑制子宫内膜癌细胞增殖和侵袭能力。而在细胞凋亡能力上,siRNA-Rsf-1/HBXAP组水平最强,提示Rsf-1/HBXAP在子宫内膜癌发生发展中发挥一定作用,为其诊疗提供了一个新的方向,是本研究重要创新之处。
综上所述,Rsf-1/HBXAP在子宫内膜癌中高表达,沉默Rsf-1/HBXAP在降低癌细胞增殖及侵袭能力的同时可增强其凋亡能力,但具体作用机制尚不清楚,有待后续探讨。

