基于网络药理学的地榆升白片对白细胞减少症的作用机制研究△
刘金垒,但文超,2*,何庆勇,许博文,2,曲艺,2
1.中国中医科学院 广安门医院,北京 100053;2.北京中医药大学,北京 100029
白细胞减少症(leukopenia)是指外周血白细胞计数<4×109个/L[1]的一种常见血液病,其发病率可达12.36%[2]。其临床病因复杂,最常见于肿瘤患者因放疗、化疗后造血干细胞损伤所致的骨髓抑制状态[3],进而使自身外周血白细胞数量减少。临床表现多为乏力、倦怠、精神萎靡不振、发热、睡眠差、食欲下降,以致肿瘤患者机体抵抗力低下,易感染,甚至导致治疗中断。
目前治疗白细胞减少症的临床一线药物如利血生、重组人粒细胞刺激因子等,其升高白细胞疗效不稳定,单独用药成本高昂,而且常伴随多种并发症,存在临床安全评价不良的弊端[4]。因此白细胞减少症的治疗亟待寻求一种价格相对低廉,疗效稳定的药物。
伴随着中医药现代化进程不断加速,天然药物的独特优势通过不同剂型得以发挥。地榆升白片治疗白细胞减少症的优势不断得以验证[5-6]。地榆升白片的成分主要为地榆,辅料为蔗糖。基础研究表明,地榆的主要成分为地榆皂苷、鞣质、大黄酚、胡萝卜苷、β谷甾醇及儿茶素等[7],而鞣质和皂苷类成分被认为是地榆发挥其升白效果的主要活性成分。目前国内外对其分子活性的研究虽相对深入,但对其在机体内的代谢、转运方式与途径等方面研究尚待深入[8]。本研究借助中药网络药理学的方法,系统地分析地榆的有效活性成分和潜在作用靶点,探讨其发挥升白作用可能的作用机制,为今后的实验研究提供借鉴。
1 资料与方法
1.1 地榆活性成分的筛选和靶点预测
检索中药系统药理学数据库和分析平台[9](traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)、TCM-MESH数据库[10]、ETCM数据库(the encyclopedia of traditional Chinese medicine)[11]以获取地榆的全部成分,将获得的成分录入TCMSP平台以匹配信息,筛选活性成分条件为口服生物利用度(oral bioavailability,OB)≥30%、类药性(drug-likeness,DL)≥0.18[12],根据已有文献整理出地榆升高白细胞的成分并对预测结果进行补充。通过PubChem(https://pubchem. ncbi. nlm.nih.gov/)获取活性成分sdf分子结构,并在SwissTargetPrediction平台[13]预测其潜在靶点。
1.2 构建地榆升白片“活性成分-靶点”网络
地榆“活性成分-靶点”网络主要通过软件Cytoscape 3.7.1[14]来构建与分析,其中用“节点”(node)表示成分或靶点,用“边”(edge)表示两者之间的关系;采用Cytoscape 3.7.1软件内置的network analyzer分析工具分析网络特征参数,包括连接度(degree)、介度(betweenness)及紧密度(closenesss)等,研究地榆中较为重要的成分和靶点及之间的关系。
1.3 白细胞减少症相关靶点检索
利用“leukopenia”为关键词,在GeneCards数据库[15]、OMIM数据库[16]、DisGenet数据库[17]、TTD数据[18]、DigSee数据库[19]、DrugBank数据库[20]等疾病基因数据库进行检索与筛选,将得到的靶点汇总并去除重复值,再根据文献报道补充未预测到的有效成分的已知靶点,利用Uniprot数据库将所得靶点标准化。
1.4 蛋白质相互作用(protein protein interaction,PPI)网络构建及关键靶点筛选
通过BisoGenet构建PPI网络。将地榆活性成分相关靶点与疾病靶点分别导入BisoGenet内,各自生成PPI网络,通过Cytoscape中的Merge功能提取2个PPI网络的交集网络并运用CytoNCA[21]分析交集网络中各个节点的属性值。计算连接度的中位数k1并选出连接度大于2倍k1的所有节点,即“Hit hubs”。计算Hit hubs网络各个节点的属性,分别得到连接度中心性(degree centrality,DC)、紧密度中心性(closeness centrality,CC)、介度中心性(betweenness centrality,BC)、网络中心性(network centrality,NC)和局部边连通性(local average connectivity,LAC)的5个中位数k2、l2、m2、n2、o2,选出节点属性同时满足>k2、l2、m2、n2、o2的所有节点作为核心靶点。
1.5 通路富集分析
Metascape平台(http://metascape.org)[22]可对靶点进行通路富集分析,该平台整合了GO、KEGG、Uniprot等多个权威的功能数据库,支持对批量基因或蛋白质进行注释、富集分析及构建PPI网络。将潜在作用靶点导入Metascape平台进行GO及KEGG分析,保存其结果并通过R软件对结果进行可视化。
2 结果
2.1 地榆活性成分及靶点获取
从TCMSP数据库获取到41个地榆成分,根据OB和DL参数筛选初步获得13个成分,剔除4个未查询到靶点的成分,并根据文献报道补充地榆皂苷Ⅰ与地榆皂苷Ⅱ[23-24],最终获得11个活性成分。运用TCMSP靶点预测模型对上述11个成分作用靶点加以预测。若TCMSP未纳入该成分靶点信息,则登入Pubchem网站下载该成分sdf结构信息,并通过Swiss Prediction网站进行靶点预测,将预测结果补充进上述靶点预测结果中。11个活性成分见图1和表1。
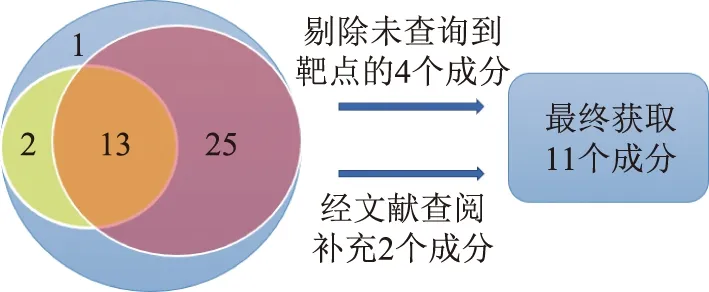
注:蓝色圆代表全部41个成分;黄色圆代表OB筛选;红色圆代表DL筛选。图1 ADME筛选结果活性成分分布

表1 地榆升白片中候选活性成分
2.2 地榆升白片“活性成分-靶点”网络构建和分析
利用相关靶点预测技术对上述活性成分进行作用靶点预测,排除重复靶点,共获得预测靶点109个。利用Cytoscape 3.7.1对地榆活性成分及其作用靶点的关系网络进行绘制和分析,共获得120个节点(包含109个靶点和11个活性成分)与161条关系,图中节点的大小代表相应的度值,节点面积越大代表度值越大,表示涉及的生物功能越多,其生物学重要性越高,见图2。

注:图中绿色代表活性成分作用的靶点;蓝色代表11个活性成分。图2 地榆活性成分-靶点网络
2.3 白细胞减少症相关靶点检索
检索Genecards、OMIM、Disgenet、TTD、DigSee和DrugBank 6个疾病数据库,分别得到靶点个数为1112、13、245、0、0和1。将得到的靶点汇总并去除重复靶点,最终得到1204个疾病靶点。
2.4 地榆治疗白细胞减少症的PPI网络构建与关键靶点筛选
2.4.1地榆治疗白细胞减少症的PPI网络构建 运用Cytoscape 3.7.1中的BisoGenet功能,分别构建地榆和白细胞减少症的PPI网络,发现地榆潜在靶点可与5178个靶点产生直接或间接作用,而这些靶点之间的相互关系可达130 414种。与此同时,对白细胞减少症相关的靶点绘制PPI网络,显示与其直接或者间接相关的靶点可达10 818个,这些靶点之间的相互联系可达224 920种,两者交集网络见图3。

图3 地榆升白片与白细胞减少症的PPI网络交集网络
2.4.2地榆升白片治疗白细胞减少症关键靶点筛选 为获取PPI网络中更丰富的节点连接信息以及优化节点信息传递效率,充分明确在网络中发挥重要作用的靶点,本研究计算了上述PPI交集网络图的网络拓扑学特征属性值。通过2次筛选,共获得关键靶点167个,具体筛选策略见图4,最终筛选得到的靶点互相作用关系见图5。

图4 地榆升白片干预白细胞减少症关键节点的筛选策略

图5 地榆升白片核心靶点PPI网络
由于PPI网络中蛋白的作用是相互的,所以通常归为无向图。PPI复杂网络中存在部分密度较高的区域称为community或module。module内部的网络是PPI网络的潜在子网,子网连线密度较高,区域部分连线少,因此module被认为是具有生物学意义的集合,该集合有2种含义,一为蛋白质复合体(protein complex),即多个蛋白质共同组成复合体而后发挥生物学作用;一为功能模块(functional module),如位于同一通路的蛋白质,其相互作用更加密切。故为更精确地分析地榆升白片治疗白细胞减少症的作用机制,在得到核心PPI网络后,有必要进一步识别其内在module。通过分子复合物检测算法对相互作用关系进行分析,得到module,见图6。根据P值,分别保留PPI网络与module中3个最佳评分的生物学进程并对其进行功能描述,见表2。
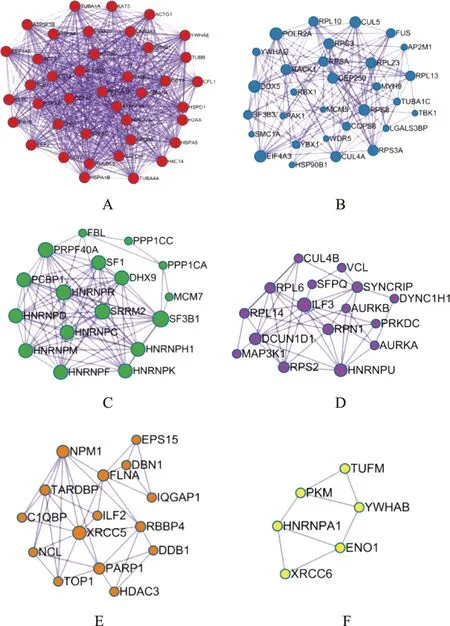
注:A~F为具有生物集合意义的6个功能团。图6 地榆升白片治疗白细胞减少症核心PPI网络内部潜在module网络
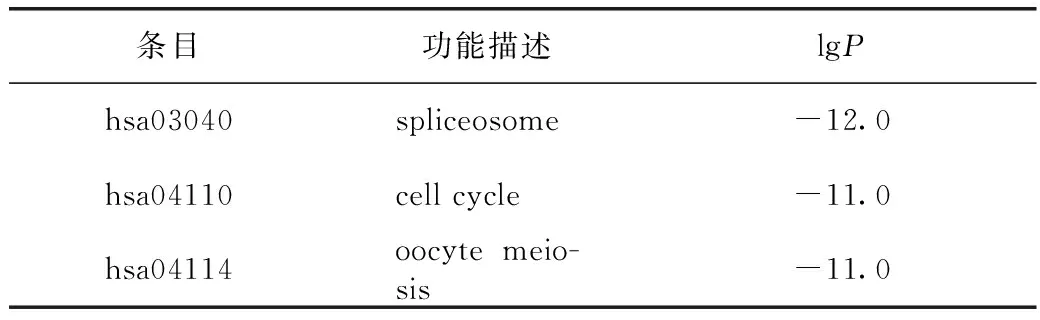
表2 地榆升白片治疗白细胞减少症的PPI网络内部潜在module功能描述(前3位)
2.5 地榆升白片治疗白细胞减少症通路富集分析可视化
本研究使用Metascape平台对上述167个关键靶点进行基因富集分析,包括GO的BP(biological process)、CC(cellular component)、MF(molecular function)以及KEGG通路,保存其结果并使用R语言绘制气泡图(bubble chart),结果见图7。气泡颜色由红到紫代表lgP值从小到大,lgP值越小代表显著性越强,气泡越大代表该通路的基因计数(count值)越大,横轴代表该通路基因所占总体输入基因的比率(ratio)。
图7A表明地榆调控白细胞减少症主要涉及的生物学过程有DNA修复(DNA repair)、RNA剪接(RNA splicing)、翻译(translation)、mRNA分解过程(mRNA catabolic process)、细胞周期过程的调控(regulation of cell cycle process)等。这些过程直接作为细胞修复和细胞增殖的环节,表明地榆对于白细胞的修复和产生具有直接的调控作用。
图7D为KEGG通路富集结果,图中显示了排名前20的信号通路,包括剪接体通路(spliceosome)、肌动蛋白细胞骨架调控(regulation of actin cytoskeleton)、细胞周期通路(cell cycle)、细胞凋亡(apoptosis)通路等,此外还包括地榆与白细胞减少症间接相关的信号通路诸如细胞间紧密连接(tight junction)、泛素介导的蛋白质水解(ubiquitin mediated proteolysis)等。

注:A. GO-BP分析;B. GO-CC分析;C. GO-MF分析;D. KEGG分析。图7 地榆治疗白细胞减少症作用靶点富集气泡图
3 讨论
中医学并没有与白细胞减少症对应的病名,但其典型症状如乏力、头晕、精神萎靡、食欲减退、面色苍白或萎黄等与明·李梴所著《医学入门》中的虚证记载“食少神昏,精不荣,筋骨酸痛”较为接近,故可将其归于中医学“虚劳”范畴[25]。由图2可知,地榆升白片调治白细胞减少症的主要成分可能为槲皮素、地榆皂苷、山柰酚等。其中地榆皂苷I可调控F2、JUN、GLI1、HSD11B2、HSD11B1、BCL2L1等靶点,而靶点如F2可与多个活性成分互相作用,这反映出地榆升白片治疗白细胞减少症的相互协调、共同调节的作用机制。细胞实验表明,槲皮素可与HSP(70和90)、MAT2A和FOXM1相互作用来促进细胞周期阻滞和凋亡[26],山柰酚能以浓度依赖的方式促进细胞凋亡并抑制多药耐药性[27],实验研究表明,地榆皂苷I可显著升高骨髓抑制小鼠白细胞数量和中性粒细胞数量,激发其造血干细胞自噬的发生,并显著上调造血干细胞中Atg5、Atg7和Beclin-1蛋白的表达水平[21],地榆皂苷II通过激活3大细胞凋亡通路来抑制肿瘤细胞的增殖,促进肿瘤细胞的凋亡,间接对白细胞减少症起治疗作用。
3.1 关键靶点结果分析
本研究按照筛选策略共得到167个潜在关键靶点。根据度值排名,其中较为重要的有FUS、CUL5、NPM1、HNRNPA1、HSPA5、H2AFX、TUBG1。基础研究表明,FUS参与了转录调节、RNA剪接与转运等多种细胞生命活动[28],其主导的DNA或RNA结合蛋白能在DNA双链断裂修复过程中促进D-环形成和同源重组,进而影响细胞生命活动[29]。CUL5具有结合泛素蛋白连接酶的功能[30],其参与的ERBB2信号转导通路可参与激活核糖体RNA基因的转录来增强翻译和细胞生长[31],这在固有凋亡信号通路中起调控作用[32]。NPM1能调节中心体复制,并通过抑制EIF2AK2/PKR自身磷酸化来抑制细胞凋亡[33],故推测地榆升白片可能通过抑制NPM1的功能来对抗白细胞减少症。而γ-微管蛋白(TUBG1)是人类细胞中心体实现组装功能所需的必要蛋白质,同时γ-微管蛋白还参与细胞胞质分裂的协调[34]。热休克蛋白5(HSPA5)与内质网伴侣蛋白在内质网腔中的蛋白质折叠和质量控制中起关键作用[35-38],而组蛋白家族成员(H2AFX)在维持染色质结构和遗传稳定性方面很重要[39]。以上研究表明,地榆升白片通过多靶点对白细胞减少症起到调治作用。
3.2 通路与生物进程分析
地榆升白片调治白细胞减少症涉及DNA修复、mRNA分解过程、RNA剪接、DNA代谢过程的调控、细胞分裂等多个生物学进程,这些进程是细胞修复和细胞增殖的直接环节。细胞应激反应(regulation of cellular response to stress)的下游信号通路聚集在TSC1/2,TSC1/2可抑制对细胞生长功能具有促进作用的雷帕霉素靶蛋白复合体1(mTORC1)。当给予细胞的刺激达到一定程度时,可使mTORC1失活[40]。这表明地榆升白片对细胞应激反应的干预有可能促进白细胞的修复与生成。此外,通过参与细胞对辐射的反应(response to radiation)通路,推测地榆升白片能够间接对放疗引起的白细胞减少症产生调治作用。
从通路富集结果可知,地榆升白片可能主要干预细胞凋亡、细胞周期、细胞分裂等直接与细胞生命相关的通路,亦可通过抗肿瘤方面的作用间接调控白细胞减少症。剪接体参与的前体信使RNA的剪接是所有真核生物从DNA到蛋白质的信息交流中必不可少的步骤,而其所包含的多效调控蛋白1(PLRG1)是细胞周期进程和凋亡的关键核调节因子[41]。细胞周期通路的破坏可导致细胞周期的停滞,相关研究表明,此通路与癌症预后有关[42-43],故推测地榆升白片可通过干预细胞周期通路来调控白细胞前体细胞的分裂与再生,同时具有一定的抗肿瘤作用。核糖体生物发生的中断会导致核仁应激,激活p53信号传导途径,进而导致细胞周期停滞和凋亡[44]。此外,当内质网中未折叠或错误折叠的蛋白质超过其折叠能力时,会诱导内质网自噬和与凋亡机制的串扰,以影响细胞存亡[45]。紧密连接(tight junction,TJ)包含细胞质衔接蛋白(ZO蛋白),与ZO蛋白相关的ZO-1相关核苷酸结合蛋白(ZONAB)可与增殖细胞核抗原(PCNA)、细胞周期蛋白D1直接相互作用来调节细胞周期[46]。河马信号通路参与细胞增殖与程序性死亡,其失调将导致细胞异常生长和肿瘤生成[47]。此外,在血液系统恶性肿瘤中,细胞凋亡程序通常失调,进而导致恶性肿瘤细胞的积累[48],一定程度的积累则产生放、化疗的治疗需求。
综上所述,地榆升白片治疗白细胞减少症的主要成分可能是槲皮素、地榆皂苷、山柰酚等,涉及到细胞周期、DNA修复、细胞凋亡、细胞应激反应调控、内质网中蛋白质加工、细胞分裂、细胞对辐射的反应等多个生物学过程及通路。这为后续进一步探讨地榆升白片治疗白细胞减少症的机制以及实验设计提供了依据。本课题组后续将设计完善相应的体内或体外实验,构建白细胞减少症相关模型,进一步分析地榆升白片治疗白细胞减少症的作用机制和分子机制,以验证本研究的分析和结论。此外,目前对于具体药物组分含量及比例因素的定量分析仍缺乏系统的研究模型。今后本课题组将持续跟进相关进展并做进一步研究。

