中枢性原始神经外胚层肿瘤1例
1.广东省佛山市第二人民医院影像中心(广东 佛山 528000)
2.广东省湛江市广东医科大学研究生学院(广东 湛江 524000)
陈丽贤1 朱新进1 刘 杰1 李康倩2 李树强1
原始神经外胚层肿瘤( p r i m i t i v e neuroectodermal tumor,PNET)为罕见的原发性高度恶性肿瘤,源于神经外胚层小圆细胞,具有多向分化的潜能。临床上,PNET可分为中枢型PNET(central nervous system primitive neuroectodermal tumors cPNET)及周围型PNET(peripheral primitive neuroectodermal tumors pPNET)[1]。近年来国内外有关PNET影像表现的个案报道逐渐增多,但是MRI多功能成像在PNET的应用价值少有报道。现对我院收治的1例cPNET,结合影像征象,报道如下。
1 病历资料
患者,女,10岁,于1月前无明显诱因出现头晕伴间隙性呕吐,症状持续时间不一,休息后稍能缓解,无头痛、肢体乏力,无抽搐、耳鸣。眼科检查:左眼生理盲点扩大,颞下缺损,双眼视盘水肿。
本院CT显示:左侧颞顶枕叶交界区白质内巨大占位影,边缘欠清,密度混杂,边缘可见囊状液性密度影,增强扫描不均匀强化,内见多发迂曲增粗血管影(来源于脑膜动脉)。图1MRI显示:左侧颞顶枕叶团块状影,T1WI呈稍低-高信号,T2WI呈等-高信号,内见囊状及流空血管影,DWI呈略高信号,ADC信号减低,增强扫描轻度不均强化,内见迂曲走行血管影,囊变区未见强化,边缘尚清,周围水肿不明显。见图2-6。
手术及病理:左侧枕部灰红色肿瘤组织约7cm×6cm×5cm,质中,边界不清,血运一般,深部见囊性变。病理:肿瘤细胞弥漫分布,细胞排列密集,核异型性明显,大小不一,染色质细腻,核分裂象多见,局部肿瘤排列呈花环状(Homer-Wright菊形团),见图7。免疫组化:EMA(-),GFAP(-),Ki-67(约80%+),P53(+),PCNA(+),Vim(+),CK20(-),C K7(-),S-100(-),CD99(+),NSE(-),cd56(-),Desmin(-),MSA(-),LCA(-),Syn(-)。结合免疫组化及形态学,符合原始神经外胚层肿瘤(PNET)。
2 讨 论
PNET临床特点:1973年Hart等[2]首次提出原始神经外胚层肿瘤的概念。2007年WHO将髓母细胞瘤与PNET分别归为胚胎性肿瘤,定为Ⅳ级[3]。2016年CNSWHO删除了“原始神经外胚层肿瘤”这一术语,提出了CNS胚胎性肿瘤(Nos),其包括了PNET[4-5]。但是目前,中外文献相关报道中尚未真正抛弃原始神经外胚层肿瘤这个名词,而引用新的名称。cPNET儿童多见,占儿童原发性中枢神经系统肿瘤的1%[6]。关于PNET发病机制,大部分学者认为染色体及基因调控的异常使处于原始未分化阶段的肿瘤细胞形成了cPNET[7-10]。PNET临床表现无明显特异性,主要表现为肿瘤局部占位效应及相关神经功能障碍症状,例如头痛、头晕、呕吐等颅内压增高的表现。CNS-PNET的治疗是多模式的,其中以总切除(GTR)为目标的手术是首要的治疗方式[11]。
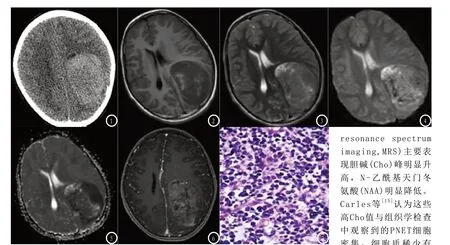
图1 左侧颞顶枕叶交界区白质内巨大占位影,稍高密度。图2-3 左侧颞顶枕叶团块状影,T1WI呈稍低-高信号,T2WI呈等-高信号,内见囊状及流空血管影。图4-5 DWI呈高信号,ADC信号减低。图6 增强扫描轻度不均强化,内见迂曲走行血管影,边缘尚清,周围水肿不明显。图7 肿瘤细胞弥漫分布,染色质细腻,可见花环状(Homer-Wright菊形团)。
病理组织学:镜下肿瘤细胞致密,核大,核周胞质少,特征性的Homer-Wright菊形团结构,可作为PNET的重要诊断依据[6,12]。免疫组化:PNET肿瘤细胞多表达CD99、NSE、CD56、Syn、S-100等神经标记物,其中CD99阳性是诊断本病相对特异性的抗体[13]。影像特点:幕上cPNET在额叶、顶叶、颞叶分布相当,常位于中线附近、脑室周围,位置较深。肿瘤形态各异,可呈类圆形、分叶状、不规则形等。肿瘤实体在CT上一般等-稍高密度,合并出血、钙化则密度更高。肿瘤实体在MRI信号一般较均匀,T1WI呈等低信号,T2WI呈等高度信号,基本与灰质信号相同,增强扫描肿瘤强化程度不一,部分可见条状血管影,肿瘤边缘清或不清,周围无水肿或者轻度水肿。本例影像学表现,与文献报道基本相符,属于典型的PNET。常规MRI检查是评估肿瘤位置、大小和增强模式的必要手段,但在鉴别中枢神经系统肿瘤的效果不明显。先进的MRI多功能成像技术可以分析肿瘤的实性成分,比传统的单独成像更优。基于本例cPNET,本文就MRI多功能成像技术在cPNET的表现做简单的分析。由于cPNET恶性程度高,肿瘤细胞排列紧密、细胞外间质缺乏,影响了细胞内外水分子扩散,所以DWI呈明显高信号。部分研究认为cPNET弥散高信号主要存在于细胞密集、生长旺盛区域,而与肿瘤基质本身关系不大[14]。cPNET磁共振波谱成像(magnetic resonance spectrum imaging,MRS)主要表现胆碱(Cho)峰明显升高,N-乙酰基天门冬氨酸(NAA)明显降低。Carles等[15]认为这些高Cho值与组织学检查中观察到的PNET细胞密集,细胞质稀少有关。本例cPNET波谱成像示:肿瘤实体Cho峰(3.22ppm)明显升高,NAA峰(2.02ppm)降低,但这不是特异性的。除了DWI及MRS外,MRI弥散张量成像(diffusion tensor imaging ,DTI)、灌注加权成像(perfusion-weighted imaging,PWI)及磁敏感成像(susceptibility weighted imaging,SWI)也逐步应用于脑肿瘤征象分析及鉴别诊断。国内外学者对颅内胶质瘤-DTI成像研究发现,随着胶质瘤恶性程度越高,肿瘤实质的ADC值越低,FA值也越低[16-17]。高级别胶质瘤较低级别胶质瘤FA值低,间接反映高级别胶质瘤间质内血管受侵蚀、神经纤维束被破坏[18-19]。本例cPENT的纤维束FA值图及伪彩示踪图均提示脑白质纤维束稀疏、断裂及中断。结合ADC值及ADC图,本例cPENT与高级别胶质瘤相似,属于高级别恶性肿瘤。本研究采用3D-ASL灌注成像无创地评cPNET的微循环血流灌注信息。Hong等[20]研究报道3D-ASL得到的CBF值与DSC-PWI CBF和CBV值具有较高的相关性,两种MR灌注成像方法均显示DSC-rCBF、DSC-rCBV、ASLrCBF均随胶质瘤分级增加而增加。PENT属于WHO-Ⅳ级肿瘤,恶性程度高,肿瘤血管丰富。但本例cPNET 3D-ASL灌注成像显示肿瘤实性成分呈低灌注,仅有局部粗大血管呈高灌注表现,这可能是肿瘤增殖过快,血供不足,处于乏血供状态并发坏死、出血导致。SWI技术利用不同组织磁敏感性的差异,对小静脉、出血、铁沉积高度敏感[21]。对于恶性肿瘤,尤其是高级别肿瘤,其血供往往比较丰富,生长迅速,常出现出血和坏死,在SWI上可见多发低信号小静脉及微出血影。本例cPNET在mip-SWAN图像上可见多发小静脉显示,相位图及幅度图均提示肿瘤弥漫微出血灶。结合3D-ASL及SWI进一步分析,本例cPNET实性低灌注区内引流静脉明显增多增粗,提示肿瘤间质毛细血管及引流静脉内脱氧血红蛋白的含量相对升高,而含氧血红蛋白则下降,SWI上呈极低信号,提示肿瘤组织坏死、缺陷,明显缺氧,肿瘤实质卒中。
cPNET影像学上无明显特征性表现,但仍需与颅内其他肿瘤鉴别。脑膜瘤MRI平扫呈稍长T1长T2信号与cPNET影像学表现类似,但脑膜瘤属于脑外肿瘤,成年女性多见,增强扫描可见“脑膜尾征”。生殖细胞瘤与PNET均好发儿童和青少年,但是前者易发于松果体区及鞍区,伴有内分泌紊乱症状。淋巴瘤与部分PNET患者影像征象难以鉴别,但是临淋巴瘤易发于中老年人,血供不丰富,增强扫描可见“脐凹征”“握拳征”。
综上所述,MRI多模式功能成像可为cPNET的诊断及鉴别诊断提供额外的信息。本研究利用多种MRI功能成像技术对颅内一例典型的PNET肿瘤做初步研究,不足之处在于缺乏临床大样本,也希望其他同行对本病进一步研究,以提高PNET的诊断效能。

