生物合成脂肽的研究进展及展望
马天祥
(中国石油大庆炼化公司研究院,黑龙江大庆163411)
大庆油田的3次采油技术在国内处于领先地位,继聚合物驱油和化学三元复合驱油后,无碱二元复合驱油和微生物驱油技术等已经提上日程,其中生物表面活性剂驱油有重要的应用前景。
1 脂肽类表面活性剂研究现状
在石油开采领域,最受关注的生物表面活性剂是以表面活性素为代表的脂肽家族。1968年Arima等[1]首次发现枯草芽胞杆菌株(Bacillussubtilis)产生的是脂肽类表面活性剂。
脂肽分子由亲水的肽键和亲油的脂肪烃链两部分组成,由于特殊的化学组成和两亲型分子结构,使其成为具有高表面活性和稳定性的生物表面活性剂。其提高原油采收率机理在于能够降低表界面张力,降低毛细管力,有利于原油流动,从而提高石油开采量[2]。典型的表面活性素分子的氨基酸序列结构见图1,分子结构见图2。
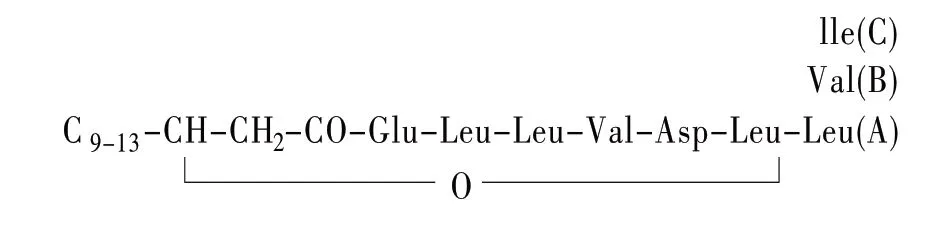
图1表面活性素分子氨基酸序列
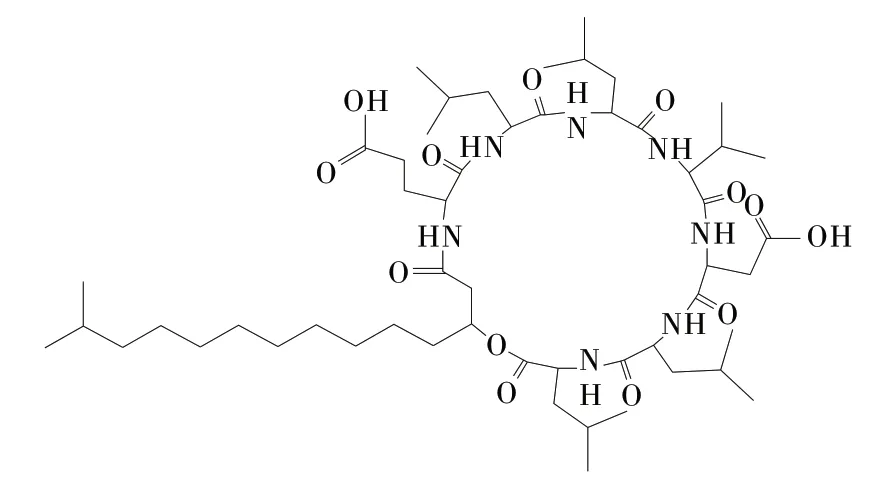
图2表面活性素分子结构式
包括疏水端的脂肪酸链和亲水端的环状寡肽,即由12~16个碳链长度的脂肪酸与7个氨基酸形成的肽环构成,其末端氨基酸的羧基与脂肪酸链的β-羟基缩合形成内脂结构[3,4],其主要生产菌株是枯草芽孢杆菌和假单胞菌。
在成本方面,由于脂肽结构和合成机制复杂,天然合成效率不高。野生菌脂肽产量约1 g/L,当脂肽产量为20 g/L时,其生产成本就可以与目前广泛应用的石油磺酸盐相当。
如果表面活性素的用量仅为石油磺酸盐的20%~10%时,则表面活性素的使用成本将降得更低,可以从根本上解决成本问题。
2 表面活性素合成菌株的小试和中试培养
2.1 清华大学技术研发
清华大学化工系10多年前开始脂肽生产菌株改造及其发酵生产工艺研究。通过对合成表面活性素的枯草芽孢杆菌细胞工厂的跨膜通道、强启动合成、氨基酸前体途径、脂肪酸前体途径以及芽孢合成途径进行基因调控改造,目前获得的重组枯草芽孢杆菌的表面活性素产量已经可达20 g/L以上,是公开报道的最好水平。
基于与清华大学化工系合作进行的生物表面活性素产业化技术开发,首先利用清华大学前期已经对产表面活性素野生菌株B.subtilis THY-7以及高产基因工程菌B.subtilis TS1726Y的发酵培养基(碳源、氮源、碳氮比、微量元素)及培养条件进行了优化基础上,通过摇瓶发酵优化确认了基因工程菌B.subtilis TS1726Y的优化培养条件及其在优化条件下的摇瓶产量,对产物进行了高压液相色谱分析和鉴定。
进一步在30 L发酵罐的小规模中试发酵水平上对基因工程菌B.subtilis TS1726Y的发酵培养进行了考察,确定了合适的发酵模式和搅拌转速。
2.2 表面活性素合成菌株的摇瓶实验
首先在摇瓶中进行了对诱导剂、氨基酸、豆油前体等培养基配方的优化验证,确认了高产表面活性素的基因工程菌B.subtilis TS1726Y的优选培养基配方和培养条件,配方见文献[5]。
采用优化方案后进行菌株发酵培养时,发酵时间由60 h缩短至48 h且产物最高产量达26 g/L,与优化前的13.6 g/L相比,表面活性素产量提高了近1倍。针对配方中用量最大、对表面活性素产量影响较大的红糖,选择市场上4个品牌进行试验,筛选出使用北京某品牌产量最高。表面活性素含量测定方面,在利用清华大学提供的液相色谱法的同时,尝试了用酸沉法测定,结果表明2者差别不大,均可用于含量测定。
采用高压液相色谱对产出的表面活性素进行了鉴定,4种主要产物的脂肪酸链长度分别为C13、C14、C14以及C15,见图3。
基因工程菌B.subtilis TS1726Y合成的表面活性素产品由4种主要产物构成,清华大学合作者通过串联质谱分析,进一步证明这4种产物中的脂肪酸链长度分别为C13、C14、C14以及C15,其7种氨基酸组成分别为Glu-Leu-Leu-Val-Asp-Leu-Leu或Glu-Val-Leu-Leu-Asp-Leu-Val。
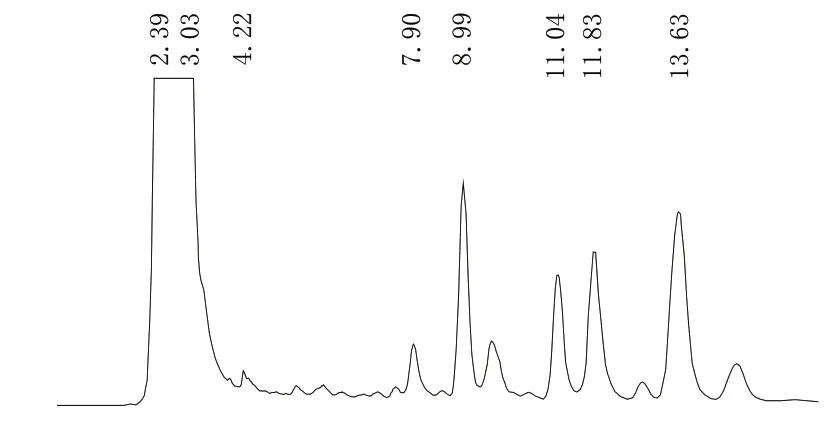
图3摇瓶表面活性素液相色谱
3 发酵罐中试实验
3.1 不同发酵模式对比
由于脂肽类表面活性剂的特殊性质,在摇瓶水平时较易生产,但放大至发酵罐水平时由于通气和搅拌的存在极易产生大量泡沫,导致发酵过程无法顺利进行。现阶段脂肽发酵模式主要有外源添加消泡剂、直接排泡、泡沫回流等方式。对各方式发酵周期及OD600进行对比,结果见图4。
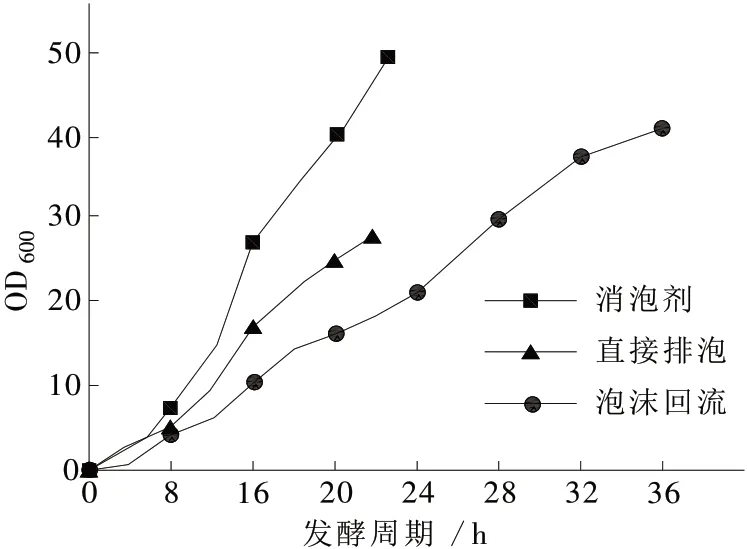
图4不同发酵模式OD600变化对比
发酵过程添加消泡剂是常规发酵中抑制泡沫的有效方法,常规发酵中所用到的消泡剂主要有硅类、天然油脂、聚醚类、高碳醇和聚醚改性硅类等,但有机硅及聚醚类消泡剂在添加量过多后均会对菌体生长造成一定抑制作用,大豆油作为碳源促进菌体生长代谢并提高脂肽类物质产量,因此尝试选择大豆油作为脂肽发酵过程中所用消泡剂。实验过程发现,豆油作为消泡剂一定程度上可以消除前期培养基内蛋白质类物质所产生的泡沫,但对产物引起的泡沫抑制能力有限,需持续添加,至发酵中后期豆油对脂肽所产生的泡沫完全无抑制作用,发酵周期仅维持约28 h。由于脂肽是1种较好的乳化剂,在发酵液中添加豆油后由于搅拌及通气作用,很容易使发酵液与豆油之间发生乳化反应形成稳定的水包油状态,该状态在发酵结束后很难消除,对后期检测及提取造成困难。且由于乳化现象的存在使发酵液OD600持续增加直至结束时达到50,对观察发酵周期内菌体生长情况造成阻碍。
脂肽发酵过程中泡沫产生比较剧烈,若直接将泡沫排出收集,同时会带走大量培养基,导致罐内发酵液损失严重,发酵16 h后发酵液损失约一半,在28 h时,10 L体积的培养基剩余量仅为1 L,致使发酵无法继续进行,同时发酵液的损失导致培养基内营养物质不能被充分利用,营养物质的减少也限制了产物的合成。且由于产物均聚集在排出的泡沫内,发酵中途取样所得发酵液内只能检测到少量产物,对发酵过程的监控也造成影响。
对比后发现,增加泡沫收集装置并通过蠕动泵将收集的泡沫及发酵液重新泵回发酵罐,能极大程度降低发酵过程中由于泡沫不断排出引起的发酵液损失现象,使发酵液内营养成分得到充分利用的同时增加发酵周期,使产物合成时间增加从而达到增加产量的目的,因此对30 L发酵罐泡进行了增加泡沫回流改造,流程见图5。
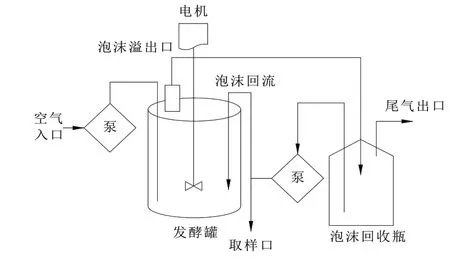
图5带泡沫回流的发酵系统流程
3.2 搅拌转速对发酵的影响
在固定通入空气量前提下,通过对比不同搅拌转速对发酵条件进行优化,以判断发酵过程最佳溶氧控制条件以及在该条件下的脂肽最高产量。
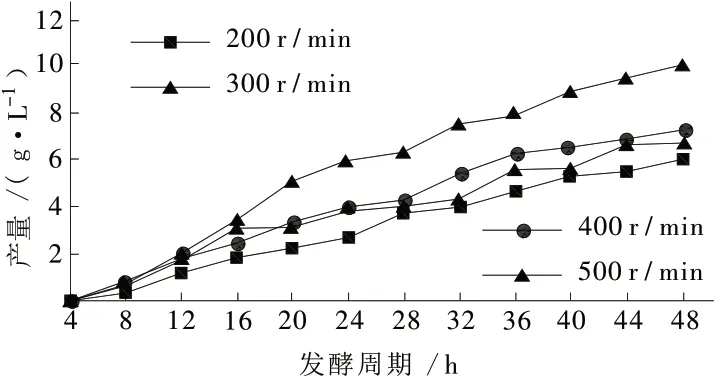
图6不同搅拌转速对脂肽产量的影响
由图6可看出,当搅拌转速大于300 rpm时随搅拌转速增加发酵液产物含量总体呈下降趋势,而当搅拌转速低于300 rpm时产量同样呈下降趋势。此种现象可能归因于过高的搅拌速度会使发酵罐内产生剧烈而稳定持久的泡沫,泡沫排出过快导致发酵液和菌体细胞的回流循环作用降低,从而导致发酵产量减少。而当搅拌速度过低时则无法保证发酵所需溶氧条件,使菌体生长及代谢缓慢,同样使发酵产量降低。搅拌转速300 rpm条件下的脂肽产量达到了34 g/L。
4 结论
(1)摇瓶和30 L发酵罐实验验证了B.subtilis TS1726Y基因工程菌的优化培养基配方和培养条件,表面活性素产量摇瓶达到26 g/L,而在30 L发酵罐达到了34 g/L,是已知文献报道的最高表面活性素产量,成本已不再是制约工业化生产的障碍。
(2)目前化学合成表面活性剂被广泛使用,在3次采油的油田产出液中含有大量化学表面活性剂,由于化学表面活性剂难降解,使后续污水处理难度大,外排污水达标难;而生物表面活性剂是微生物产生的次生代谢产物,能够很快被生物降解,环境友好,生物相容性好。
由于生物表面活性剂具有既亲水又亲油的两性分子结构,使其与化学表面活性剂具有类似的性能。生物表面活性剂通常比合成化学表面活性剂拥有更为复杂和庞大的分子结构,单个分子占据更大的空间,因而显示较低的临界胶团浓度,它们能显著地降低表面张力、改善界面性质。此外,生物表面活性剂还具有选择性好、用量少、无毒、无污染、生产工艺和设备简单、耗能少等特点。

