酸性NaCl溶液中CuNi2Si合金的电化学腐蚀行为
唐旭旺,李 根,2,袁新璐,张晓宇,任平弟
(1. 西南交通大学 机械工程学院 摩擦学研究所,成都 610031; 2. 中国石油西南油气田公司 输气管理处,成都 610031)
CuNi2Si合金是一种时效强化铜合金,具有较好的强度、硬度、导电性以及优异的加工性能[1-3],是高速铁路接触网零部件常用的材料之一,如:接触线吊弦线夹、中心锚结线夹、定位线夹等[4-5]。我国幅员辽阔,环境差异较大,接触网零部件长期处于各种复杂环境中,由CuNi2Si合金制成的各种接触网零部件因受到环境的侵蚀而失效的情况时有发生[6-9],成为严重威胁高速铁路运行安全的重大隐患。
现有文献报道大多针对CuNi2Si合金组织、性能及失效分析等方面。张治国等[10]从化学成分、显微组织、静态力学性能和疲劳极限等方面,对比分析了德国产和国产两种CuNi2Si合金的性质和差异。路海健等[11]研究了热处理与CuNi2Si吊弦线夹应力腐蚀的关系,并提出了合理、正确的时效强化热处理工艺参数。OZGOWICZ等[12]通过20~800 ℃静态拉伸试验研究了CuNi2Si合金产生微裂纹的机理,以提高合金的塑性和产品的加工性能。KONIECZNY等[13]基于导电性能,研究了经过过饱和-时效、过饱和-冷轧-时效两种方式热处理的CuNi2Si合金的相沉淀和再结晶动力学,发现经过冷轧的合金,其高导电性能和第二相(Ni2Si)析出有关。CHU等[14]利用试验和有限元方法分析得到CuNi2Si吊弦线夹失效与锻造过程的缺陷以及螺栓预紧力有关。
CuNi2Si合金的耐腐蚀性能较好,因此关于其腐蚀行为及腐蚀影响因素研究的文献报道较少。而我国近海地区的高铁接触网零部件长期受到酸雨、高盐度、高湿度等多因素耦合环境的腐蚀[15]。鉴于CuNi2Si合金在高速铁路接触网中的重要性,本工作研究了CuNi2Si合金在近海地区模拟工况条件下的电化学腐蚀行为,以期为CuNi2Si合金高铁接触网零部件的使用提供借鉴。
1 试验
1.1 试验材料
试验材料为市售CuNi2Si合金,其化学成分如表1所示。采用线切割方法将合金切割成10 mm×10 mm×5 mm的试样,并在试样背面焊接一条长约15 cm的铜导线,然后用环氧树脂封装,保留1 cm2作为研究表面。待试样完全固化后,依次用400号、600号、100号、1 500号、2 000号SiC水砂纸打磨,随后用抛光膏进行抛光处理,最后用去离子水、无水乙醇依次清洗,吹干后存干燥箱备用。

表1 CuNi2Si合金的化学成分(质量分数)Tab. 1 Chemical composition of CuNi2Si alloy(mass fraction) %
1.2 试验介质
根据近海雨水含盐度的相关数据[16-17],配制一定酸度和盐度的溶液作为腐蚀介质以模拟近海地区不同酸度的雨水[18-19]。以0.001 mol/L的NaCl溶液作为基础腐蚀介质,用浓硫酸、浓硝酸的混合液(SO42-和NO3-浓度比为8∶1)和氢氧化钠溶液调节溶液pH至3、4、5。所用试剂均为分析纯。
1.3 测试方法
使用CHI660E电化学工作站进行电化学测试。测试采用典型的三电极系统,CuNi2Si合金试样为工作电极,饱和甘汞电极(SCE)作为参比电极,铂电极为辅助电极。文中所有电位数值均相对于SCE。首先将CuNi2Si合金试样在腐蚀介质中浸泡500 s,待系统稳定后开始电化学性能测试。其中,开路电位的测试时间为5 000 s。在开路电位稳定的条件下,测量电化学阻抗谱,测试频率范围为0.01~106Hz,外加激励信号电压幅值为5 mV,运用ZsimpWin软件对电化学阻抗谱进行拟合。极化曲线的扫描范围为开路电位稳定值±250 mV,扫描速率为1 mV/s,运用CHI660E电化学工作站自带的工具对极化曲线进行拟合处理。所有测试均在室温(20±3) ℃条件下进行。
2 结果与讨论
2.1 开路电位
图1为CuNi2Si合金在不同pH的NaCl溶液中开路电位随时间的变化曲线。由图1可以看出,在不同pH条件下, CuNi2Si合金的开路电位都较为稳定,随时间变化较小。浸泡时间为5 000 s时, CuNi2Si合金在pH为3的NaCl溶液中的开路电位为0.005 V, 在pH为4的NaCl溶液中的开路电路为-0.018 V,在pH为5的NaCl溶液中的开路电位为-0.061 V。从开路电位曲线可以初步判断,随着NaCl溶液pH的升高,CuNi2Si合金的开路电位逐渐变负,说明其腐蚀倾向性增大。
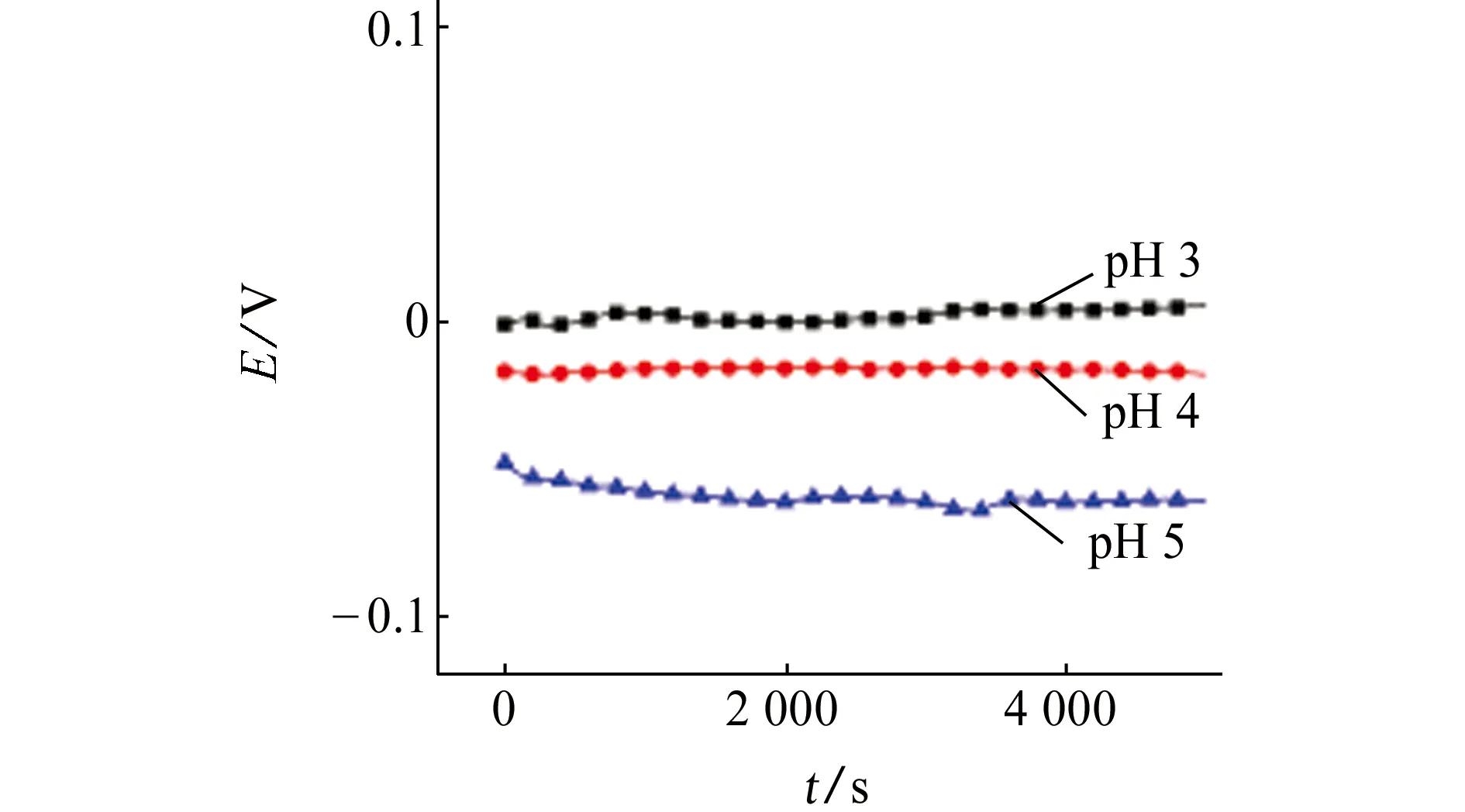
图1 CuNi2Si合金在不同pH的NaCl溶液中的开路电位随时间的变化曲线Fig.1 Plots of OCP vs time for CuNi2Si alloy in NaCl solution at different pH values
2.2 极化曲线
图2为CuNi2Si合金在不同pH的NaCl溶液中的极化曲线。由图2可见, 3种pH条件下的极化曲线形状相似, 阳极极化曲线只有活性溶解区,没有明显的钝化区间。对极化曲线进行拟合处理,得到腐蚀电流密度Jcorr、腐蚀电位Ecorr,如表2所示。结果表明,随着NaCl溶液pH的增大,腐蚀电流密度减小,CuNi2Si合金的腐蚀速率降低。
2.3 电化学阻抗谱
图3为CuNi2Si合金在不同pH的NaCl溶液中的Nyquist图。由图3可以看出,不同pH条件下阻抗谱的变化规律相似,即高频、中频区出现两个容抗弧,低频区出现类似直线的扩散阻抗。第一个容抗弧的半径随着pH的增大而增大,说明合金试样表面与溶液之间的电荷转移阻力越来越大, CuNi2Si合金的耐蚀性逐渐增强。第二个容抗弧可能与合金试样表面的腐蚀产物膜有关。低频区出现的扩散阻抗,预示着电极反应过程受到反应物的扩散控制[20]。

图2 CuNi2Si合金在不同pH的NaCl溶液中的极化曲线Fig.2 Polarization curves of CuNi2Si alloy in NaCl solution at different pH values

表2 CuNi2Si合金在不同pH的NaCl溶液中极化曲线的电化学参数Tab. 2 Electrochemical parameters of polarization curves of CuNi2Si alloy in NaCl solution at different pH values
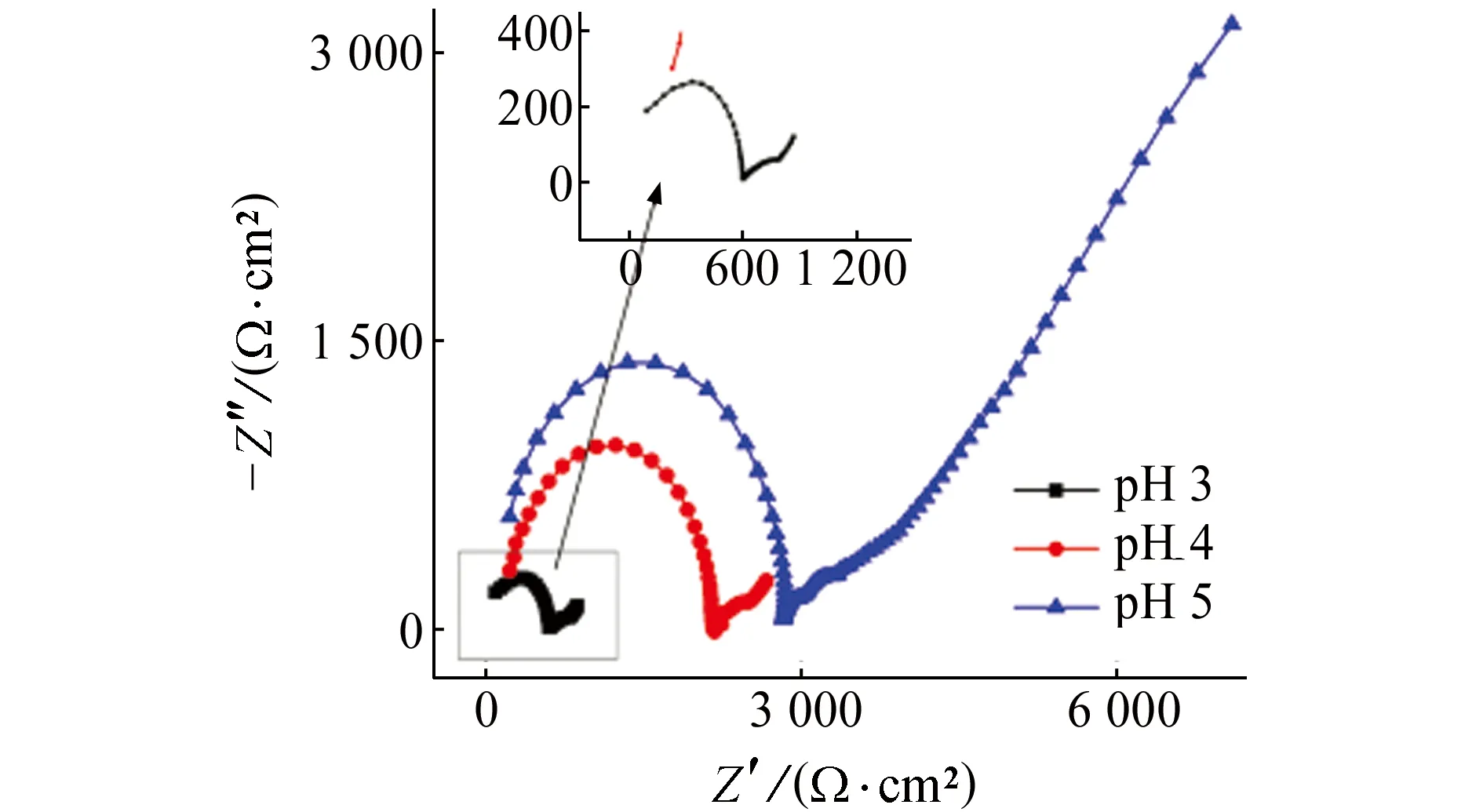
图3 CuNi2Si合金在不同pH的NaCl溶液中的Nyquist图Fig.3 Nyquist plots of CuNi2Si alloy in NaCl solution at different pH values
图4为CuNi2Si合金在不同pH的NaCl溶液中的等效电路。图4中,Rs为溶液电阻;Cdl为双电层电容;Rt为电荷转移电阻;Q1为常相位元角件(由参数Y和弥散系数n决定),代表电极表面的腐蚀产物膜电容;R1为腐蚀产物膜电阻;Zw为由于扩散引起的阻抗。表3为根据电化学阻抗谱拟合得到的各等效元件参数值。可以看到,随着pH的增大,电荷转移电阻以及腐蚀产物膜电阻都呈现逐渐增大的趋势,这说明腐蚀反应的阻力越来越大,CuNi2Si合金的耐腐蚀性能得到提高,这与极化曲线的测试结果是吻合的。

图4 CuNi2Si合金在不同pH的NaCl溶液中的等效电路Fig.4 Equivalent circuit of CuNi2Si alloy in NaCl solution at different pH values

表3 CuNi2Si合金在不同pH的NaCl溶液中EIS的拟合结果Tab. 3 Fitted results of EIS of CuNi2Si alloy in NaCl solution at different pH values
2.4 讨论
铜是一种正电位金属,即电极电位高于氢,故CuNi2Si合金在含有溶解氧的酸性溶液中能发生吸氧腐蚀。根据FENG等[21]在类似溶液中的研究结果,铜的腐蚀产物主要是铜的一价氧化物Cu2O,以此给出电极反应过程。铜发生阳极氧化反应,失去电子并生成Cu+,如式(1)所示。而阴极反应过程为溶解氧O2借助于扩散和对流作用通过溶液的主体层,随后借助扩散作用通过双电层,吸附在阴极表面形成吸附氧Oad,并与氢离子H+以及电子结合形成OHad,随后OHad进一步与H+以及电子反应生成H2O,如式(2)所示。结合电化学阻抗谱以及上述反应过程可知,腐蚀过程主要受到溶解氧和氢离子的扩散控制。

(1)

(2)
在电化学腐蚀领域,许多研究都以自腐蚀电位作为评价合金耐腐蚀性能强弱的判据,认为自腐蚀电位越负,合金的耐腐蚀性能越差。实际上,这种方法只能作为一种经验判据,并不适用所有情况。本工作从自腐蚀电位得到的结论,与其他参数得到的结论完全不一致,一些学者在研究铜合金、铝合金时也遇到了类似的情况[22-23]。自腐蚀电位是阴阳两个电极反应相互耦合的混合电位,是处于阴极平衡电位Ee,c和阳极平衡电位Ee,a之间的非平衡电位,它是腐蚀过程作用的结果。自腐蚀电位随着pH的升高而持续负移,罗宗强等[24]认为pH越高金属表面腐蚀产物膜越致密,阴极电流流过产物膜时就产生了更大的电压降。伍远辉等[25]在研究土壤酸化过程中铜的腐蚀行为时,也发现了pH升高自腐蚀电位负移的情况,但作者并没有给出相应的解释。
为讨论CuNi2Si合金在不同pH的NaCl溶液中自腐蚀电位变化的原因,需要先进行如下说明:若只考虑阴极反应,当电极反应达到平衡时,可由Nernst方程推导出水/氧气阴极平衡电位Ee,c(H2O/O2),即
Ee,c(H2O/O2)=E(H2O/O2)+(RT/F)·
lna(H+)+(RT/4F)lnp(O2)
(3)
式中:E为标准电极电位;R为气体常数;T为热力学温度;F为法拉第常数;a(H+)为氢离子活度;p(O2)为氧气分压。
在25 ℃、1标准大气压情况下,可以计算得出氧气在酸性溶液中还原反应的平衡电位,即
Ee,c(H2O/O2)=1.299+0.059 1 lgc(H+)
(4)
式中:c(H+)为氢离子浓度。计算得到的电位是相对于标准氢电极的电位。
由此可见,随着pH的增大,阴极反应的平衡电位发生了负移,这也必然会导致自腐蚀电位发生移动。因此,可以用Evans图来定性描述pH与自腐蚀电位、腐蚀电流密度之间的关系,如图5所示,其中下标数值表示对应的pH。随溶液pH的增大,阴极平衡电位负移,反应阻力加大(曲线斜率增大),即真实的阴极极化曲线可分别用曲线B、C、D示意,而阳极反应平衡电位及反应阻力随pH的变化不大,即真实的阳极极化曲线可用曲线A示意。真实阴极极化曲线和真实的阳极极化曲线的交点即为自腐蚀电位。从图5可以看出,体系的自腐蚀电位、腐蚀电流密度随pH的增大而降低。
进一步分析安百刚[26]关于铜在酸雨中的腐蚀动力学行为的研究结果,得出铜的自腐蚀电位为
Ecorr=(β/2)ln{(Kcθ)/[Ka(1-θ)]}+(β/2)·
ln[c(Oad)·c(H+)]+(Ee,c+Ee,a)/2
(5)
式中:c(Oad)为铜表面的氧气浓度;c(H+)为氢离子浓度;Ka与Kc分别为与阳极与阴极反应有关的常数;β为塔菲尔斜率;θ为腐蚀产物的表面覆盖度。

图5 CuNi2Si合金在不同pH的NaCl溶液中的Evans图Fig.5 Evans plots of CuNi2Si alloy in NaCl solution at different pH values
当pH增大时,对应着氢离子浓度降低,阴极反应的平衡电位也降低,式(5)的第二项以及第三项变小,而第一项保持不变,则自腐蚀电位数值是减小的。这也验证了随着pH的增大,自腐蚀电位发生负移的现象是值得肯定的。
由法拉第定律[27],如式(6)所示,可以看出,当腐蚀电流密度增大时,单位时间的电子转移数量也增大,金属在单位时间内被腐蚀的质量增大。结合极化曲线测试结果可知,随着pH的增大,腐蚀电流密度愈小,金属的腐蚀质量损失愈小,金属的耐蚀性能得到增强。
m=[M/(nF)]Jcorr
(6)
式中:m为在单位时间内被腐蚀的质量;M为金属原子量;n为原子价。
综上所述,使用自腐蚀电位来判断CuNi2Si合金在不同pH的NaCl溶液中的耐腐蚀性能是不可靠的,即自腐蚀电位正移不能说明CuNi2Si合金在酸性介质中更加稳定、更加耐腐蚀,而腐蚀电流密度则可以用来判定金属的耐腐蚀性能大小。
3 结论
(1) 在不同pH的NaCl溶液中,CuNi2Si合金的腐蚀电流密度随着pH的增大而减小,腐蚀速率降低,电荷转移电阻随着pH的增大而增大,导致合金电极反应阻力增加,合金的耐腐蚀性能得到提高。
(2) 电化学阻抗谱结果表明,CuNi2Si合金在腐蚀过程中主要受溶解氧和氢离子在液相和金属界面之间的扩散过程控制。
(3) Evans图和腐蚀质量损失的计算分析说明,自腐蚀电位并不反映CuNi2Si合金耐腐蚀性能的优劣,腐蚀电流密度可作为特定条件下耐腐蚀性能的判据。

