叶酸缺乏的小鼠胚胎干细胞ES-D3中miR-302a、Bcl2L11表达观察及其靶向关系预测和验证
梁燕,曹丁丁,李媛媛,刘卓,吴建新
1 山东第一医科大学附属省立医院,济南250021;2 首都儿科研究所
胚胎发育是一个复杂的过程,受到遗传与环境的交互调控,但胚胎发育过程中的具体作用机制目前仍未明确。我们前期研究[1~3]发现,叶酸缺乏可导致小鼠胚胎干细胞特异性凋亡增加,引起G0/G1期阻滞,微小RNA302a(miR-302a)可能在其凋亡过程中发挥关键作用。无叶酸培养96 h的小鼠胚胎干细胞中Caspase-3表达升高,但凋亡的具体作用机制目前仍未明确。Bcl2L11 (Bcl-2 interacting mediator of cell death) 作为 Bcl-2 家族中仅包含 BH3 的亚家族成员,是一种重要的凋亡调节蛋白[4]。关于Bcl2L11是否参与叶酸缺乏致小鼠胚胎干细胞凋亡过程,是目前的研究热点。2018年6月~2020年5月,我们观察了叶酸缺乏的小鼠胚胎干细胞miR-302a及Bcl2L11 的表达变化,对胚胎干细胞凋亡中miR-302a、Bcl2L11的靶向关系进行预测和验证,旨在为今后研究营养物质在早期胚胎发育中的作用机制提供科学依据。
1 材料与方法
1.1 细胞、试剂及仪器 小鼠胚胎干细胞系ES-D3为本实验室冻存,培养方法同前期研究[1, 2]。DMEM高糖无叶酸培养基购自北京思赛因公司;L-谷氨酰胺、非必需氨基酸、2-巯基乙醇、丙酮酸钠、胎牛血清、胰酶替代品、DPBS均购自Invitrogen/Gibco公司;明胶粉末购自Amresco公司;重组小鼠白血病抑制因子(rmLIF)购自Millipore公司;哺乳动物蛋白提取试剂盒、总RNA提取试剂盒、荧光定量PCR试剂盒购自北京康为世纪生物有限公司;cDNA逆转录试剂盒购自Promega公司。丝裂霉素C处理的小鼠胚胎成纤维细胞(mouse embryonic fibroblasts,MEF)购自北京干细胞库;Bcl2L11、β-actin抗体购自Cell Signal Technology公司;引物购自上海捷瑞生物有限公司;双荧光素酶报告载体购自广州锐博生物科技有限公司。
1.2 叶酸缺乏的ES-D3细胞miR-302a及Bcl2L11检测
1.2.1 叶酸缺乏细胞培养与分组 取适量ES-D3细胞,置于胚胎干细胞无叶酸培养液中培养,培养液成分如下: 高糖无叶酸DMEM(葡萄糖含量4 500 mg/L)、15%胎牛血清、L-谷氨酰胺2 mmol/L、非必须氨基酸0.1 mmol/L、2-巯基乙醇0.1 mmol/L、丙酮酸钠1 mmol/L、青霉素100 U/L、链霉素100 U/L、rmLIF 1000 U/L。在0.2%明胶包被培养板,制备MEF单层,小鼠胚胎干细胞置于单层上。37 ℃, 5%CO2饱和湿度的培养箱中培养。将细胞分为A、B、C、D组,分别于培养0、24、48、72 h时留取细胞,每组3个复孔。
1.2.2 A、B、C、D组细胞miR-302a、Bcl2L11 mRNA检测 采用实时荧光定量PCR法。取四组细胞,提取总RNA,细胞总RNA提取根据试剂盒步骤,Nanodrop1000分光光度计测总RNA浓度;Promega反转录试剂盒将RNA反转录成cDNA,具体引物序列见表1。反转录条件:42 ℃、15 min,95 ℃、5 min, 4 ℃、5 min; 最后按照FastSYBR Mixture试剂盒步骤进行real time PCR反应,体系为25 μL;扩增条件95 ℃、30 s预变性,95 ℃、20 s,95 ℃、3 s,60 ℃、30 s, 40个循环,每份样品做3个复孔,重复3次。以U6和β-actin作为内参,以2-ΔΔCt代表miR-302a、Bcl2L11 mRNA的相对表达量。

表1 引物列表
1.2.3 A、B、C、D组细胞Bcl2L11(BimEL、BimL及BimS)蛋白检测 采用Western blotting法。取各组细胞进行细胞裂解,Bradford法测蛋白浓度。20 μg蛋白样品以12% SDS-PAGE胶分离后通过湿转法转至PVDF膜上;5%脱脂奶粉室温摇床封闭2 h,分别加兔抗Bcl2L11单克隆抗体(1∶1 000)、兔抗Actin单克隆抗体(1∶5 000)过夜;TBST洗膜3次,10分钟/次,然后与HRP标记的山羊抗兔二抗(1∶5 000)室温孵育2 h,TBST洗膜3次,10分钟/次;增强型ECL化学发光成像,X胶片曝光显影,并扫描为照片。采用Image J 软件对蛋白条带灰度值进行具体量化,以各蛋白与 β-actin蛋白的相对灰度值比值代表目的蛋白的相对表达量。各蛋白重复3次,取平均值。
1.3 miR-302a与Bcl2L11基因靶向关系的预测及验证
1.3.1 miR-302a与Bcl2L11基因靶向关系的预测 登陆生物信息学软件TargetScan、PicTar、MiRanda预测miR-302a与Bcl2L11存在靶向结合位点,结果发现miR-302a与Bcl2L11-3′UTR有三个结合位点。
1.3.2 miRNA-302a与Bcl2L11基因靶向关系的验证 登录NCBI 数据库,输入Gene ID: 10018(gene=“Bcl2L11”),寻找基因序列信息。根据结合位点设计miR-302a引物,以小鼠3T3 细胞基因组DNA为模板,利用双荧光素酶报告载体中的XhoⅠ和NotⅠ两个限制性内切酶,设计3′UTR扩增引物,PCR扩增基因的3′UTR 序列,成功将Bim-3′UTR 795-3006bp片段克隆至pmiR-RB-REPORTTM双荧光素酶报告载体中,扩增总长度为2 233 bp。设计Bcl2L11-3′UTR突变引物,将基因中的三处靶序列 TAGCACTT突变成ACGAGTT。突变型载体测序显示已成功将3处靶序列 TAGCACTT突变成ACGAGTT。所用载体报告荧光为hRluc,校正荧光为hluc(做内参校正),构建Bcl2L11-3′UTR野生载体;设计突变引物将靶标序列突变,构建突变载体。引物序列及靶点测序见表1。

表1 Bcl2L11-3′UTR的引物序列表
miRNA-302a mimics(模拟miRNA-302a表达)及Negative Control(阴性对照,不表达miRNA-302a)分别与Bcl2L113′UTR双报告基因野生载体及突变载体共转染,组分别为1组: Bcl2L113′UTR野生型载体+Negative Control;2组: Bcl2L113′UTR野生型载体+miR-302a mimics;3组: Bcl2L113′UTR突变型载体+Negative Control;4组: Bcl2L113′UTR突变型载体+miR-302a mimics。转染48 h后测定4组报告基因hRluc的相对荧光值。重复3次,取平均值。
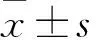
2 结果
2.1 A、B、C、D组细胞miR-302a、Bcl2L11 mRNA相对表达量比较 A、B、C、D组细胞miR-302a 相对表达量分别为1.00±0.20、0.65±0.32、0.50±0.22、0.43±0.24,与A 组比较,D 组miR-302a相对表达量下降(P<0.05)。A、B、C、D组细胞Bcl2L11 mRNA相对表达量分别为1.00±0.00、1.22±0.19、1.82±0.37、3.49±0.45,与A 组比较,D 组Bcl2L11 mRNA相对表达量升高(P<0.05)。
A、B、C、D组细胞BimEL相对表达量分别为0.86±0.02、0.87±0.03、0.92±0.02 、1.10±0.06,与A 组比较,C、D 组BimEL相对表达量升高(P<0.05)。 A、B、C、D组细胞BimL相对表达量分别为0、0.09±0.02、0.16±0.04、0.26±0.03,与A 组比较,B、C、D 组BimL相对表达量升高(P<0.05)。A、B、C、D组细胞BimS相对表达量分别为0、0、0.11±0.04、0.18±0.04,与A 组比较,C、D 组BimS相对表达量升高(P<0.05)。
2.2 miRNA-302a与Bcl2L11基因靶向关系 miR-302a与Bcl2L11存在交互作用。1、2、3、4组hRluc相对荧光值分别为1.00±0.07、0.64±0.02、1.00±0.03、0.95±0.06,与其他组比较,2组hRluc相对荧光值降低(P<0.05)。
3 讨论
胚胎发育是一个极其复杂的过程,受遗传因素和环境因素的交互影响。胚胎生长发育过程是细胞生长、分化、死亡及器官模式形成高度协调的过程,受众多基因和信号通路在多个水平的精密调控,任一相关基因表达或生物过程异常都可能导致畸形产生[5]。叶酸是一种水溶性B族维生素,人体不能合成,需从食物中摄取。胚胎的发育进程中的主要营养物叶酸相对不足常导致胚胎基因组表达失衡,产生基因组和表观基因组损伤,进而影响胚胎发育,导致出生缺陷的发生,特别是引起神经管畸形的发生[6, 7]。虽然孕期补充叶酸可显著降低出生缺陷的发生,但叶酸的作用机理,特别是在胚胎干细胞内的调控机理仍不明确。这也是目前相关领域的研究热点之一。
本项目前期研究提示,无叶酸培养小鼠胚胎干细胞96 h,大部分胚胎干细胞均已发生凋亡,不利于研究整个凋亡过程,故我们选取无叶酸培养4个时间点(0、24、48及72 h)。叶酸缺乏引起小鼠胚胎干细胞干细胞周期特异性凋亡,多个miRNAs参与其中调控,特别是 miR-302a 在此过程中发挥关键作用[1, 8]。miR-302a如何在叶酸缺乏时调控细胞凋亡,其详尽机制仍不明确。目前已知miR-302家族包含7个成员,属于miR-302-367簇,各成员之间的种子区序列高度保守(UAAGUGCU),在小鼠胚胎干细胞、人胚胎干细胞及对应的畸胎瘤细胞和诱导性多能干细胞中特异性表达,通过靶向调节不同的基因,在细胞增殖和凋亡中发挥重要作用[8, 9]。在胚胎发育的早期,miR-92, miR-19, and miR-20 家族成员可靶向调控凋亡前蛋白Bim表达,调控细胞增殖与凋亡[10]。在肿瘤细胞中,miR-92、miR-195及miR-326均可靶向调控Bim表达,影响细胞凋亡[11~13]。本课题组前期研究[2]发现叶酸缺乏时,Caspase-3 在mRNA和蛋白水平表达均上调,表明叶酸缺乏通过Caspase-3途径促进细胞凋亡。Caspase-3作为细胞凋亡的中心环节及执行者,位于整个信号通路的下游。而Bcl-2蛋白家族作为Caspapse上游调节蛋白,可分为两类:抗凋亡蛋白,比如Bcl-2、MCL-1和Bcl-XL;促凋亡蛋白,比如BAX、BAK和BIM。这两类蛋白之间关系错综复杂,通过各种蛋白结合可以维持细胞凋亡状态的平衡。Bim/Bod是一种促凋亡蛋白,属于Bcl-2家族中仅包含BH3的亚家族,该亚家族成员包括 Bad、Bid、Bik、Hrk 和 Noxa,都包含一个 BH3 结构域,但缺乏其他保守的 BH1 或 BH2 结构域[13~15]。本实验结果显示随着叶酸缺乏时间延长,miR-302a表达逐步下调,而Bcl2L11 mRNA及蛋白相对表达量均明显升高,进一步通过生物信息学预测及双荧光报告实验证实两者之间存在靶向调控关系,由此我们推测miR-302a可通过调控Bcl2L11表达,促进细胞凋亡程序启动。
Bcl2L11可通过结合并拮抗 Bcl-2 家族的抗凋亡成员,诱导细胞凋亡[16]。Bcl2L11(Bim)表达时,通过选择性剪切会产生三种主要的 Bim 同工型:BimEL、BimL 和 BimS。BimS是最短的同工型,细胞毒性最强,通常仅在细胞凋亡过程中瞬时表达。BimEL 和 BimL 同工型能通过与动力蛋白轻链相互作用被隔绝到动力蛋白运动复合体,并在细胞凋亡期间从这个复合体上释放[14, 17]。Bim 转录水平调控受到多种信号途径的调节,其中转录因子 FoxO1 通过 PI3K/AKT 信号通路能够聚集细胞内外的多重下游信号分子,调节细胞内外应激信号之间的平衡,参与调控Bim表达,FoxO的磷酸化与非磷酸化状态与转录调节功能密切关系[15,18~20]。后续实验将进一步寻找Bim相关的上游信号通路,构建转录因子-miRNAs-基因共调控网络[21,22],获得转录因子-miRNA参与调控叶酸缺乏影响胚胎发育过程的实验依据。
综上所述,随叶酸缺乏时间延长,ES-D3细胞miR-302a相对表达量降低,Bcl2L11 mRNA及蛋白相对表达量升高。miR-302a可能通过靶向调节Bcl2L11基因表达,在叶酸缺乏引起的ES-D3细胞周期特异性凋亡过程中发挥重要作用,但其中具体信号通路仍需进一步深入探究。

