关注酸式酸根 提升符号表征能力
上海 喻 俊
《普通高中化学课程标准(2017年版)》在课程性质、课程目标、化学学科核心素养和学业质量标准方面都以不同形式提到了学生要能运用符号表征物质及其变化。方程式(化学方程式、离子方程式、电离方程式、水解方程式等)是重要的化学符号,它有独特的魅力,作为联系宏观现象与微观变化的桥梁,能够以最简洁、最灵活的方式表征复杂物质变化或化学反应的内涵,是化学研究较高层次的思维。化学方程式作为化学课程中最核心的化学用语,贯穿整个化学学习全过程。高中阶段化学方程式很多,对于有的物质变化学生具有较高的识记能力,但仍有部分物质的变化规律模糊不清。本文着重以酸式盐和酸式酸根离子为例,探讨高考中的考查方向和学生答题时的解决策略,引导学生学会主动分类并归纳寻找识记方法,降低由方程式书写引起的化学学习障碍和困难,也让学生在化学学习中体会到乐趣。
一、酸式盐固体的稳定性比较
【例1】下列有关说法正确的是
( )
A.(2017天津卷)除去NaHCO3固体中的Na2CO3的实验方法是将固体加热至恒重
B.(2015安徽卷)在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解
C.可用加热的方法区分Na2CO3、NaHCO3固体
D.NaHCO3见光易分解,不易保存
【答案】C
【解析】NaHCO3在加热时不稳定,易分解成Na2CO3、H2O和CO2;Na2CO3稳定,受热不易分解。对NaHCO3和Na2CO3的混合物进行加热,NaHCO3会分解,所以无法除去混在NaHCO3固体中的Na2CO3,A错误;加热时,Na2CO3不易分解,B错误;加热NaHCO3固体时有气体生成,且质量会减少,因而可以用来区分Na2CO3、NaHCO3固体,C正确;NaHCO3分解的条件是加热,不是光照,D错误。
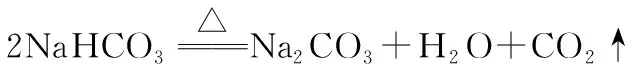
二、酸式盐溶液的酸碱性判断
【例2】(2010四川卷)有关①100 mL 0.1 mol/L NaHCO3、②100 mL 0.1 mol/L Na2CO3两种溶液的叙述不正确的是
( )
A.溶液中水电离出的H+个数:②>①
B.溶液中阴离子的物质的量浓度之和:②>①
【答案】C

盐类水解的规律在生活中有着重要的作用,如可用热的纯碱溶液洗去油污。2019全国卷Ⅰ第26题结合工业生产考查了学生这一知识点的理解与应用,即“可用碱煮水洗的办法去除废铁屑表面的油污”这一方法,这一背景知识在化学教材必修2和选修4中关于碳酸钠的性质中均被提到。可见,高考非常重视对酸根离子水解的应用考查。
【例3】25℃时,同浓度的NaHSO3与NaHCO3溶液分别呈酸性和碱性,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中一定错误的是
( )
A.NaHSO3溶液中由水电离出的c(H+)比NaHCO3溶液中由水电离出的c(H+)小
【答案】D


三、酸式酸根的离子反应书写
【例4】下列对应关系错误的是
( )
A.(2016·全国卷Ⅲ·7A改编)Al2(SO4)3和小苏打反应可以用于泡沫灭火器灭火
C.明矾具有净水的作用
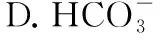
【答案】B


已知氢氧化铝可以和强酸、强碱反应,反应的离子方程式:


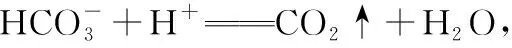


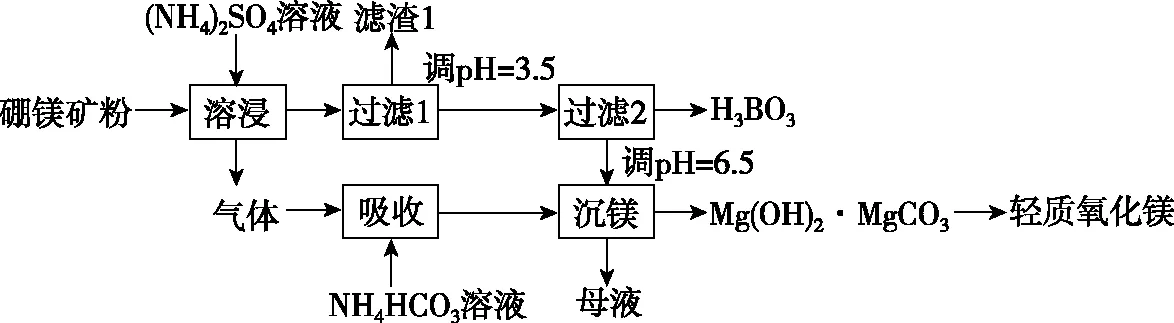
【例5】(2019·全国卷Ⅰ·26节选)硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:
(1)在95℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为______________________________。


【例6】(2019·全国卷Ⅲ·26节选)高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如图所示。回答下列问题:
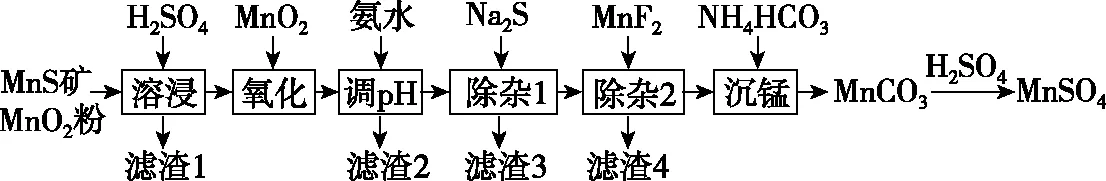
(5)写出“沉锰”的离子方程式_________________
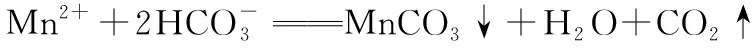
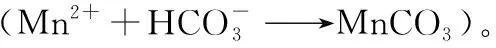
四、酸式酸根的气体除杂应用
【例7】通过盛有足量饱和NaHCO3溶液的洗气瓶,不能除去气体中的杂质(括号中为杂质)的是
( )
A.CO2(SO2) B.CO2(HCl)
C.CO2(CH3COOH) D.CO2(H2S)
【答案】D

【点拨】以H2CO3、H2SO3为例,相应酸、酸式酸根离子、酸根离子之间的转化可用如图表示:

五、教学启示

化学反应千变万化,头绪纷繁,如果仅靠生搬硬套去书写,势必脱离实际,谬误百出。针对这些问题,教师可以在教学中根据题目考查的方向,对某一个或者某一类微粒发生反应的变化规律展开专题讨论和分类研究,并在问题解决过程中引导学生逐步建构起思维模型,以此提高学生学习知识的效率。

