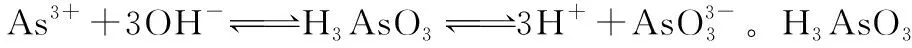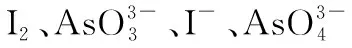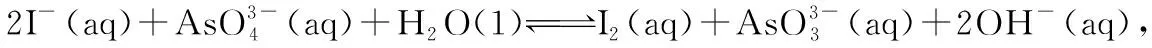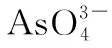高考中陌生的非金属元素——高考化学以非金属元素为背景的试题解题策略初探
吉林 赵鑫光
在高考化学试卷中的非选择题必考题部分,经常以高中课本以外的非金属元素作为命题背景,这体现了高考命题源于教材又高于教材的特点,具有较强的综合性。以这些学生不太熟悉的非金属单质及其化合物为载体,综合考查化学基本概念、物质的制备、化学反应原理、性质及检验等方面的内容。本文选择硼(B)、磷(P)、砷(As)等几种典型的主族非金属元素加以介绍。并配以例题、解析,以期学生通过练习掌握该类试题的解题策略。
一、硼及其化合物
1.单质硼
(1)单质硼有晶态硼和无定形硼两种,熔、沸点高,硬度较大,仅次于金刚石。以正二十面体为基本的结构单元。



2.三氧化二硼(B2O3)

3.硼酸(H3BO3)
(1)硼酸具有片层晶体结构,分子间以氢键连接。在冷水中硼酸溶解度小,在热水中因部分氢键断裂而使溶解度增大。
(2)硼酸在100℃以上易脱水生成偏硼酸(HBO2),继续升温可进一步失水生成四硼酸(H2B4O7),更高温度时完全失水生成硼酸酐,也就是三氧化二硼(B2O3)。


4.硼砂(Na2B4O7·10H2O)


(3)硼砂既可用来鉴别金属,又可用来焊接金属,因为它可以消除金属表面的氧化物。
5.乙硼烷(B2H6)
(1)乙硼烷是最简单的硼烷。常温下,B2H6、B4H10为气体,B5H12至B8H12为液体,B10H14及其他高级硼烷都是固体。
(2)硼烷多数有毒,有令人不适的特殊气味,不稳定。

6.硼氢化钠(NaBH4)
(1)硼氢化钠溶液呈碱性,显棕黄色。

(3)在有机合成中,硼氢化钠可用作醛类、酮类和酰氯类的还原剂。
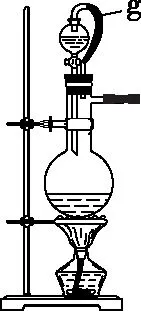
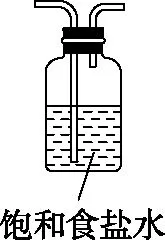
【例1】硼是第ⅢA族元素,单质硼在加热条件下能与多种非金属反应。某同学欲利用氯气和单质硼反应制备三氯化硼。已知BCl3的沸点为12.5℃,熔点为-107.3℃,遇水剧烈反应,生成硼酸和盐酸。该同学选用如图所示的部分装置(可以重复选用)进行实验,请回答下列问题:
A
B
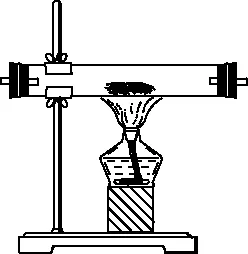
C

E
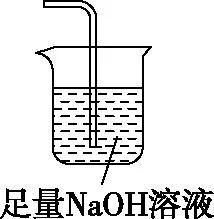
F
(1)装置A中反应的离子方程式为_________________
(2)图中g管的作用是_________________
(3)装置的连接顺序依次为A→________→________→________→E→D→F;在装置E、F间连接装置D的作用是_________________
(4)停止实验时,正确的实验操作是_________________
(5)若硼酸(H3BO3)为一元弱酸,则其钠盐NaH2BO3为________(填“正盐”“酸式盐”或“碱式盐”)。
(6)实验完成后,某同学向装置F中(溶液含有0.05 mol/L NaClO、0.05 mol/L NaCl、0.1 mol/L NaOH)滴加品红溶液,发现溶液褪色。现设计实验探究溶液褪色的原因,请在表中空格处填上数据,完成实验方案。
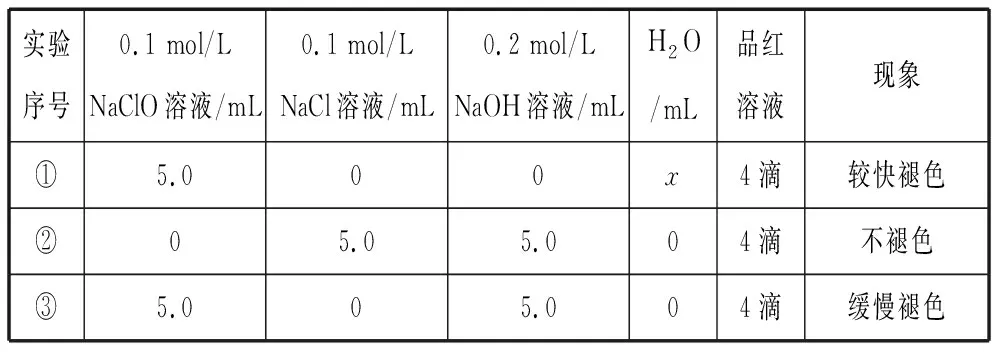
实验序号0.1 mol/LNaClO溶液/mL0.1 mol/LNaCl溶液/mL0.2 mol/LNaOH溶液/mLH2O/mL品红溶液现象①5.000x4滴较快褪色②05.05.004滴不褪色③5.005.004滴缓慢褪色
则x=________,结论:_________________
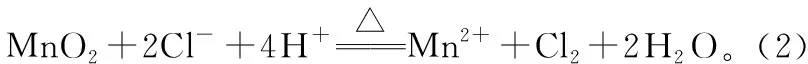
【例2】硼可形成H3BO3、NaBH4、NaBO2等化合物,用途广泛。
(1)H3BO3为一元弱酸,可由硼砂(Na2B4O7·10H2O)与盐酸在加热的条件下反应制得。该反应的化学方程式为______________________________。常温下0.1 mol·L-1的H3BO3溶液pH约为5.0,则H3BO3的电离常数Ka约为________。

如图为NaBH4产率与反应温度的关系曲线:
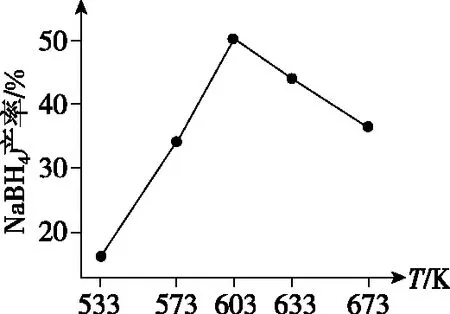
①反应达到平衡时,下列有关叙述正确的是________;
A.生成1 mol NaBH4只需1 mol BPO4、4 mol Na和2 mol H2
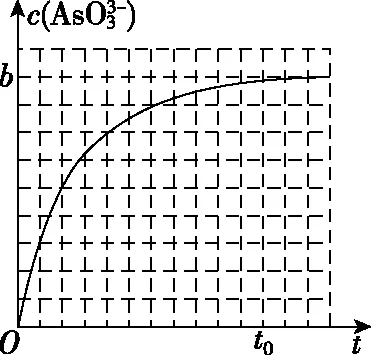
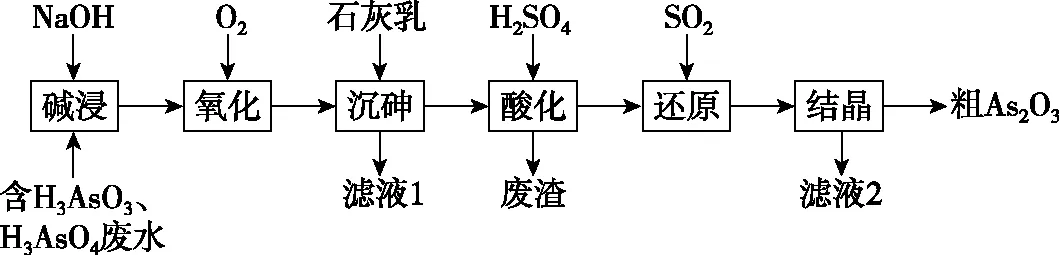
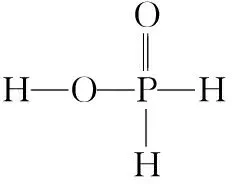
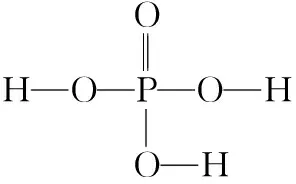
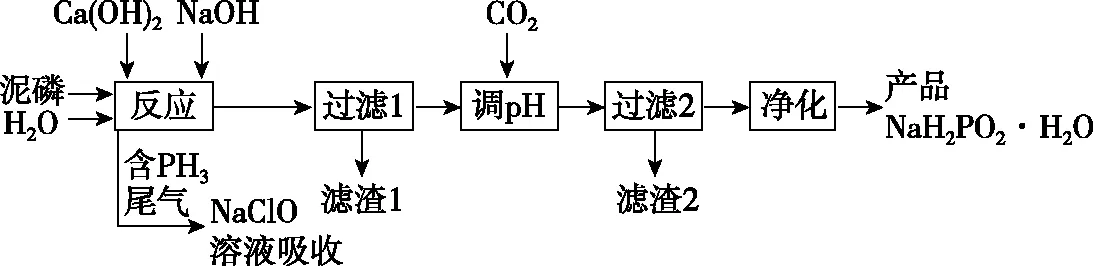
B.若向容器内通入少量H2,则v(放氢) C.升高温度,放氢速率加快,重新达到平衡时容器压强增大 D.降低温度,该反应的平衡常数减小 ②NaBH4的产率在603 K之前随温度升高而增大的原因是_________________ 1.单质磷 (1)磷有多种同素异形体,常见的有白磷、红磷和黑磷。含磷的矿物有磷酸钙Ca3(PO4)2、氟磷灰石Ca5(PO4)3F、羟基磷灰石Ca5(PO4)3(OH)等。 (2)白磷(P4)为正四面体结构,键角为60°,每个分子中含有6个P—P键,不溶于水,易溶于CS2。白磷有剧毒、易自燃,一般要存放在水中以隔绝空气。 2.磷化氢(PH3) 3.三氧化二磷(P2O3)和五氧化二磷(P2O5) 4.次磷酸(H3PO2) 5.亚磷酸(H3PO3) 6.磷酸(H3PO4) (1)磷酸有正磷酸(H3PO4)、偏磷酸(HPO3)和焦磷酸(H4P2O7)。 (3)磷酸二氢盐均能溶于水。磷酸一氢盐和磷酸盐除碱金属盐与铵盐外,均难溶于水。任何一种磷酸盐(正盐或酸式盐)溶液中加入硝酸银溶液,皆生成黄色的Ag3PO4沉淀。 7.卤化磷(PCl3、PCl5) (1)磷与氯气反应,当氯气不足时生成的三氯化磷是液体,当氯气足量时生成的五氯化磷是固体。 【例3】磷化铝(AlP)和磷化氢(PH3)都是粮食储备常用的高效熏蒸杀虫剂。 (1)AlP遇水蒸气会发生反应放出PH3气体,该反应的另一种产物的化学式为________。 (2)磷化氢是一种无色、剧毒、易燃的气体,该气体密度比空气大并有类似臭鱼的味道,其结构和NH3相似,写出磷化氢的电子式:________________;磷化氢具有强的还原性,通入硫酸铜溶液中会生成单质铜和磷酸,写出该反应的离子方程式:______________________________。 (3)磷化氢在空气中的最高允许值为0.3 ppm,空气中超标的PH3气体可以用重铬酸钾、活性炭、氢碘酸处理,你认为上述反应原理是否相同,原因是_________________ (5)工业制备PH3的流程如图所示。 ①黄磷和烧碱溶液反应的化学方程式为____________________,次磷酸属于________(填“一”“二”或“三”)元酸。 ②若起始时有1 mol P4参加反应,则整个工业流程中共生成________mol PH3。(不考虑产物的损失) 【例4】NaH2PO2(次磷酸钠)易溶于水,水溶液接近中性,具有强还原性,可用于化学镀银、镍、铬等。一种利用泥磷(含P4和少量CaO、Fe2O3、Al2O3、CaCl2等)为原料制备NaH2PO2·H2O的工艺流程如下: 已知P4与两种碱的反应主要有 (1)已知H3PO2是一元中强酸,NaH2PO2是________(填“正盐”或“酸式盐”)。 (2)尾气中的PH3被NaClO溶液吸收可生成NaH2PO2,从吸收液中获得NaH2PO2·H2O的操作为________、________、过滤、洗涤和干燥。 (3)用NiCl2、NaH2PO2溶液化学镀Ni,同时生成H3PO4和氯化物的化学方程式为_________________ (5)滤渣2的主要成分为________(填化学式)。 (6)“过滤2”的滤液须用Ag2SO4、Ba(OH)2及Na2S溶液除去其中Cl-及Fe2+等,其中加入的Ag2SO4溶液不宜过量太多,其主要原因是_________________ (7)在工业上,可以用惰性电极电解NaH2PO2溶液制取磷酸,请写出其阳极反应式:_________________ 1.单质砷 (1)As的非金属性比磷弱,与O2反应得到As2O3,而不能直接得到As2O5。 2.三氧化二砷(As2O3)和五氧化二砷(As2O5) (3)As2O5在空气中易潮解,易溶于水,遇热不稳定,在熔点(300℃)附近即失去氧原子变成As2O3。 3.三硫化二砷(As2S3) (1)As2S3俗称雌黄,不溶于水,也不与浓盐酸反应。 (5)As4S4和As2S3均可以与氧气反应生成As2O3,也可以被Zn、C等在加热条件下还原为砷单质。 4.H3AsO4的性质 【例5】砷(As)是第四周期第ⅤA族的元素,能形成多种化合物。回答下列问题: (1)同族元素的同类物质结构相似,AsH3的电子式为________。 ②若t0时刻,溶液的pH=8,则该反应的平衡常数K=________(列式即可)。 【例6】As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水经如下流程转化为粗As2O3。 (1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应的化学方程式是______________________________。 (3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有 研究表明:“沉砷”的最佳温度是85℃。用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是 。 (4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是______________________________。 (5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示。为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是_________________ (6)下列说法中,正确的是________(填字母)。 a.粗As2O3中含有CaSO4 b.工业生产中,滤液2可循环使用,提高砷的回收率 c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的


二、磷及其化合物

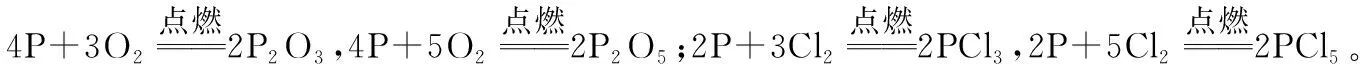
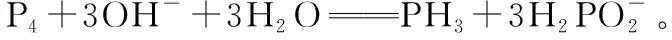

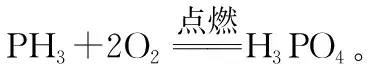












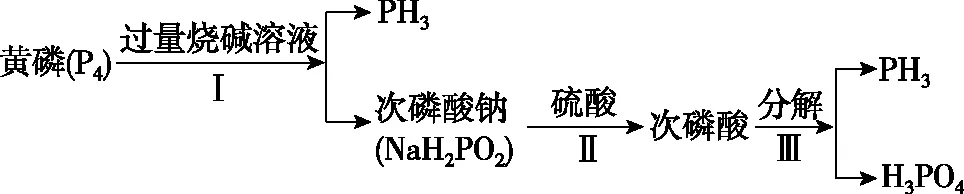








三、砷及其化合物