旋毛虫二肽基肽酶1的免疫保护性研究
廖书漪,徐立新,宋小凯,李祥瑞,严若峰,2*
(1.南京农业大学动物医学院,江苏 南京 210095;2.新疆农业大学动物医学学院,新疆 乌鲁木齐 830052)
旋毛虫病(Trichinosis)是由旋毛形线虫(Trichinellaspiralis)引起的一种食源性人兽共患病,对动物生产和人类公共卫生安全带来严重危害[1]。该病在我国人群和动物中广泛流行,已在猪、犬、牛、羊、猫、鼠、狐狸、黄鼠狼、貂、貉、熊及麂等多种动物中发现该病,随着饲养动物及居民肉类消费量的增加,以及感染动物种类的增加,人的发病率不断呈上升和扩散趋势[2-4]。我国旋毛虫病的防治工作任务艰巨,研究旋毛虫的免疫机理、发掘新的免疫保护性抗原,对防控该病具有重要意义。课题组前期研究发现,旋毛虫二肽基肽酶1(dipeptidyl peptidase 1,Dpp1)在体外对大鼠外周血单个核细胞的增殖、迁移、一氧化氮分泌和吞噬功能等具有促进作用[5]。但该蛋白是否具有免疫保护作用等尚不清楚。鉴于此,本研究在大鼠体内开展了Dpp1的免疫保护试验。
1 材料与方法
1.1 试验动物与虫株
Wistar大鼠、SD大鼠和BALB/c小鼠购自扬州大学实验动物中心。旋毛虫虫株为中国河南猪分离株,国际编号为ISS534,由本实验室传代保存于BALB/c小鼠体内。
1.2 菌种和重组蛋白
重组菌株BL21/pET-32a和BL21/pET-32a-Dpp1由本实验室保存。pET-32a空载体蛋白和rDpp1重组蛋白的表达和纯化方法均参考文献[5]。
1.3 主要试剂
大鼠IL-4、IL-9、IL-17、转化生长因子-β(TGF-β)和IFN-γ的ELISA检测试剂盒购自南京金益柏生物有限公司。HRP标记的山羊抗小鼠IgG、IgG1、和IgG2a抗体为Abcam公司产品。RPMI细胞培养液和胎牛血清购自Gibco公司。
1.4 rDpp1对大鼠分泌细胞因子的影响
将50只标准体重的SD大鼠随机分成5组(n=10)。第1组腹腔注射PBS,第2组腹腔注射160 μg pET-32a空载体蛋白,第3~5组分别腹腔注射10、40和160 μg重组蛋白rDpp1,每组每只大鼠注射体积均为1 mL。于注射前(第0天),注射后第1、2、3、4、5和6天采集血清,用ELISA试剂盒检测IL-4、IL-9、IL-17、TGF-β和IFN-γ等细胞因子的变化。
1.5 rDpp1抗体的制备
将200 μg重组rDpp1蛋白与等体积的弗氏完全佐剂混合乳化后,对Wistar大鼠背部皮下多点注射进行第1次免疫。2周后将与第1次免疫同等体积的重组蛋白混合弗氏不完全佐剂乳化后,进行第2次免疫。之后,每隔1周进行第3次和第4次免疫。第4次免疫1周后,眼眶采血,分离血清并分装,-20 ℃冻存。
1.6 rDpp1抗体对旋毛虫肌肉幼虫感染能力的抑制作用
将30只BALB/c小鼠随机分成3组(n=10),分别为PBS组、阴性血清组和抗rDpp1血清组。在细胞培养板(6孔板选其中3孔)每孔加入8 000条旋毛虫肌肉幼虫,再分别加入500 μL的PBS、阴性血清以及抗rDpp1血清,用含20%胎牛血清的RPMI培养液补至2 mL,37 ℃孵育2 h。检查虫体活力,弃培养液,PBS清洗,每只小鼠经口感染500条肌肉幼虫。小鼠感染5 d后,取小肠,收集成虫并计数。
1.7 rDpp1的免疫程序与攻虫
将60只BALB/c小鼠随机分成3组(n=20),分别命名为rDpp1、pET-32a和PBS组。采用背部皮下多点注射方法进行免疫,于第0天用弗氏完全佐剂乳化蛋白(40 μg rDpp1或pET-32a空载体蛋白)或PBS进行第1次免疫,第14天用弗氏不完全佐剂乳化蛋白或PBS进行第2次免疫。于第28天对每只小鼠灌胃感染肌肉幼虫400条。
1.8 抗rDpp1抗体的检测
分别于免疫后第0、7、14、21和28天,从小鼠眼眶后静脉丛采血,收集血清,用ELISA方法检测抗rDpp1特异性IgG、IgG1和IgG2a抗体水平。
1.9 成虫和肌肉幼虫荷虫数分析
于第33天(人工感染5 d后),每组随机选取10只小鼠,取小肠,分离旋毛虫成虫并计数。于第63天(人工感染35 d后),取每组剩下的10只小鼠、扑杀,分离肌肉组织、称重、剪碎、消化,计算每克肌肉中旋毛虫肌肉幼虫的数量。具体方法参考文献[6]。
2 结果
2.1 rDpp1对大鼠分泌细胞因子的影响
腹腔注射重组蛋白rDpp1后,大鼠体内IFN-γ的分泌水平显著高于PBS空白对照组与pET-32a空载体蛋白对照组(图1A);IL-17的分泌在第2、3天显著低于PBS空白对照组与pET-32a空载体蛋白对照组(图1B)。而与对照组相比,IL-4(图1C)、IL-9(图1D)和TGF-β(图1D)的分泌水平无显著变化。
2.2 抗rDpp1抗体对旋毛虫肌肉幼虫感染能力具有抑制作用
将抗rDpp1抗体与旋毛虫肌肉幼虫共孵育后感染小鼠,对肠道成虫数进行分析,结果如图2所示,PBS对照组旋毛虫成虫数为(438±116)个,阴性血清组为(423±54)个,抗rDpp1血清组为(266±50)个。抗rDpp1血清组成虫数量显著低于PBS组(P<0.05),成虫减少率为39.27%。阴性血清组和PBS对照组间差异不显著。

注:与PBS组比较,*P<0.05,**P<0.01;***P<0.001。下同A.IFN-γ;B.IL-17;C.IL-4;D.IL-9;E.TGF-β图1 rDpp1对大鼠细胞因子分泌的影响

图2 抗rDpp1抗体对旋毛虫肌肉幼虫感染能力的影响
2.3 rDpp1免疫后宿主抗体水平的变化
抗rDpp1特异性IgG、IgG1亚型和IgG2a亚型抗体的检测结果如图3所示,第一次免疫7天后,rDpp1重组蛋白免疫组IgG水平显著高于PBS和pET-32a组(P<0.05),且PBS空白对照组和pET-32a空载体蛋白组之间差异不显著(P>0.05)。第二次免疫后7天与14天(第21、28天),rDpp1组抗体水平持续升高,与对照相比差异极显著(P<0.001)。
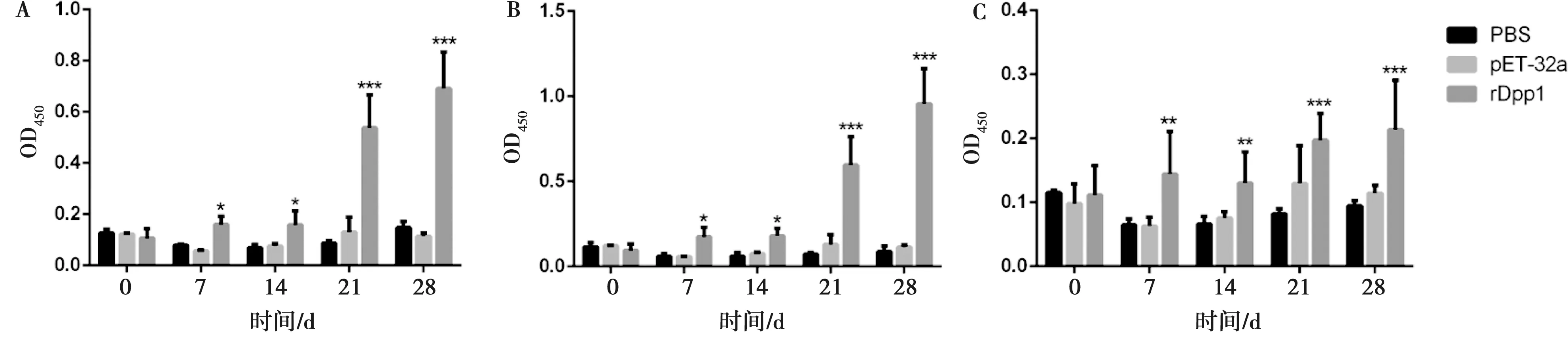
A.IgG;B.IgG1;C.IgG2a图3 小鼠血清特异性抗体的变化
2.4 成虫和肌肉幼虫荷虫量的变化
肠道成虫计数结果如图4A所示,PBS空白对照组旋毛虫成虫数为(109±23)个,pET-32a组为(89±32)个,rDpp1重组蛋白免疫组为(57±20)个。rDpp1免疫组成虫数量显著低于PBS组(P<0.01),成虫荷虫量减少47.70%。pET-32a组和PBS空白对照组差异不显著(P>0.05)。
肌肉幼虫计数统计结果如图4B所示,PBS组每克肌肉中旋毛虫肌肉幼虫数量为(3 393±560)个,pET-32a组为(2 871±616)个,rDpp1重组蛋白免疫组为(1 203±125)个。rDpp1免疫组肌肉幼虫数量显著低于PBS组(P<0.001),减虫率为64.54%。pET-32a组和PBS组差异不显著(P>0.05)。

图4 旋毛虫成虫(A)和肌肉幼虫(B)荷虫数
3 讨论
近年来,旋毛虫病研究在流行病学、诊断、病原生物学等方面取得了重要进展[7-14],特别是旋毛虫基因组计划的实施和基因草图的完成[15],为其分子生物学和免疫学等研究提供了重要支持。然而,目前仍然没有商品化的疫苗用于该病的预防。深入研究旋毛虫与宿主间相互作用,尤其是虫体对宿主的免疫调节机制,对发掘新型疫苗候选抗原具有重要意义。体外试验发现旋毛虫二肽基肽酶1对宿主外周血单个核细胞的免疫功能具有显著的刺激作用,是潜在的免疫保护性抗原[5],本研究通过动物体内试验发现重组Dpp1免疫小鼠后,成虫和肌肉幼虫分别减少了47.7%和64.5%,产生了较好的免疫保护效果。
在抗寄生虫感染过程中,Th1和Th2型免疫反应及相关细胞因子发挥着重要作用[16]。旋毛虫在肠道寄生阶段,开始主要以Th1型免疫应答为主,之后以Th2型为主;在肌肉寄生阶段则以Th2型免疫反应为主,并在肌肉组织附近诱导产生调节型T细胞(Treg)[17]。这些研究结果提示旋毛虫具有较强的调节宿主免疫系统的能力[18]。本研究检测分别代表Th1、Th2、Th9、Th17和Treg等亚型免疫反应的细胞因子IFN-γ、IL-4、IL-9、IL-17和TGF-β,探究rDpp1蛋白对宿主免疫系统的调节作用,结果发现腹腔注射rDpp1后大鼠体内IFN-γ的分泌水平显著高于对照组,推测该重组蛋白能够引起宿主Th1型免疫反应,这与Picherot等[19]认为旋毛虫入侵机体后主要引起Th1型免疫应答相一致。
由Th2细胞介导的体液免疫所产生的特异性IgG抗体,在抗旋毛虫感染中同样发挥重要作用[20]。本研究通过体外抗体阻断试验也直接证明了抗体的抗感染作用。旋毛虫感染诱导机体产生IgG,该类抗体也是免疫学诊断和流行病学调查的重要指标[21]。研究表明中性粒细胞和单核细胞对旋毛虫肌幼虫的杀伤作用主要依赖IgG,通过与IgG类抗体结合发挥ADCC效应[22-23]。IgGl亚型抗体主要反映Th2型免疫应答,而IgG2a亚型抗体水平反映Th1型免疫应答[20]。本研究结果显示,佐剂乳化的rDpp1重组蛋白免疫小鼠后能引起特异性IgG抗体产生,为混合型Th1/Th2免疫应答。
综上,本研究证实旋毛虫rDpp1具有较好的免疫保护作用。研究结果为深入调查Dpp1功能奠定基础。

