细胞衰老过程中POLD1基因表达下调的甲基化调控机制
夏武杰 郑如莲 林维谦 宋 静
衰老是细胞、组织、器官等随着年龄增加,结构和功能出现渐进性退行性改变,最终走向不可逆的死亡过程。既往研究表明,基因组稳定性的维持可能对衰老进程有决定性的影响[1,2]。在DNA修复基因缺失或突变的小鼠模型中,小鼠表现出类似于早衰的表型。如核苷酸切除修复蛋白ERCC1缺失可导致小鼠肝脏、大脑、皮肤和脾脏等组织的衰老[3,4]。反之,寿命的延长则与DNA修复效率提高有关[5]。POLD1是人源DNA聚合酶δ催化亚基的编码基因,在DNA损伤修复以及维持基因组结构的完整性和稳定性等方面发挥着重要作用[6]。近年来研究发现,在阿尔兹海默症患者中POLD1表达随着年龄增长逐渐下降,且与病情进展呈正相关, 推测POLD1可能参与细胞衰老过程[7]。然而POLD1表达下调的机制尚不清楚。DNA甲基化是基因表达调控的重要方式之一,它与衰老、肿瘤、遗传疾病等的发生和发展密切相关。本研究中笔者通过检测人胚肺二倍体成纤维细胞(human embryonic lung diploid fibroblasts,2BS)衰老过程中POLD1基因启动子区甲基化状态及POLD1 mRNA和蛋白表达水平变化,分析去甲基化对POLD1基因表达的影响,探讨2BS衰老过程中POLD1基因表达的甲基化调控机制。
材料与方法
1.材料:(1)细胞株:人胚肺二倍体成纤维细胞株(2BS)由北京大学医学部生物化学与分子生物学实验室惠赠。(2)主要试剂:DMEM培养基、胎牛血清均购自美国Gibco公司;RNA提取及反转录试剂盒、DNA提取试剂盒和DNA重亚硫酸盐转化试剂盒均购自天根生化科技(北京)有限公司;蛋白提取试剂盒购自北京索莱宝科技有限公司;全基因组DNA甲基化测定试剂盒购自美国Epigentek公司;BSP扩增试剂盒购自日本TaKaRa公司;POLD1兔抗人单克隆抗体购自英国Abcam公司,羊抗兔辣根过氧化物酶抗体购自北京中杉金桥生物技术有限公司;5-氮杂-2′-脱氧胞苷购自美国Sigma公司;引物由美国ThermoFisher公司合成。(3)主要仪器:ABI2720PCR扩增仪(美国ABI公司);CX31-32RFL型生物显微镜(日本Olympus公司);5417型台式高速冷冻离心机(德国Eppendorf公司)。
2.细胞培养:使用含有10%胎牛血清的DMEM培养基,在饱和湿度、37℃、5%CO2通用培养条件下培养2BS。当细胞融合度约90%时,细胞1∶2传代培养。30代以下为年轻细胞,55代及以上为衰老细胞。
3.RT-PCR检测POLD1 mRNA表达:提取25PD和55PD 2BS总RNA、第一链cDNA的合成,引物序列及产物大小见表1,以GAPDH为内参,PCR产物在1%琼脂糖凝胶电泳,凝胶成像仪下成像,观察PCR扩增结果。RT-PCR反应条件:95℃预变性2min;95℃变性30s,60℃退火30s,72℃延伸30s,共40个循环;72℃延伸5min。
4.Western blot法检测POLD1蛋白表达:收集25PD和55PD 2BS提取总蛋白,BCA法进行蛋白定量,100℃煮沸5min使蛋白变性后,取50μg总蛋白进行10% SDS-PAGE电泳,蛋白电泳分离后转移至PVDF膜,5%脱脂奶粉封闭1h,一抗封闭,4℃过夜,室温封闭二抗2h,ECL显色,观察结果。以GAPDH表达为内参,用Image J进行相对定量分析。

表1 PCR 反应引物序列及扩增片段长度
5.DNA提取与亚硫酸氢盐修饰后测序:提取25PD和55PD 2BS基因组DNA,将纯化好的DNA溶液,用亚硫酸氢盐DNA修饰试剂盒,按照操作手册进行亚硫酸氢钠的转化。将修饰后的样品进行巢式PCR扩增,引物见表2。然后将PCR产物通过1%琼脂糖凝胶电泳分离后回收纯化,连接T载体后将阳性克隆的样本送日本TaKaRa公司进行测序。RT-PCR反应条件:95℃预变性5min;95℃变性30s,45℃退火30s,72℃延伸40s,共35 个循环;72℃延伸5min。
6.5-Aza-dc去甲基化处理:以2×105个/孔的细胞浓度,将48PD 2BS接种于6孔板中。接种第2天起,每24h更换培养基为5μmol/L 5-Aza-dc的完全DMEM培养基。培养96h后,收集细胞,提取总RNA,采用RT-PCR检测POLD1 mRNA表达水平。

结 果
1.2BS衰老过程中POLD1 mRNA表达水平的变化:采用RT-PCR法检测年轻(25PD)和衰老(55PD)2BS POLD1 mRNA表达情况(图1)。衰老2BS POLD1 mRNA表达水平较年轻2BS显著下降(P<0.01)。
2.2BS衰老过程中POLD1蛋白的表达水平的变化:采用Western blot法检测年轻(25PD)和衰老(55PD)2BS POLD1蛋白表达情况(图2)。衰老2BS POLD1蛋白表达水平较年轻2BS显著下降(P<0.01)。
3.2BS衰老过程中POLD1基因甲基化状态的变化:通过搜索UCSC基因数据库,得到POLD1启动子区基因序列,取转录起始位点-2000bp~+300bp区段序列作为研究对象,采用MethyPrimer在线分析软件对POLD1启动子区基因序列进行甲基化岛预测分析,POLD1启动子区存在4个CpG岛。采用BSP法检测年轻(25PD)和衰老(55PD)2BS POLD1启动子区甲基化水平(图3)。衰老2BS POLD1启动子区甲基化水平较年轻2BS显著升高(P<0.01)。

表2 BSP相关引物信息

图1 不同代龄2BS POLD1 mRNA表达水平A.RT-PCR法检测不同代龄2BS POLD1 mRNA表达量;B.不同代龄POLD1相对mRNA表达量统计分析结果,*P<0.01

图2 不同代龄2BS POLD1 蛋白表达水平A.Western blot法检测不同代龄2BS POLD1 蛋白表达量;B.不同代龄POLD1相对蛋白表达量统计分析结果,*P<0.01
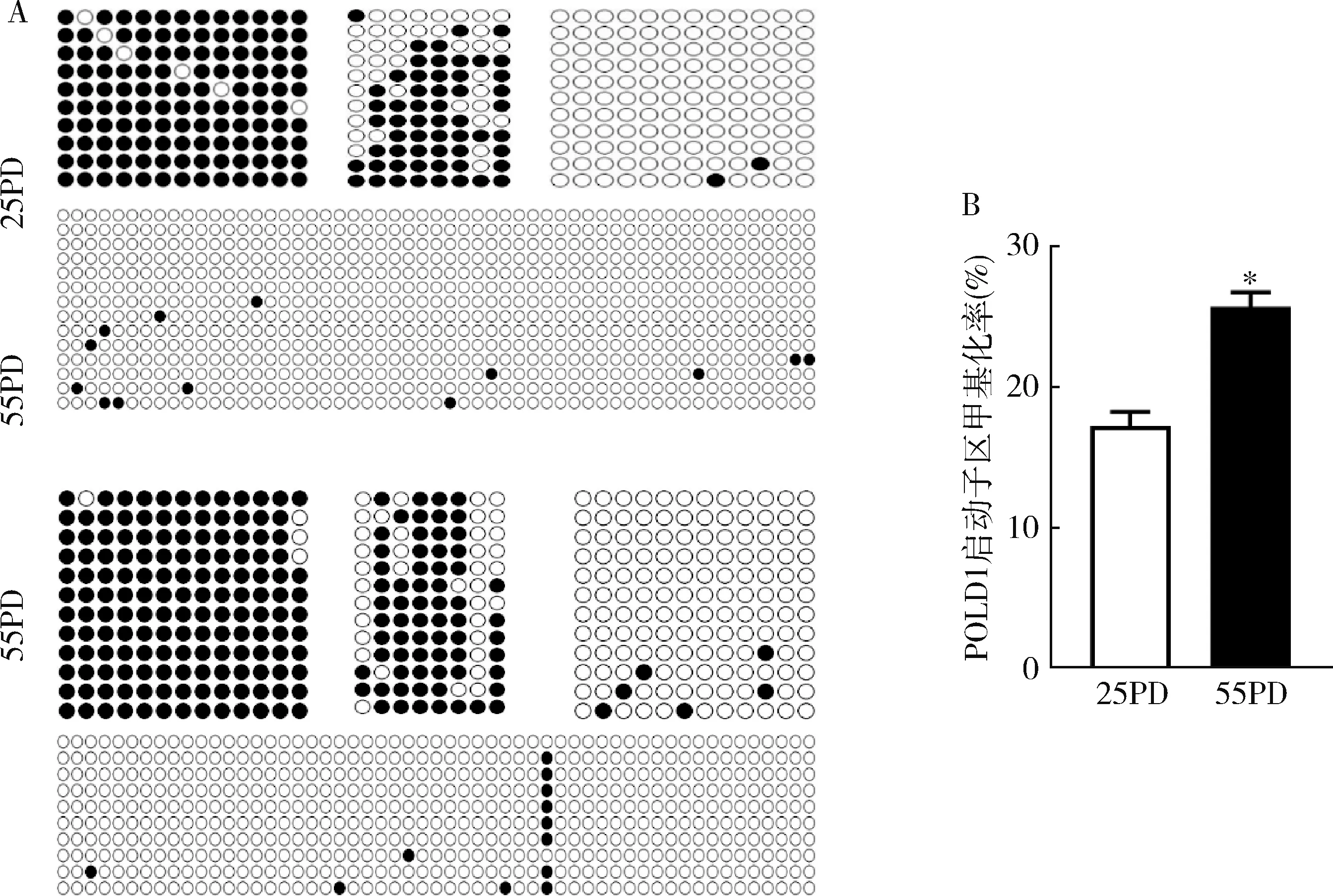
图3 不同代龄2BS POLD1启动子区甲基化水平A.BSP法检测不同代龄2BS POLD1 启动子区CpG岛的DNA甲基化水平;B.不同代龄POLD1启动子区甲基化水平统计分析结果,*P<0.01
4.POLD1 mRNA表达与启动子甲基化的关系:分析年轻和衰老2BS POLD1 mRNA表达水平和其启动子甲基化水平相关性(图4)。POLD1启动子区甲基化水平与其mRNA表达水平呈负相关(n=6,r2=0.853,P=0.009)。为进一步阐明POLD1甲基化与其mRNA表达水平间的关系,以5μmol/L 5-Aza-dc去甲基化试剂处理48PD 2BS,采用RT-PCR法检测POLD1 mRNA表达水平(图5)。去甲基化试剂处理组POLD1表达水平明显增加(P<0.01)。
讨 论
POLD1是DNA复制和损伤修复中最重要的基因之一,位于第19号染色体q13.3-q13.4上,其cDNA全长约3.5kb,编码1107个氨基酸[6]。POLD1基因缺陷不仅与肿瘤关系密切,也增加早老综合征如沃纳综合征(Werner syndrome)的发生风险[8~11]。此外,研究发现,下调POLD1表达,细胞生长增殖能力显著下降,细胞周期减慢,DNA合成减低,DNA损伤明显增加[12]。动物实验进一步证实,沉默POLD1基因表达可导致小鼠神经元细胞发生早衰[7]。近年来,一些研究者观察到DNA损伤修复基因如BRCA1、BLM等在衰老过程中表达均有所降低[13,14]。而本研究结果显示,在2BS衰老过程中POLD1呈增龄性表达下调,也再次证实了上述观点。

图4 POLD1启动子区甲基化水平与其mRNA 表达水平的相关性分析

图5 5μmol/L 5-Aza-dc处理前后POLD1mRNA表达水平A.RT-PCR法检测5μmol/L 5-Aza-dc处理2BS前后POLD1 mRNA表达量;B.5μmol/L 5-Aza-dc处理前后POLD1相对mRNA表达量统计分析结果。NC.正常对照组;*P<0.01
近年来,DNA甲基化在衰老的发生、发展中的作用越来越受到国内外研究者的重视,成为目前衰老领域研究的热点之一。DNA甲基化是指DNA的5′-C胞嘧啶p磷酸G鸟嘌呤-3′(CpG)双核苷酸位点的胞嘧啶在DNA甲基转移酶的催化下,以S-腺苷甲硫氨酸为甲基供体,将甲基转移到特定碱基上的化学修饰过程。一般来说,低甲基化可促进基因的表达,而高甲基化则抑制基因表达。体外研究发现,将已甲基化的序列转入细胞后则其表达抑制,而许多内源基因经去甲基化试剂如5-Aza-dc处理后可被激活[15,16]。本研究结果显示,在2BS衰老过程中POLD1启动子区甲基化水平呈增高趋势,且POLD1 mRNA表达水平与其启动子区甲基化水平呈负相关;经5-Aza-dc处理后,POLD1 mRNA表达水平明显增高。POLD1表达水平与其启动子甲基化水平呈负相关,提示POLD1启动子区甲基化水平的改变与其增龄性表达下调有密切关系。
目前研究认为DNA甲基化影响基因表达的机制可能是:(1)某些可与DNA结合的转录因子对结合位点甲基化较敏感,当该位点处于甲基化状态时,这类转录因子和其他转录相关蛋白无法正确地识别并结合到相应位点从而造成转录抑制。(2)DNA甲基化后,甲基化CpG结合蛋白与甲基化CpG残基结合,并与其他转录抑制因子共同抑制基因转录,其介导的转录抑制取决于甲基化密度和启动子强度,低密度甲基化可能抑制弱的启动子,而一个强的启动子可能不受甲基化的影响。(3)具有转录活性的基因序列甲基化后与甲基化CpG特异性结合蛋白相结合,使组蛋白脱乙酰化,染色质结构变化致使转录抑制发生[17,18]。既往研究发现,POLD1可间接通过p53、E2F1和Sp1等转录因子调控促进肿瘤的发生和发展,推测POLD1启动子区CpG位点甲基化可能通过阻碍转录因子与启动子的结合,从而抑制POLD1基因的转录和表达[19,20]。
综上所述,本研究结果表明,POLD1启动子区CpG岛的DNA甲基化水平是细胞衰老的重要特征,较高的甲基化水平参与该基因的表达调控。通过调节POLD1启动子区DNA甲基化水平,对于衰老和衰老相关疾病的预防和治疗具有一定的启示作用。进一步深入研究POLD1启动子区的DNA甲基化调控机制,有助于更好地阐释细胞衰老过程中的表观遗传学调控机制。

