原发直肠肛管小细胞癌1例报告并文献复习
陈忠胜,李梁和,张建栋,姜洞彬,廖欣,李珀,詹玮
(1.贵州医科大学,贵州 贵阳 550004;贵州医科大学附属医院 2.影像科 3.病理科 4.肛肠外科,贵州 贵阳 550004)
小细胞癌(small cell carcinoma,SCC)属于神经内分泌肿瘤,多发于肺部,肺外SCC占比不到5%,肺外SCC在食管、泌尿生殖系统、咽喉部较多见,直肠肛管SCC属于罕见类型[1-2]。直肠肛管SCC的临床表现及影像学特征不明显,术前诊断困难,但其往往进展较快、容易发生远处转移,预后极差,平均存活时间小于1年,5年生存率低于10%。目前国内外关于直肠肛管SCC文献较少,缺乏大量的前瞻性研究数据,临床上尚无统一的最佳治疗方法[3-5]。本文报道1例原发直肠肛管SCC的诊疗过程,进行临床资料分析并对复习国内外相关文献,加深对该疾病的认识,提高对该类疾病的诊疗水平,现报告如下。
1 病例资料
患者 女,51岁。因“间断少量便血2年,加重3周”于2019年9月12日入院。无腹痛、腹胀,无恶心、呕吐、畏寒、发热等不适,小便正常。无传染病史,既往无手术、外伤史,否认家族相同病史。入院体检:体温36.7℃,脉搏86次/min,呼吸20次/min,血压115/78 mmHg(1mmHg= 0.133 kPa)。腹部平坦,未见胃肠型及蠕动波,未见腹壁静脉曲张,全腹无压痛,无明显反跳痛及肌紧张,肝脾肋下未扪及,移动性浊音阴性,肝浊音界存在,肠鸣音弱,3次/min。肛门指检:膝胸位,肛门处可见少量鲜红色血液,距肛缘约1 cm,直肠左侧壁、后壁,可扪及大小约5 cm×3 cm菜花样肿块,质韧,活动度可,触痛,退指血染。结肠镜:距肛缘1 cm处肛管直肠内见环1/3周新生物,表面粗糙,充血水肿,边界不清,触之易出血(图1A)。盆腔MRI:直肠下段及肛管占位,病灶长约48.5 mm,宽约22.5 mm,主要位于直肠左侧壁、后壁,侵及肠腔壁70%,伴周围1~3枚肿大淋巴结,EMVI分级:III级(图1B-C)。胸部CT、上腹部和中腹部CT、全身核素骨扫描、血清肿瘤标志物等未见明显异常。经肠镜下行组织活检2次,病理及免疫组化:细胞核深染,细胞质稀少,染色质细颗粒状,呈圆形或短梭型,CD56(+)、Syn(+)、Ki-67(+90%),结合HE组织形态及免疫组化标记结果支持为SCC。2019年9月26号行“腹腔镜辅助Miles手术”,术中见肿瘤大小约5 cm×3 cm×3 cm,环绕肠腔1/3周,并与左侧盆壁粘连。术后病理诊断:肿瘤大小约 5 cm×3 cm×3 cm,肿瘤侵及深肌层,肛门切缘、肠切缘及环周切缘未见肿瘤累及,周围脂肪组织淋巴结(2/27)(图2A)。术后病理组织形态:在HE染色中,细胞核深染,细胞质稀少,染色质细颗粒状,呈圆形、卵圆形或短梭形(图2B)。免疫组化:CD56(+)、Syn(+)、Ki-67(+90%)、pc(+)、EMA(+)、P16(+)、PCK(+)、P63(+)、CEA(-)、CK(-)、CgA(-),NSE(-)、TTF-1(-)、RB1(-)、CD117(-)、P53(-)、SSTR2(-)(图2C-E)。综合患者临床表现、术中所见、影像学、病理及免疫组化检查,诊断为直肠肛管SCC(pT2N1bM0 IIIA期),术后采取“会阴疤痕+瘤床+骶前区+直肠系膜区+髂内、闭孔淋巴结引流区+坐骨直肠窝”的盆腔放疗方案,总共完成DT 50.4 Gy,共28次,并同步顺铂化疗,放疗后采取“依托泊苷+顺铂”的EP化疗方案,总疗程6周期。术后进行定期随访,病史和体检、血清肿瘤标志物,每3个月复查1次;胸腹部CT、盆腔MRI,每6个月复查1次;肠镜1年内已复查1次,均未见明显异常,目前已无瘤生存13个月,现患者继续随访中,拟术后15个月再次随访病史和体检、血清肿瘤标志物检查等。
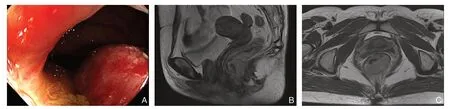
图1 术前检查资料 A:肠镜;B:盆腔MRI 矢状位;C:盆腔MRI 横断位Figure1 Preoperative examination data A:Colonoscopy;B:Axial plane image of pelvic MRI;C:Transverse plane image of pelvic MRI

图2 术后病理资料 A:手术切除大体标本;B:组织病理切片(HE×100);C:免疫组化CD56 阳性(×100);D:免疫组化Syn 阳性(×100);E:免疫组化Ki-67 阳性率90%(×100)Figure2 Postoperative pathological data A:Gross surgical specimen;B:Histopathological section (HE×100);C:Positive immunohistochemical CD56 staining (×100);D:Positive immunohistochemical Syn staining (×100);E:Immunohistochemical staining for Ki-67 with positive rate of 90% (×100)
2 文献复习并讨论
直肠肛管肿瘤中,直肠肛管SCC占比<1%,文献报道较少。原发直肠肛管SCC被认为起源于神经内分泌干细胞,进一步演变成具有侵袭和远处转移的肿瘤[5-6]。直肠肛管SCC起初多以大便性状改变或便血为主要临床表现,很少表现出明显的面色潮红、痉挛性腹痛、腹泻等类癌综合征,其临床症状不典型,难将其与常见的直肠肛管腺癌鉴别出来[3,7]。影像学检查对发现肿瘤的部位和大小、局部浸润情况、淋巴结的肿大和远处转移有着重要的作用,但无法确诊为直肠肛管SCC[8]。肠镜下活检组织的病理学检查是确诊直肠肛管SCC的方法,在光镜下观察细胞形态,小细胞肿瘤往往呈圆形或梭形、胞质稀少、核染色质呈细颗粒状、核仁不明显的特征[9]。但在临床操作中,直肠肛管的病理活检标本通常从肠腔的表浅部位获得,常伴有多种组织细胞,并且容易发生挤压变形出现坏死出血的成分,这对细胞的形态产生了很大的影响,给SCC的诊断带来了一定的困难,需要进一步结合免疫组化检查进行诊断[5,10]。Syn、CgA、CD56、NSE 等免疫组化标记物作为常用的胃肠胰神经内分泌肿瘤的检测指标,通常对存在两种及两种以上的免疫组化标记物阳性时,结合组织形态可确诊为小细胞肿瘤。Ki-67增殖指数作为胃肠道神经内分泌肿瘤中的分级指标,其第一、二、三级分别对应Ki-67增殖指数≤2%、3%~20%、>20%,指数越高往往其预示恶性程度越高,侵袭性和转移性越高,预后越差[3,9,11]。对于直肠肛管SCC的治疗包括手术切除、放疗、化疗、免疫治疗及靶向治疗等多种方法,然而目前对于治疗直肠肛管SCC缺乏大量的前瞻性数据研究,尚无统一标准的最佳治疗方式[6]。由于SCC具有高侵袭性、高复发性和较高的远处转移潜能,更有研究[12]指出直肠肛管SCC在早期就可发生血液转移和淋巴转移,因此目前其总体治疗效果欠佳,中位生存期为5~12个月,5年生存率不超过10%[6,13-14]。
目前国内外对于直肠肛管SCC的手术方案包括根治性手术、局部切除和内镜下切除术,针对肿瘤直径<2 cm且局限于黏膜下层的早期直肠肛管SCC,对于选择局部切除或内镜下切除的适应症仍然存在争议[15-16];但当肿瘤直径超过2 cm时或浸润深度超过黏膜下层,以及局部进展期的患者,则必须行根治性手术;对于发生远处转移的患者,则应根据情况行根治手术治疗[17]。有研究[13]对 652例结直肠SCC进行回顾性分析,进行单纯手术治疗的患者中位生存期为10.5个月,相比未接受手术治疗患者中位生存期(6.9个月)明显延长。
放射治疗通过控制肿瘤的进展和术后复发从而提高患者的生存率,直肠肛管SCC的放疗主要针对原发肿瘤部位和区域淋巴引流区进行盆腔照射,对于头颅部位进行预防性的放疗仍然存在争议,主要应用三维适形放疗或调强放疗技术,进行长程放疗,并同步以铂类药物为基础的化疗[14,18-19]。Modrek等[20]通过71例早期直肠肛管SCC的回顾性研究发现,未接受放疗与接受放疗的患者的中位生存期分别8个月与26个月;未接受放疗与接受放疗的患者的1年总体生存率为分别37.8%、71.1%。多项研究[1,4,21]表明,放疗对控制直肠肛管SCC的进展、术后复发和转移有着明显的疗效。
化疗是治疗SCC的重要组成部分,但目前对于直肠肛管SCC无标准的化疗方案可供使用,主要参照小细胞肺癌的治疗经验[22]。基于SCC对铂类药物化疗较为敏感,主要包括以铂类药物为基础联合依托泊苷、伊立替康或拓扑替康的化疗方案,其中以“顺铂+依托泊苷”的EP化疗方案较为安全有效,一般化疗4~6个周期[23]。有研究[13]显示对于结直肠SCC患者术后辅以EP方案化疗,能将其中位生存期提高1~5个月。
靶向治疗和免疫治疗是当今肿瘤治疗的研究热点,特别是在非小细胞肺癌、乳腺癌等常见肿瘤中得到了广泛的研究应用。对于结直肠癌的靶向治疗中,包括以表皮生长因子受体药物西妥昔单抗和帕尼单抗,人类表皮生长因子受体2 药物曲妥珠单抗和帕妥珠单抗,酪氨酸激酶抑制剂拉帕替尼,抗血管内皮生长因子药物贝伐单抗和阿柏西普等靶向药物[24-25]。目前对于晚期结直肠癌患者,可根据基因突变情况进行靶向药物的选择,此外靶向治疗联合化疗是当前治疗的趋势,可延长晚期结直肠腺癌患者总体的生存期,但耐药问题始终是制约着靶向治疗的临床应用[26]。目前结直肠癌的免疫治疗方法主要包括肿瘤疫苗、免疫细胞治疗、免疫检查点抑制剂(checkpoint inhibitor,CPI)治疗,其中CPI是当前研究的热点。自2015年以来,以程序性细胞死亡蛋白1(PD-1)和细胞毒性T淋巴细胞相关抗原4(CTLA-4)单抗为代表的CPI药物应用于临床治疗结直肠癌,目前免疫治疗针对晚期结直肠癌中的微卫星高度不稳定患者取得了良好的疗效,然而其人群比例仅占5%~8%,但对于微卫星稳定人群未能取得相似的疗效,如何将免疫疗法扩展到微卫星稳定型结直肠癌需要进一步的研究[27-28]。由于直肠肛管SCC的罕见性和特殊性,其靶向治疗和免疫治疗目前缺乏足够的研究,主要参照常见的小细胞肺癌的研究及应用,然而小细胞肺癌的相关研究进展缓慢,并且治疗效果不理想,其有效性及安全性需要得到进一步的证实[29]。随着深入探索肿瘤的发生、发展、信号通路和基因改变的机制,以及免疫学基础研究的突破,有望扩大靶向治疗和免疫治疗在直肠肛管SCC中的临床应用。
因此,目前临床上对于直肠肛管SCC的治疗主要通过手术切除,辅以放化疗的综合治疗[30]。Conte等[31]报道89例结直肠SCC的临床治疗观察,其中手术切除为主辅以放化疗的综合治疗方案与单纯手术治疗相比,能使患者的中位生存期提高 5个月。多项研究指出,对于早期或局部进展期的直肠肛管SCC,手术切除联合放化疗的综合治疗,能提高其总体的远期生存率[13-14,32]。
现回顾分析病史,本例患者的临床特点和影像学检查与常见的直肠腺癌表现相似,通过2次术前肠镜活检,肠镜下的病理活检取材较为困难,经活检病理提示为直肠肛管SCC,遂行“腹腔镜辅助Miles手术”。术后病理:距肛缘1cm处找见肿瘤,大小约5 cm×3 cm×3 cm,肿瘤侵及深肌层,肛门切缘、肠切缘及环周切缘未见肿瘤累及;周围脂肪组织淋巴结(2/27);在光镜下,胞核深染,胞质稀少,染色质细颗粒状,细胞呈圆形、卵圆形或短梭形,CD56(+)、Syn(+)、Ki-67(+90%)。结合本患者临床症状特点、辅助检查、手术及术后病理结果证实为直肠肛管SCC(pT2N1bM0 IIIA期),同时根据免疫组化Ki-67(+90%)归类为神经内分泌肿瘤G3级别,其恶性程度高,易发生远处转移,因此术后辅以放疗和化疗的综合治疗[9]。放疗参照直肠癌Miles术后的放疗方案,予以“会阴疤痕+瘤床+骶前区+直肠系膜区+髂内、闭孔淋巴结引流区+坐骨直肠窝”的盆腔放疗,总共完成DT 50.4Gy,共28次,并同步顺铂的基础化疗[19]。后续采取针对SCC敏感的“依托泊苷+顺铂”的EP化疗方案,总疗程6周期[22]。术后定期复查,近期随访患者未见肿瘤复发和转移,预后良好,已无瘤生存13个月。与目前国内外相关研究报道相比,直肠肛管SCC的平均生存时间小于1年,中位生存时间5~12个月[3,14,33],本例患者表现出较好的疗效。这表明本研究对局部进展期的直肠肛管SCC通过根治性手术治疗,术后辅以放疗、化疗的综合治疗,较好的控制了肿瘤细胞的局部复发和远处转移,预后良好,但本研究病例今后应继续进行长期的随访观察。
直肠肛管SCC患者临床症状及影像学表现与常见的直肠肛管腺癌相比不具有特异性,确诊直肠肛管SCC需要结合病理检查和多种免疫标记物。针对该患者,笔者认为对于局部进展期的直肠肛管SCC,尽早行根治性手术是治疗的关键,术后辅以放疗和EP化疗方案的综合治疗,能提高患者的生存期。

