羧基酯脂肪酶在结直肠癌中的表达及其生物学功能
王磊,刘洁,黄伟
(中南大学湘雅医院 1.肿瘤科 3.癌变机理与靶向治疗研究室,湖南 长沙 410008;2.中南大学肿瘤研究所,湖南 长沙 410008;4.湖南省长沙市中心医院 病理科,湖南 长沙 410004)
结直肠癌是最常见的消化道恶性肿瘤,其发病率和病死率均位居恶性肿瘤的前列[1-2]。随着经济的飞速发展和物质生活水平的提高,我国人民群众的生活习惯及饮食结构的发生了很大改变,导致结直肠癌等西方国家高发的消化系统肿瘤在我国的发病率呈逐年上升趋势,且中青年的发病占比上升趋势明显[3-4]。根据2018国家癌症中心公布的最新全国癌症统计数据,结直肠癌的发病率位列第三,病死率位列第五,且30岁以上人群的发病率快速增高。随着基础研究的深入、积累和转化,结直肠癌的临床诊断和治疗取得了较为显著的提高,结直肠癌患者,尤其是早期患者的5年生存率及荷瘤生活质量有了较大提升[5-6]。但整体来看,结直肠癌的早诊率和治疗水平仍有待进一步提升。因此,深入研究结直肠癌的发病机理,开发和鉴定结直肠癌早期诊断标志物和治疗靶点是进一步提升结直肠癌临床疗效有效方式。
羧基酯脂肪酶(carboxyl ester lipase,CEL)是由胰岛滤泡细胞分泌并进入消化道,也可以由泌乳的乳腺分泌进入乳汁,参与胆固醇、甘油脂、脂溶性维生素脂等脂质消化和吸收的脂肪酶,可促进乳糜微滴在肠道的生成[7-9]。CEL蛋白包含753个氨基酸,分子量为79 kD,其编码基因位于9q34.13,长度约为10 kb,包含11个外显子和10个内含子。CEL基因的第11号外显子富含可变数目串联重复序列(variable-number tandem repeat,VNTR),通常为11~21个。VNTR的多态性是重要的遗传标记,与CEL的功能可能存在相关性[10-11]。目前,已证实CEL的多态性/突变与动脉粥样硬化、糖尿病及胰腺炎等病理过程密切相关[12-14]。随着转录组测序数据的完善,CEL也被证实在肿瘤中存在高表达,提示其在多种肿瘤、尤其在消化道肿瘤的发生发展中可能扮演了重要作用[11,15-16]。因此,本文研究了CEL在结直肠癌中的表达情况,并利用细胞模型对CEL在结直肠癌中的基本生物学功能进行了初步探讨,为CEL在结直肠癌中的应用提供实验依据。
1 材料与方法
1.1 细胞及主要试剂
人结直肠癌细胞系SW620、SW480、HCT116和人正常结肠上皮细胞NCM460均为本实验室保存。RPIM-1640培养基为GE公司HyClone品牌,胎牛血清及0.25%胰蛋白酶购自于以色列BI公司。RNAsimple总RNA提取试剂盒(DP419),FastKing一步法除基因组cDNA第一链合成预混试剂(KR118),SuperReal PreMix Plus(SYBR Green)(FP205)均购自北京天根生化科技有限公司。CEL抗体和β-actin抗体购买于武汉爱博泰克生物科技有限公司。免疫组化试剂盒购自北京中杉金桥生物技术有限公司。CEL siRNA转染试剂盒(含对照盒转染试剂)购于广州锐博生物科技有限公司。蛋白快速裂解液、5×蛋白上样缓冲液、BCA蛋白浓度测定试剂盒购自上海雅酶生物科技有限公司。CCK-8、SDS-PAGE胶等试剂购自上海碧云天生物科技有限公司。
1.2 临床标本
56对结直肠癌标本及癌旁标本收集于2017年11月—2019年2月期间在长沙市中心医院普通外科住院的手术初诊患者,且均未接受放疗和化疗等治疗。其中男30例,女26例;年龄25~65岁,平均年龄(48.42±8.24)岁,其中无转移患者38例,转移患者18例。所有标本均一分为二,一部分于液氮中冻存,用于RNA抽提,一部分于福尔马林中固定,用于后续制作石蜡切片。所有标本均经病理科确认。所有标本收集前,均签署了患者知情同意书,并获得了长沙市中心医院医学伦理委员会批准。
1.3 方法
1.3.1 数据库分析UALCAN数据库整合了TCGA的基因表达数据和启动子甲基化数据[17]。GEPIA数据库除了整合了TCGA数据外,还包含了GTEx中的数据,具有更多的正常样本量[18]。本文利用UALCAN数据库(http://ualcan.path.uab.edu)和GEPIA(http://gepia.cancer-pku.cn)数据库分析CEL在结直肠癌中的表达情况和启动子区甲基化状态情况。
1.3.2 免疫组织化学实验按笔者以往方法[19]和试剂盒说明,进行免疫组化操作,简述如下。石蜡切片标本60℃熔蜡1 h,二甲苯脱蜡2次(3 min/次)梯度酒精脱水(100%→100%→95%→85%→75%,3 min/次),自来水水化1 min。切片随后进行高压抗原修复(柠檬酸钠)、内源性过氧化物酶去除、血清封闭、CEL一抗(稀释度:1:100)4℃过夜孵育、生物素标记二抗工作液孵育、HRP 标记的链霉亲和素孵育、DAB 显色、复染、脱水透明及中性树胶封片后,于正立显微镜下观察。根据染色强度和染色面积进行定量分析,无着色为0分,黄色为1分,棕黄色为2分;阳性细胞比例≤25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分;两者得分之积为最终得分,分数≥4分为高表达,<4分为低表达[19-21]。
1.3.3 细胞培养所有细胞的培养基配方均为包含10%胎牛血清的RPIM-1640培养基,于37℃,5%CO2的细胞培养箱内培养,细胞汇合度达到70%~80%时,进行消化,传代,接种细胞等操作,在良好的细胞状态下进行相关实验,保证结果的有效性。
1.3.4 siRNA转染按照已发表文章进行转染操作,简述如下[22]。转染前1 d,将SW620 细胞按2×105/孔的密度接种于6孔板中,保证转染前细胞汇合度在30%~40% 左右。根据siRNA 转染试剂盒的说明进行转染操作,siCEL和siRNA 阴性对照序列(siNC)的转染终浓度的100 nmol/L,转染6 h后,更换含血清的新鲜培养基。siCEL和siNC 均购买自广州锐博生物科技有限公司,siCEL序列为:5'-CCC GTT ATG ATCTGG ATCTAT-3',siNC 序列为公司赠送,出于商业保密,未提供具体序列。
1.3.5 总RNA抽提及qPCR检测按笔者已发表的论文[22]和试剂盒说明,抽提结直肠癌组织和细胞的总RNA和进行逆转录。利用SuperReal PreMix Plus 试剂,参照说明,配制qPCR 体系,利用ABI 7900 荧光定量PCR 仪运行PCR 操作,检测CEL在结直肠癌组织和细胞中的相对表达水平,利用2-ΔΔCt法进行相对定量。qPCR 引物如下:CEL上游引物5'-TGG GTG ACT CTG TGG ACA TCT-3',下游引物5'-GCA GGC ATCTCT TCT TGA AGT T-3',产物大小129 bp;GAPDH 上游引物5'-CTG GGCTAC ACT GAG CAC C-3',下游引物5'-AAG TGG TCG TTG AGG GCA ATG-3',产物大小101 bp。
1.3.6 细胞总蛋白提取及Westernblot 按文献[19]方法进行相关操作。简述如下,待裂解细胞经PBS 洗涤后,甩干残余后,按照1×106个细胞加入100 μL 蛋白裂解液的比例,于冰上裂解蛋白 15 min,收集蛋白,超声处理后,经14 000 r/min离心,取蛋白上清保存,分装包装。选取10 μL 蛋白进行蛋白浓度测定,具体步骤参照说明书。蛋白按比例加入5×蛋白上样缓冲液,100℃煮沸5 min 变性,冷却后以30 μg/孔上样,经12%的SDS-PAGE 电泳分离后,利用湿转法将蛋白转印至PVDF 膜后,经5%脱脂牛奶封闭,CEL 一抗孵育,TBST洗涤,二抗孵育,TBST洗涤后,利用Bio-Rad 凝胶成像系统进行化学发光。
1.3.7 CCK-8分析根据已发表的论文和试剂说明书进行CCK-8 实验[19]。将处于对数生长期的敲低CEL表达的SW620细胞和对照细胞,按1 000个 细胞/孔的密度接种于96孔板,每隔24 h,连续4次,分别取5个孔,每孔加入10 μL CCK-8试剂,孵育1 h后,利用Bio-Tek 酶标仪,测量450 nm 波长下,各孔的吸光值,扣除空白本底后,绘制生长曲线。
1.3.8 平板克隆形成实验按笔者以往方法[19]进行平板克隆形成实验,简述如下:将处于对数生长期的敲低CEL表达的SW620 细胞和对照细胞,按每孔1 000个细胞,接种于6 孔板,每种细胞设置3个复孔。细胞连续培养8 d后,利用甲醇固定15 min,随后利用0.5%结晶紫染色15 min,经自来水漂去除游离染色液后,计算各孔的克隆数目(蓝色)。于倒置显微镜镜下观察每个克隆的细胞数目,>50个细胞的克隆,计算为1个有效 克隆。
1.3.9 Transwell小室迁移和侵袭实验 按文献[19]方法进行Transwell 小室迁移和侵袭实验,简述如下。消化和收集处于对数生长期的CEL表达敲低的SW620 细胞和对照细胞,利用RPIM-1640培养基(不含血清) 重悬细胞,调整细胞密度至50 000 细胞/mL,分别于预铺有Matrigel和未铺Matrigel的Transwell小室中加入500 μL细胞悬液,使细胞总数为25 000个。同时,在下室孔中(24孔板)加入750 μL 含15%FBS的RPMI-1640的完全培养基,于细胞培养箱中继续培养24 h后取出,经甲醇固定15 min,0.5%结晶紫染色15 min,经自来水漂洗后,利用棉签小心刮除Transwell 小室上层的细胞,于显微镜下观察细胞穿过情况,随机选取5个视野,计算穿过细胞的平均数。
1.4 统计学处理
利用SPSS statistics 20.0和Graphpad prism 6.0进行统计学分析和作图。平均OD值、平均克隆数、平均细胞数等计量资料以均数±标准差(±s)表示,两组数据间比较采用t检验;计数资料比较利用χ2检验或Fisher精确检验(n<5)。P<0.05为差异有统计学意义。
2 结 果
2.1 在线数据库分析
为了初步分析CEL在结直肠癌中的表达水平,利用UALCAN和GEPIA在线工具分析CEL在结直肠癌和正常组织中的表达差异UALCAN数据库结果显示,CEL在结直肠癌组织中的表达水平显著高于正常结直肠组织(P<0.001)(图1A)。GEPIA数据库同样显示,CEL在结直肠癌组织中的表达水平明显高于正常结直肠组织(P<0.05)(图1B)。另外UALCAN数据库甲基化分析结果显示,结直肠癌组织CEL的启动子区甲基化水平明显低于正常结直肠组织(P<0.001)(图2A-B),提示启动子区的低甲基化可能是CEL在结直肠癌中高表达的重要原因。
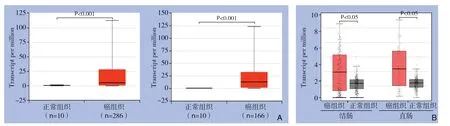
图1 在线数据库分析CEL在结直肠癌中的表达 A:UALCAN 结果显示,CEL在结肠癌和直肠癌中的表达水平明显高于正常组织;B:GEPIA 结果显示,CEL在结肠癌和直肠癌中的表达明显高于正常组织Figure1 Analysis of the expression level of CEL in colorectal cancer using online databases A:UALCAN results showing that the expression level of CEL in colon cancer and rectal cancer are significantly higher than those in normal tissues;B:GEPIA results showing that the expression of CEL in colon cancer and rectal cancer are significantly higher than those in normal tissues
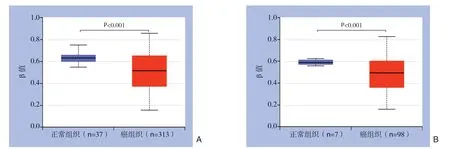
图2 利用UALCAN分析CEL在结直肠癌中的启动子甲基化水平 A:结肠癌中CEL1 启动子区的甲基化水平明显低于正常组织;B:直肠癌中CEL1 启动子区的甲基化水平明显低于正常组织Figure2 Analysis of the promoter methylation level of CEL in colorectal cancer using UALCAN A:The promoter methylation level of the CEL1 region in colon cancer is significantly lower than that in normal tissues;B:The promoter methylation level of the CEL1 region in rectal cancer is significantly lower than that in normal tissues
2.2 CEL在结直肠癌组织和细胞中的表达
为了验证在线分析的相关结果,在收集的结直肠癌组织及培养的结直肠癌细胞系中检测了CEL的表达水平。qPCR结果显示,CEL在结直肠癌组织中的表达水平明显高于其在癌旁组织中的表达水平(P<0.001)(图3A)。免疫组化结果显示,CEL蛋白在癌旁组织中低表达,在结直肠癌组织中高表达,且在转移癌中表达水平更高,其表达主要分布于胞浆和胞膜(图3B)。qPCR及Western blot结果也证实,CEL在SW620等结直肠癌细胞系中的表达水平和蛋白水平明显高于永生化的正常肠上皮细胞NCM460(P<0.01;P<0.001)(图3C)。
2.3 敲低CEL表达对结直肠癌细胞的生长和增殖的影响
为了进一步研究CEL在结直肠癌中的功能,选取CEL表达水平较高的SW620细胞作为模型,进行了后续的功能研究。利用脂质体转染方法,将特异性靶向CEL的siRNA转入CEL高表达的SW620细胞系,从而瞬时敲低CEL的表达。Western blot结果显示,SW620中CEL的表达被siRNA明显抑制,表明瞬时敲低成功(图4A)。随后,利用CCK-8和平板克隆形成实验分析敲低CEL对SW620生长和增殖的影响。结果显示,与对照组细胞比较,敲低CEL表达后,SW620的生长和增殖能力明显降低(P<0.05;P<0.01;P<0.001)(图4B-C)。
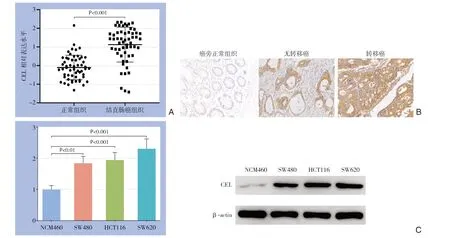
图3 CEL在结直肠癌组织和细胞中表达的检测结果 A:qPCR结果显示,CEL在结直肠癌中的表达显著高于正常组织;B:免疫组化结果显示,CEL在结直肠癌组织中的水平高于正常组织,且转移癌中的水平高于无转移癌(×200);C:qPCR和Western blot 结果显示,CEL在结直肠癌细胞系中的水平明显高于正常结肠上皮细胞Figure3 Results of determinations of CEL expression in colorectal cancer tissues and cells A:qPCR results showing that the expression of CEL in colorectal cancer is significantly higher than that in normal tissues;B:The results of immunohistochemistry showing that the level of CEL in colorectal cancer tissue is higher than that in normal tissue,and the level in metastatic cancer is higher than that in non-metastatic cancer;C:Results of qPCR and Western blot showing that the level of CEL in colorectal cancer cell lines is significantly higher than that in normal colonic epithelial cells
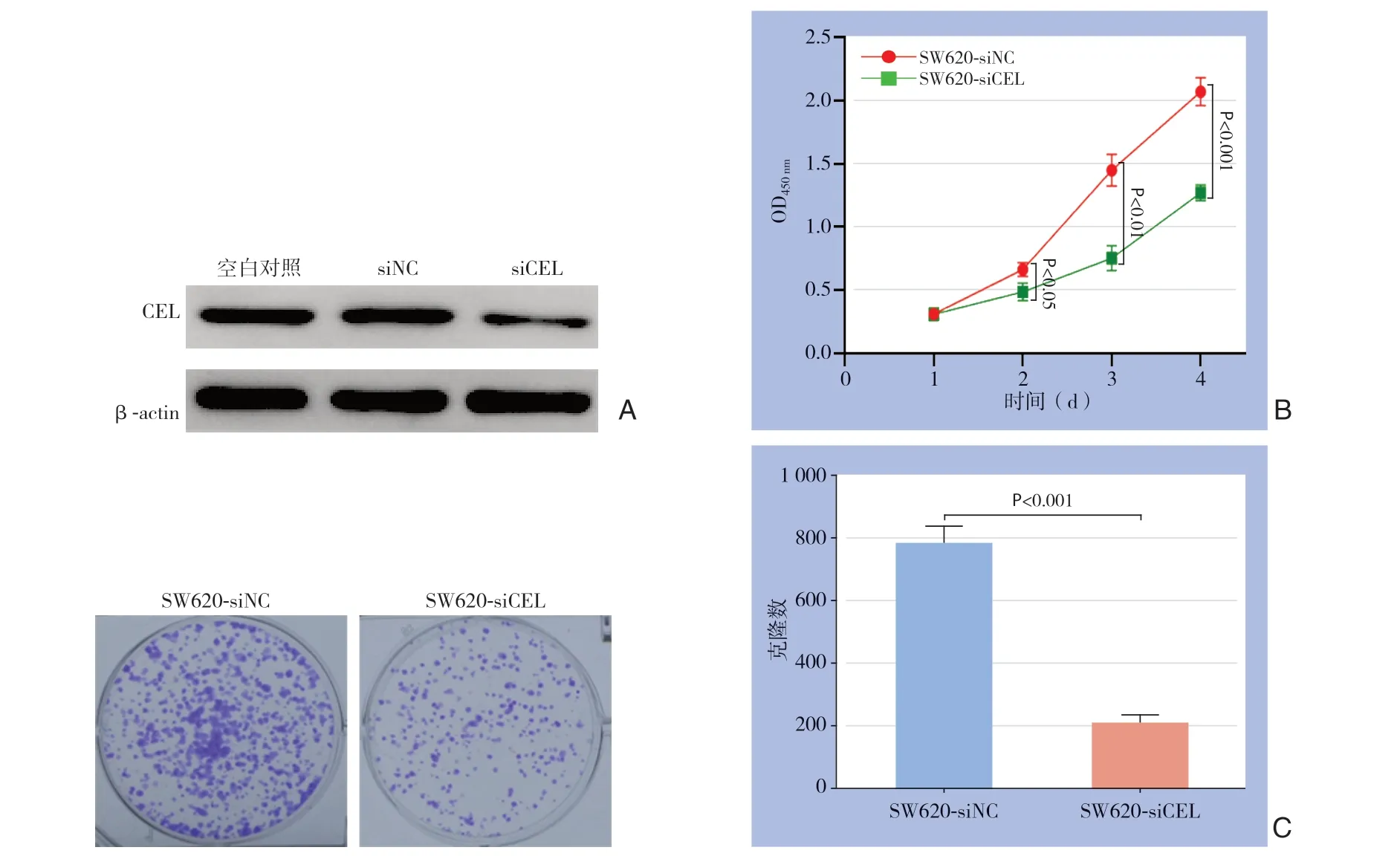
图4 CEL对结直肠癌细胞生长和增殖的作用 A:Western blot 显示,SW620 中CEL的表达被显著敲低;B:CCK-8 显示,敲低CEL表达,SW620的生长被明显抑制;C:克隆形成显示,敲低CEL表达,SW620的增殖被明显抑制Figure4 Effects of CEL on the growth and proliferation of colorectal cancer cells A:Western blot showing that the expression of CEL is significantly knocked down in SW620;B:CCK-8 assay showing that CEL knockdown significantly inhibits the growth of SW620 cells;C:Colony formation showing that CEL knockdown notably inhibits the proliferation of SW620 cells
2.4 敲低CEL表达对结直肠癌细胞迁移和侵袭的影响
免疫组化结果提示,CEL在转移的结直肠癌组织中表达更高,提示CEL与结直肠癌细胞的迁移和侵袭相关。因此,进一步分析CEL表达水平改变对SW620细胞迁移和侵袭能力的影响。Tranwell迁移和侵袭实验结果显示,敲低CEL表达后,SW620细胞的迁移和侵袭能力明显降低(P<0.001)(图5A-B)。
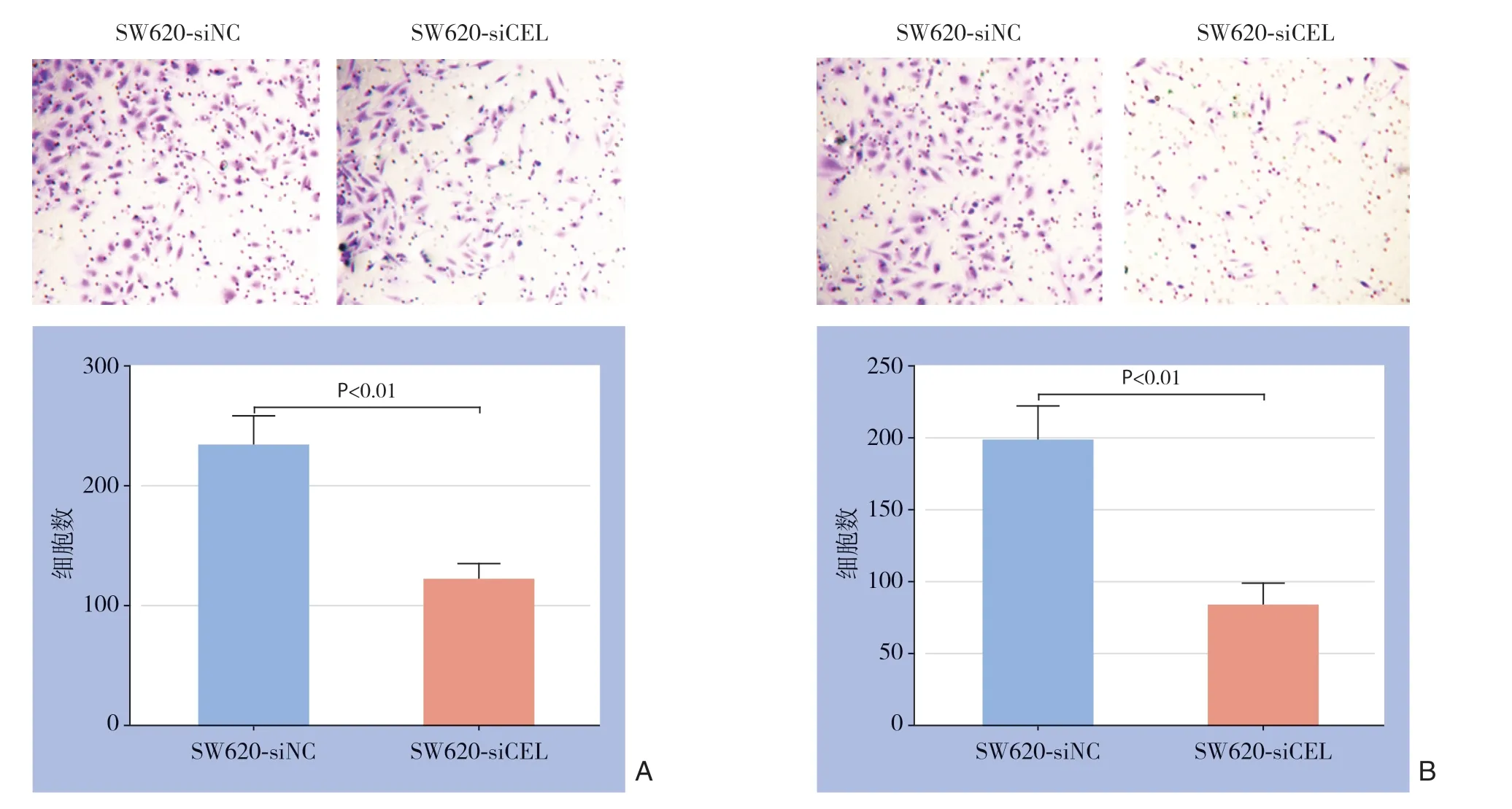
图5 CEL表达对结直肠癌细胞迁移和侵袭的作用 A:Transwell 迁移实验显示,敲低CEL表达,SW620的迁移能力被明显抑制;B:Transwell 侵袭实验显示,敲低CEL表达,SW620的侵袭能力被明显抑制Figure5 Effects of CEL on the migration and invasion of colorectal cancer cells A:Transwell migration experiment showing that CEL knockdown significantly inhibits the migration ability of SW620 cells;B:Transwell invasion experiment showing that CEL knockdown remarkably suppresses the invasion ability of SW620 cells
3 讨 论
尽管早期筛查及靶向及免疫治疗等手段的应用,提高了结直肠癌的早期诊断率和治疗水平,但其发病率和病死率仍位居前列,表明结直肠癌的发病机理仍有待进一步揭示。筛选和鉴定结直肠癌发生发展的关键分子,不仅可以揭示和完善发病机理,还可以为临床诊断和治疗提供候选靶点[23]。随着二代高通量测序技术的问世和生物信息学的发展,促进了包含各种组织、细胞及体液等多样本的高通量测序数据的公共数据库平台的飞速发展。尤其在肿瘤研究领域,基于TCGA,GEO及Oncomine等在线数据库数据分析和挖掘,成为肿瘤关键分子的筛选、鉴定和验证的重要工具。本研究基于TCGA及GTEx等数据库中的数据,利用GEPIA和UALCAN等在线分析工具筛选,发现CEL在结直肠癌中高表达,并在临床标本和细胞系中进一步验证这一结论,提示CEL可能在结直肠癌的发生发展中发挥了重要作用。
众多研究证实,CEL基因单点突变(缺失或插入)、VNTR长度多态性、拷贝数变异(copy number variants,CNVs)等遗传变异与青少年发病的成人型糖尿病、I型和II型糖尿病、慢性胰腺炎、酒精性胰腺炎、胰腺外分泌综合征及动脉粥样硬化等疾病的发生密切相关[8-10,12,14]。但是CEL在肿瘤中的表达和功能中的研究相对较少。Dalva等[11]分别分析了包含非酒精性慢性胰腺炎和胰腺癌的德国家系和一个包含462例胰腺癌和882例正常样本的队列中,CEL的CNVs和VNTR多态性与肿瘤的关系,结果显示,CEL CNVs和VNTR多态性在肿瘤组和对照组中差异无统计学意义。Shindo 等[24]的研究结果也显示,CEL-HYB(CEL的杂合性等位基因)的携带率在胰腺导管腺癌组和对照组差异无统计学意义。另外最近的研究证实,CEL在乳腺癌中高表达,CEL高表达患者的预后更差[16]。目前,还未见CEL遗传变异与结肠癌发生发展的报道,从TCGA等数据库获取的信息显示,CEL突变及CNVs在结直肠癌中的总占比在1%左右,且未发现与结直肠癌发生显著相关的热点。因此,基因突变等遗传变异在CEL肿瘤向的功能中作用较小。
癌基因的异常活化和抑癌基因的失活是肿瘤发生和进展的驱动因素,筛选和鉴定新的癌基因和抑癌基因是全面解析肿瘤发生机制的重要环节。EGFR、Ras、p53等肿瘤关键分子的发现,极大地促进肿瘤基础和临床的进步,但仍有众多问题等待解决,鉴定和解析更多肿瘤发生发展相关的关键基因的功能意义重大[25-27]。本研究经过在线数据库分析和本地样本验证,首次证实CEL在结直肠癌中高表达,提示CEL在结直肠癌中可能发挥了重要作用。DNA甲基化等表观遗传因素在基因表达调控中发挥了重要作用,启动子区低甲基化和高甲基化分别是癌基因高表达和抑癌基因失活的常见机制[28]。基于已有甲基化化测序数据,发现结直肠癌组织中CEL启动子区的甲基化转态显著低于正常黏膜组织,提示启动子低甲基化是CEL在结直肠癌中高表达的重要机制。
持续的增殖信号、逃避生长抑制、抵抗细胞死亡、诱导血管生成、组织和浸润转移、无限复制、能量代谢异常、基因组不稳定和突变、免疫逃逸及促瘤炎症等是肿瘤的十大基本特征[29]。从最终效应来看,十大特征的结果是肿瘤的快速增殖和侵袭转移[29-30]。因此,本研究进一步分析了CEL表达水平对结直肠癌生长和侵袭能力的影响。敲低CEL表达后,结直肠癌细胞的生长、增殖和侵袭能力显著降低,表明CEL高表达能促进结直肠癌细胞的生长和侵袭,但是其具体机制仍有待进一步揭示。从理论上分析,结直肠癌中CEL高表达和分泌,可促进肠道等微环境中脂类等物质的快速消化和吸收,为肿瘤的快速生长和侵袭提供物质和能量。
综上所述,本研究首次验证和揭示了CEL在结直肠癌中的表达和基本功能,表明CEL可能是结直肠癌发生和发展中重要的正调控因子,深入CEL在结直肠癌中作用、分子机制和临床意义有望为结直肠癌的诊断、治疗和预后判断提供新的靶标。

