高比表面积介孔网状氧化镁的制备、表征及对废水中Pb(Ⅱ)的吸附性能和机理
黄建翠 凌观爽 武艳妮 翟 俊 宗 俊
(华东师范大学化学与分子工程学院,上海 200241)
0 引 言
过去的几十年,由于城市化、工业化、农业实践等人类活动,大量废物被排放到环境和水资源中,造成了严重水污染。水的污染与水需求的增加正导致全球面临严重的缺水问题,再生废水则是重要解决方案之一[1]。而 Pb(Ⅱ)、Cd(Ⅱ)、Ni(Ⅱ)、Cr(Ⅲ)、As(Ⅲ)、Zn(Ⅱ)、Cu(Ⅱ)等重金属离子是水中非常有害的污染物,这些离子的高毒性、在环境中的持久性、不可生物降解性以及生物蓄积性已经对公共健康和生态系统构成了严重威胁[2-3]。因此,从水系统中有效去除重金属离子对废水重新利用、保护地球生态系统具有重要意义。迄今为止,已开发出多种重金属离子去除方法,例如化学沉淀[4]、混凝/絮凝[5]、吸附[6]、离子交换[7]、膜过滤[8]、电化学处理[9]、浮选[10]以及微生物系统处理[11]等。其中,吸附技术由于其简单稳定的处理过程、无二次污染、高效廉价的特点被广大研究人员推荐使用。据文献报道,各种吸附剂如活性炭[12]、金属氧化物[13]、磁铁矿[14]、壳聚糖[15]、沸石[16]等已用于从水溶液中去除镉和铅等重金属离子。但是,这些吸附剂的吸附能力和去除效率通常较低。因此,寻找去除重金属离子的高效吸附剂是当前重要的研究方向。
近年来,一些金属氧化物或金属氢氧化物因其低成本、绿色环保以及优异的吸附性能引起了人们的关注。其中,氧化镁(MgO)具有比表面积大、孔结构丰富、表面活性位点多、吸附能力强、适用范围广的特点,成为了处理水污染物最具前景的金属氧化物吸附剂之一[17]。例如,Cao等[18]以硝酸镁和尿素为原料,乙醇为溶剂,采用微波辅助溶剂热法制备了具有高比表面积的花状MgO,并显示出对Pb(Ⅱ)和Cd(Ⅱ)优异的去除效率,最大吸附量分别达到1 980和1 500 mg·g-1,他们还提出了来自MgO的Mg(Ⅱ)离子与Pb(Ⅱ)或Cd(Ⅱ)之间的阳离子交换的吸附机理。Xiong等[19]利用溶胶-凝胶法制备了MgO纳米颗粒,用于去除水溶液中的Cd(Ⅱ)和Pb(Ⅱ)(最大吸附量分别为2 294和2 614 mg·g-1),并且研究了2种离子的竞争吸附,结果表明吸附优先顺序为Pb(Ⅱ)>Cd(Ⅱ)。Feng等[20]制备了六角形介孔MgO纳米片,比表面积高达 182 m2·g-1,用于去除水溶液中的 Ni(Ⅱ),最大吸附容量为1 684.25 mg·g-1。在此基础上,研究更高吸附性能、更低制备成本和难度的氧化镁吸附剂具有重大的研究价值和经济意义。基于此,本文报道了以丰富的天然水菱镁矿为原料制备介孔网状氧化镁的方法。通常,介孔网状结构具有丰富的孔结构、高的比表面积,能提供大量的表面活性位点,是一种具备良好吸附特征的优异结构。因此,为了验证该特殊结构的氧化镁是否具有优异的吸附性能,我们以Pb(Ⅱ)为例,系统性研究了氧化镁用量、吸附时间、吸附温度及pH对氧化镁吸附模拟废水中铅离子吸附性能的影响及吸附机理,并考察了氧化镁吸附剂对溶液中多组分离子的吸附效果。
1 实验部分
1.1 实验原料
天然水菱镁矿(Mg(OH)2·4MgCO3·4H2O)源自西藏班戈湖。Pb(NO3)2、HNO3、NaOH和无水乙醇(分析纯)购自国药集团化学试剂有限公司(上海)。去离子水为实验室自制。将 24 种离子(Al、As、B、Ba、Be、Bi、Ca、Cd、Co、Cr、Cu、Fe、K、Li、Mg、Mn、Na、Ni、P、Pb、Se、Sr、V、Zn)配制成 1 000 mg·L-1的混标溶液备用。所有试剂无须进一步纯化即可使用。
1.2 高比表面积介孔网状氧化镁吸附材料的制备
将适量水菱镁矿石放入坩埚中,一同放入马弗炉中煅烧。设置参数为:煅烧温度650℃,煅烧时间30 min,升温速率10℃·min-1。冷却到室温后,将其研磨成粉末并使用200目筛子过筛,得到氧化镁。将去离子水加入到三孔烧瓶中并加热至80℃,称取一定量制备的氧化镁,在剧烈搅拌下缓慢加入到水中,保持固液比(质量比)为1∶30,水浴回流反应2 h。反应结束后,悬浊液陈化30 min,抽滤、洗涤。将滤饼放置在150℃鼓风干燥箱中烘干3 h,研磨得氢氧化镁白色粉末。随后将该氢氧化镁粉末在650℃下(升温速率10℃·min-1)再次煅烧1 h,得到氧化镁吸附剂粉末。
1.3 氧化镁对Pb(Ⅱ)的吸附实验
单离子模拟水样中以Pb(NO3)2为重金属离子源,配制不同浓度铅离子溶液,pH=6;混合离子模拟水样以混标溶液为混合离子源,将其稀释到各离子的浓度为40 mg·L-1,pH=2。使用NaOH(0.1 mol·L-1)和HNO3(0.1 mol·L-1)调节储备溶液的pH。
移取某浓度Pb(Ⅱ)或混合离子模拟水样20 mL于100 mL烧杯中,加入一定量的上述制备的氧化镁吸附剂,在设定温度下的磁力搅拌器中搅拌反应一段时间。反应结束后,过滤分离,取滤后清液,检测铅离子浓度及出水pH值,滤液调至pH<9后排放。所得沉淀在50℃下干燥,用X射线衍射仪分析物相的变化。
离子去除率(R)计算公式(1)为:R=(c0-ce)/c0×100%,吸附平衡量(qe)计算公式(2)为:qe=(c0-ce)V/m,式中c0为Pb(Ⅱ)的初始浓度(mg·L-1),ce为Pb(Ⅱ)的平衡浓度(mg·L-1),V为溶液体积(L),m为吸附剂的质量(g)。
1.4 表征及测试方法
用X射线粉末衍射仪(日本,Rigaku公司)进行物相分析,参数设置:CuKα辐射,λ=0.154 18 nm,镍滤光片,25 mA,35 kV,扫速30(°)·min-1,扫描范围10°~90°。用差热热重分析仪(TGA/SDTA851e)(瑞士,梅特勒-托利多仪器公司)分析水菱镁矿的热分解过程,参数设置:温度范围:室温~800℃,升温速率10 ℃·min-1,N2气氛。用Quanta FEG 250场发射扫描电子显微镜(美国,FEI公司)观察产物形貌和结构,测定前进行喷金处理。用气体吸附分析仪测定样品的N2吸附-脱附等温线以求得比表面积、孔体积及孔径分布(型号:Autosorb-IQ);用电感耦合等离子体原子发射光谱仪(美国,型号:icap7200 Radial)测定吸附后残留在溶液中的铅离子及其他离子浓度。
2 结果与讨论
2.1 水菱镁矿原料分析
天然水菱镁矿的XRD图如图1a所示,主要矿物组成是水菱镁矿(Mg(OH)2·4MgCO3·4H2O)和文石(CaCO3)。样品经化学分析,测得氧化镁质量分数为41.59%,氧化钙质量分数为1.30%,其他杂质含量较少。
水菱镁矿(Mg(OH)2·4MgCO3·4H2O)在 800 ℃氮气气氛中热分解,得到如图1b所示的TG-DTG曲线。TG曲线表明,样品的初始分解温度在150℃左右,分解完全的温度在680℃附近。根据TG曲线的质量损失台阶可将样品分解的质量损失过程分为4个区间:150~350 ℃、350~480 ℃、480~560 ℃、560~680℃。由DTG曲线可以看出,各阶段的质量损失速率不同,4个温度区间的质量损失分别为13.33%、29.28%、8.28%和3.51%,总的分解率为54.40%。其中每个区间可能发生的吸热反应[21]如下:

总吸热反应分解的方程式为(7),因此,采用650℃煅烧基本可以完全分解水菱镁矿。
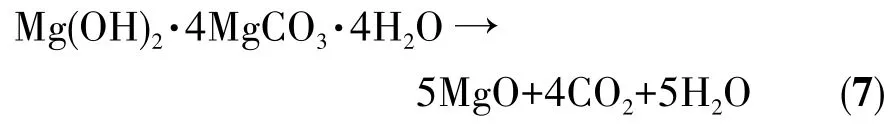
2.2 高比表面积氧化镁的分析与表征

图3 高比表面积介孔网状氧化镁的制备路线图Fig.3 Preparation diagram of mesoporous reticular MgO with high specific surface area
以水菱镁矿为原料,在“煅烧-水化-煅烧”路线下制备氧化镁的XRD图和SEM图分别如图2a、图3所示。煅烧产物的衍射峰主要位于2θ=36.76°、42.84°、62.12°、74.64°、78.14°,与 MgO(PDF No.89-4248)的峰完全符合,说明煅烧产物为MgO。水化产物的衍射峰主要位于 2θ=18.58°、32.84°、37.96°、50.88°、58.70°、62.14°、68.10°、72.16°,与 Mg(OH)2(PDF No.44-1482)的峰完全吻合,说明水化产物是Mg(OH)2。从前后2次煅烧的XRD对比中可以看出,第一次煅烧后产物峰形尖锐,有杂质峰,第二次煅烧后产物杂质峰消失,且峰形有所宽化。此外,根据所有峰的半峰宽(FWHM),使用Debye-Scherrer[22]方程确定了第一次煅烧和第二次煅烧的平均粒径分别为18.41和13.47 nm,证明第二次煅烧MgO纯度更高且具有更小的晶粒尺寸。从图3中可以看出,第一次煅烧的氧化镁无特定形貌,第二次煅烧的氧化镁呈现类似花状片层“网”状结构,具有多孔性。对氧化镁的N2吸附-脱附等温线和孔径分布如图2b所示。样品表现出具有H3磁滞回线的Ⅳ型等温线,这主要见于层状结构的聚集体产生狭缝的介孔或大孔材料,表明了材料的介孔性质[23]。通过BJH(Barrette-Joyner-Halendg)模型计算孔径分布,得到平均孔径为12.33 nm,进一步证明了材料是介孔结构,这与SEM图所看到的氧化镁形貌一致。BET(Brunaure-Emmett-Teller)计算结果表明,该氧化镁的比表面积为 188 m2·g-1,孔体积为 0.85 cm3·g-1,这种多孔结构提供了大量的表面活性位点,这在水处理中将会非常有利。
2.3 各因素对氧化镁吸附Pb(Ⅱ)效果的影响
2.3.1 氧化镁用量对Pb(Ⅱ)去除效率的影响
吸附剂用量影响重金属离子的吸附效果,吸附剂过少会因其吸附活性位不足导致重金属离子吸附效果不佳;而吸附剂过多会提高处理成本,甚至会污染水质。为了确定最佳的氧化镁吸附剂用量,移取100 mg·L-1、pH=6的Pb(Ⅱ)水样20 mL于100 mL烧杯中,加入不同量(0.005~0.3 g·L-1)的氧化镁吸附剂,在室温下进行吸附实验。图4给出了氧化镁用量与Pb(Ⅱ)的去除效率的关系,表1是具体数据。可以看出,将氧化镁用量从0.005 g·L-1增加到0.05 g·L-1,Pb(Ⅱ)的去除效率从46.63%突跃到99.86%;将用量从 0.05 g·L-1增加到 0.3 g·L-1,未观察到效率的特别提高。因此,可以认为0.05 g·L-1是进一步实验的最佳吸附剂用量。
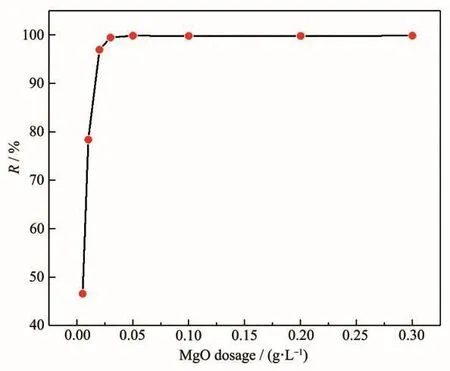
图4 氧化镁用量对其Pb(Ⅱ)去除效率的影响Fig.4 Effect of MgO dosage on Pb(Ⅱ)removal efficiency of MgO
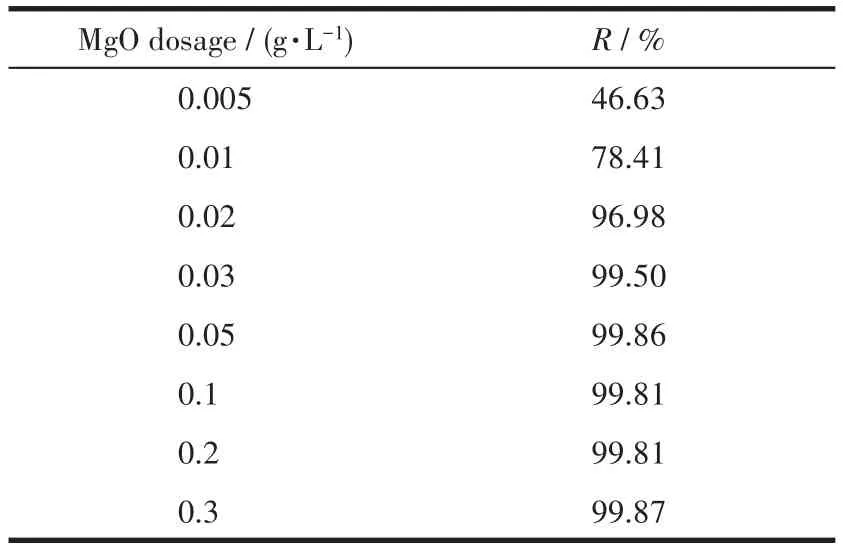
表1 氧化镁用量与其对应的Pb(Ⅱ)去除效率Table 1 MgO dosage and relative Pb(Ⅱ)removal efficiency of MgO
2.3.2 吸附时间对Pb(Ⅱ)去除效率的影响
移取一系列 100 mg·L-1、pH=6 的 Pb(Ⅱ)水样 20 mL于100 mL烧杯中,加入0.05 g·L-1吸附剂,在室温下进行吸附实验,每隔一定时间测定铅离子浓度。吸附时间与Pb(Ⅱ)去除效率的关系如图5所示,具体数值见表2,可以看到,MgO吸附Pb(Ⅱ)的过程非常快,在开始的前1 min内去除效率迅速达到96.94%,接触45 min左右达到平衡,此时去除效率达99.84%。如此快的吸附速率可归因于MgO表面上存在大量的活性位点。因此,考虑到去除效率和时间成本,设定进一步实验的吸附时间为45 min。
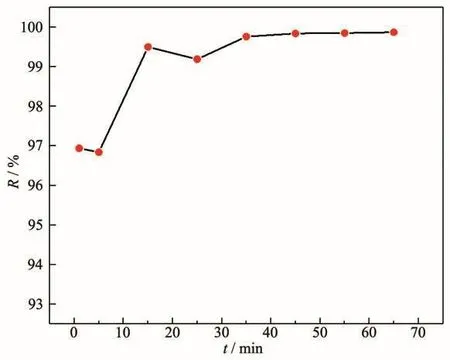
图5 吸附时间对MgO的Pb(Ⅱ)去除效率的影响Fig.5 Effect of adsorption time on Pb(Ⅱ)removal efficiency of MgO
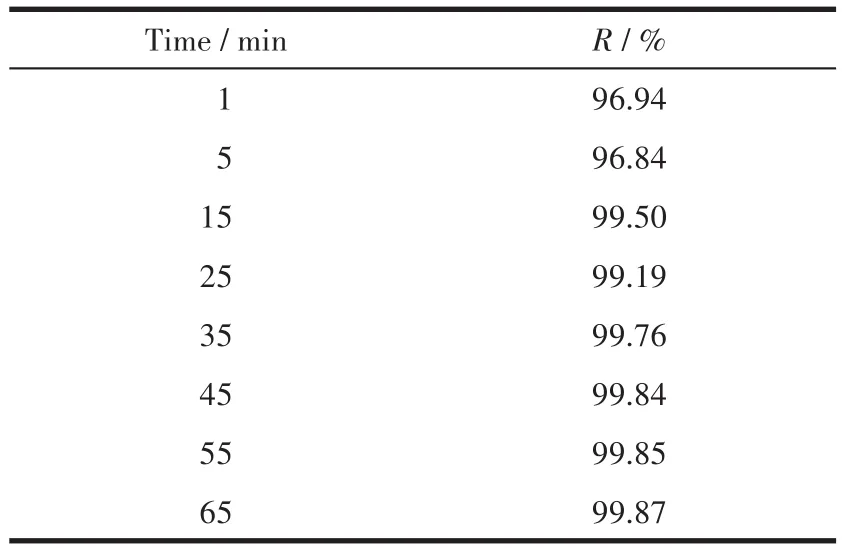
表2 吸附时间与对应的MgO的Pb(Ⅱ)去除效率Table 2 Adsorption time and relative Pb(Ⅱ)removal efficiency of MgO
2.3.3 吸附温度对Pb(Ⅱ)去除效率的影响
移取一系列 100 mg·L-1、pH=6 的 Pb(Ⅱ)水样 20 mL于100 mL烧杯中,加入0.05 g·L-1吸附剂,在不同温度下进行吸附实验。吸附温度与Pb(Ⅱ)去除效率的关系如图6所示,可以看出,整体而言,温度对去除率的影响不大,该吸附剂在室温下就表现出了优异的吸附效率,因此,选择在室温下进行进一步的实验。
2.3.4 废水溶液pH对Pb(Ⅱ)去除效率的影响
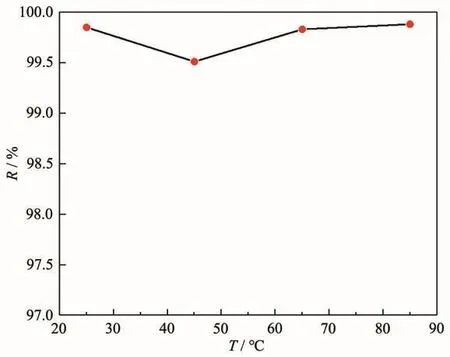
图6 吸附温度对MgO的Pb(Ⅱ)去除效率的影响Fig.6 Effect of adsorption temperature on Pb(Ⅱ)removal efficiency of MgO
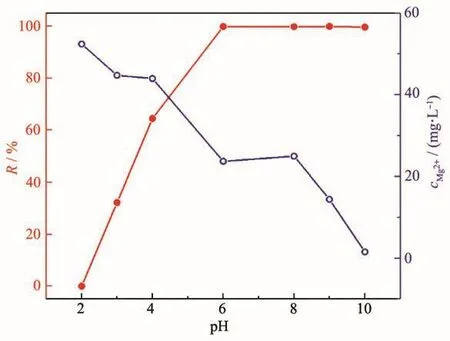
图7 pH与MgO的Pb(Ⅱ)去除效率及溶液中Mg2+浓度的关系图Fig.7 Relationship between pH and Pb(Ⅱ)removal efficiency of MgO and Mg2+concentration in solution
废水有酸性、碱性,因此溶液的pH值是吸附过程中最重要的因素之一。移取一系列100 mg·L-1、不同pH的Pb(Ⅱ)水样20 mL于100 mL烧杯中,加入0.05 g·L-1吸附剂,在室温下进行吸附实验。图7显示了不同初始溶液pH值对Pb(Ⅱ)去除效率的影响及溶液中Mg2+浓度的变化,发现随pH的增加,去除效率迅速提高,这是因为在较低pH值下,MgO表面将完全被溶液中的H+覆盖,这消耗掉大部分吸附剂,进而导致吸附能力下降;但随着pH的增加,来自H+的竞争减小,带正电的Pb2+被吸附到吸附剂带负电的位置[24]。在pH≥6的条件下,Pb(Ⅱ)去除效率几乎达到100%,除了一部分吸附作用,还因为过量的OH-与 Pb2+、Mg2+结合分别生成了 Pb(OH)2、Mg(OH)2沉淀,Mg2+浓度的下降可以充分说明这一点。pH≤8的条件下,Pb2+占主导地位;pH>8的条件下,Pb(OH)2的形成对吸附有较大影响[25]。表3显示了溶液被吸附前后的pH值,表明吸附后溶液pH有所增加。但在pH>9的情况下,Mg2+浓度会很低,会严重影响Mg(OH)2与Mg2+的缓冲作用,进而使得出水pH>9。因此,适宜的pH值为6~8。另外,在酸性废水中,可以通过增加氧化镁用量来调节pH,改善吸附性能。
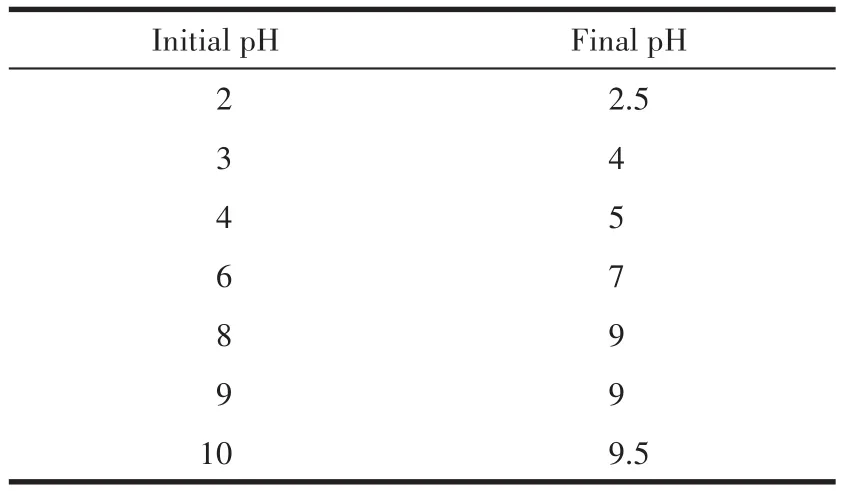
表3 初始溶液pH与MgO吸附Pb(Ⅱ)后溶液pH的变化Table 3 Changes of initial solution pH and solution pH after adsorption of Pb(Ⅱ)on MgO
2.4 吸附动力学
为了更好地研究吸附速率控制步骤并描述在吸附剂上的吸附行为,根据Lagergren的伪一级动力学(8)、伪二级动力学模型(9)分析了吸附动力学数据。伪一级动力学模型主要用于描述物理吸附过程,伪二级动力学模型主要用于描述化学吸附过程,它们的线性方程式[26-27]分别如下:

其中,qe是平衡吸附容量(mg·g-1),qt是时间t(min)时的吸附容量(mg·g-1),k1(min-1)和k2(g·mg-1·min-1)分别是伪一级模型和伪二级模型的吸附速率常数。氧化镁对于Pb(Ⅱ)吸附过程的伪一、二级动力学拟合如图8a和8b所示,2种模型的拟合参数如表4所示。通过对比可以看出,伪二级动力学模型对其吸附过程的拟合程度(R2=0.999 9)远高于伪一级动力学(R2=0.915 4),且伪二级动力学计算的qe,cal与实验值(qe,exp)相当。因此可以得出结论,氧化镁对Pb(Ⅱ)的吸附过程符合伪二级动力学模型,表明MgO比表面积高,内扩散阻力小,化学反应是限速步骤[26,28],可以说,最可能的机理是涉及吸附剂与被吸附物电子交换的化学吸附[29]。
2.5 吸附等温线

图8 氧化镁吸附Pb(Ⅱ)的Lagergren伪一级(a)和伪二级(b)动力学模型拟合曲线Fig.8 Fitting curves of first-order(a)and second-order(b)Lagergren models for adsorption of Pb(Ⅱ)on MgO

表4 氧化镁吸附Pb(Ⅱ)的伪一级和伪二级动力学方程拟合参数Table 4 Fitting parameters of pseudo-first-order and pseudo-second-order kinetic equations for adsorption of Pb(Ⅱ)on MgO
为了研究在某温度下吸附剂在吸附过程中能达到的最大吸收程度,常用吸附等温线表示平衡吸附量和浓度的关系。分别移取Pb2+浓度为100、200、300、400、600、700、900 mg·L-1的模拟废水溶液 20 mL放入烧杯中,加入等体积的0.05 g·L-1的氧化镁吸附剂,在室温下进行吸附实验。图9为得到的吸附等温线,结果表明,Pb(Ⅱ)的吸附量随着金属离子浓度的增加而逐渐增加,直到出现最大吸收为止。
我们选用常用的Langmuir(10)和Freundlich(11)等温线模型用于解释吸附平衡,Langmuir模型提出了单层吸附,而Freundlich模型提出了多层吸附[30]。它们的线性方程如下:

其中,qe是平衡吸附量(mg·g-1),ce为溶液平衡浓度(mg·L-1),qm为吸附剂的最大吸附量(mg·g-1),b为吸附平衡常数(L·mg-1);Kf是和吸附容量有关的常数(mg1-1/n·L1/n·g-1),n是与吸附强度有关的经验参数。
图10a和10b是根据热力学方程Langmuir模型和Freundlich模型拟合得到的,表5为其拟合参数。对比图表可知,Langmuir模型的相关度R2=0.998 5远大于Freundlich模型的相关度R2=0.797 9。因此,该氧化镁对Pb2+的吸附过程更符合Langmuir模型,该等温线表明吸附为单分子层吸附,其结合位点对吸附具有相同的亲和力,吸附在表面均匀进行,这可能是由于MgO纳米颗粒与重金属离子之间的化学相互作用[19]。由Langmuir模型计算出来的饱和吸附容量为7 431.5 mg·g-1,这远远高于文献所报道的结果(表6)。上述结果表明,制备的介孔网状MgO可用作去除Pb(Ⅱ)离子的快速有效的吸附剂。
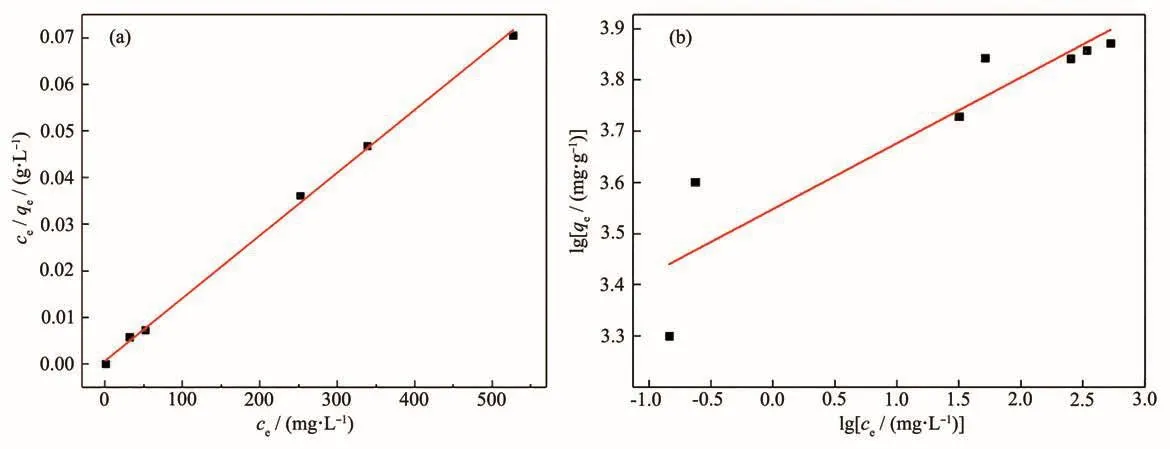
图10 氧化镁吸附Pb(Ⅱ)的Langmuir方程(a)和Freundlich方程(b)拟合曲线图Fig.10 Fitting curves of Langmuir(a)and Freundlich(b)isotherm models for adsorption of Pb(Ⅱ)on MgO
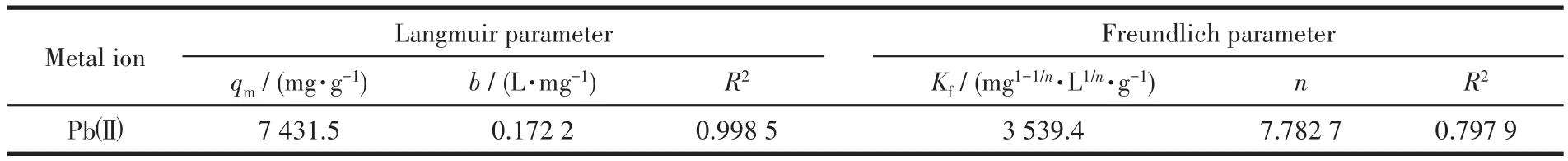
表5 氧化镁吸附Pb(Ⅱ)的Langmuir和Freundlich等温吸附模型拟合参数Table 5 Fitting parameters of Langmuir and Freundlich adsorption models for adsorption of Pb(Ⅱ)on MgO
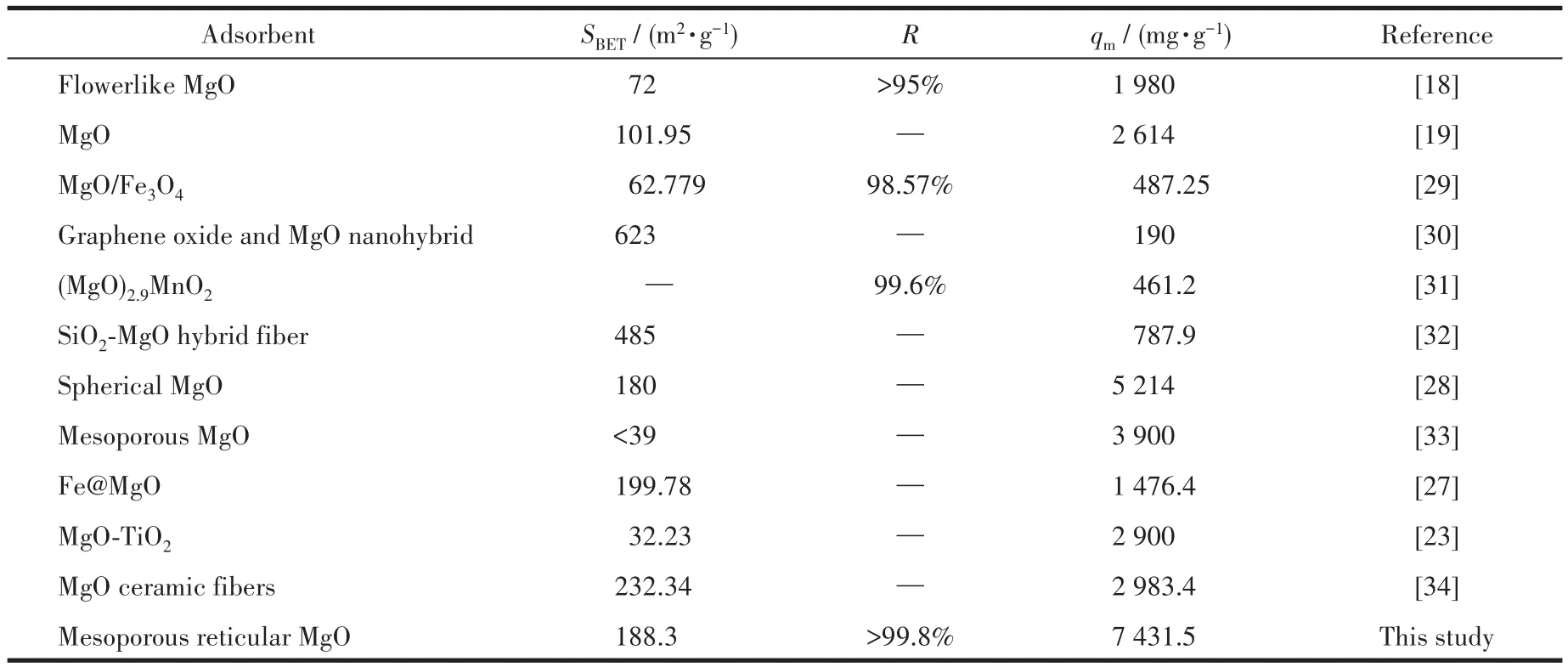
表6 各种氧化镁吸附剂对Pb(Ⅱ)吸附性能的比较Table 6 Comparison of Pb(Ⅱ)adsorption performance of various MgO adsorbents
2.6 氧化镁吸附铅离子的吸附机理
吸附动力学及吸附等温线的分析表明,吸附机理可能是由于MgO纳米颗粒与重金属离子之间的化学相互作用。为了进一步研究MgO对Pb(Ⅱ)的去除机理,对每次氧化镁吸附不同浓度Pb(Ⅱ)离子后溶液中的Mg2+浓度进行了检测,分析了吸附量与溶液中Mg2+浓度的关系,如图11a所示。观察发现溶液中Mg2+浓度随吸附容量的增加而增加(Mg2+浓度值远远小于世界卫生组织规定的450 mg·L-1,因此使用该氧化镁吸附剂是安全的[18])。Mg2+是MgO晶格的一部分,这可能是因为Pb2+取代了Mg2+的位置。图11b显示了吸附Pb(Ⅱ)离子之后吸附剂的XRD图,从衍射峰的位置可以判断出产物中主要为Pb3(CO3)2(OH)2(PDF No.01-0687)、PbO(PDF No.72-0094)、Mg(OH)2和MgO。Mg(OH)2是MgO水合产生,生成的Mg(OH)2在MgO表面部分解离形成OH-。因此,溶液中的Pb(Ⅱ)可以与OH-结合形成Pb(OH)2,由于Pb(OH)2不稳定,它可以与溶解的CO2反应形成Pb3(CO3)2(OH)2。PbO的存在可以归因于Mg2+与Pb2+的阳离子交换,这实际上是一种固液界面反应,O2-可以与金属离子结合形成金属氧化物。吸附过程中发生的化学反应[19,28]如下:
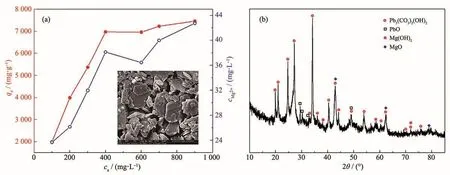
图11 (a)吸附量与溶液中Mg2+浓度的关系图与吸附Pb(Ⅱ)后MgO粉末的SEM图(插图);(b)吸附Pb(Ⅱ)后MgO粉末的XRD图Fig.11 (a)Relationship between adsorption amount and Mg2+concentration in solution and SEM image of MgO powder after Pb(Ⅱ)adsorption(inset);(b)XRD pattern of MgO powder after Pb(Ⅱ)adsorption
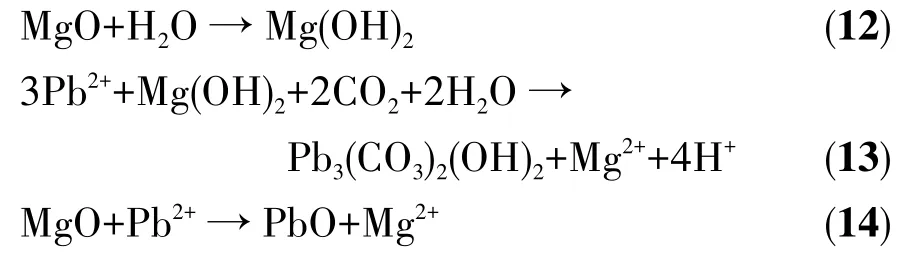
吸附Pb(Ⅱ)后的产物的SEM图像如图11a中插图所示,产物形貌呈大块板状结构。显然,吸附了Pb(Ⅱ)的产物粒径大于吸附前样品粒径,且多孔结构消失,这可归因于重金属离子的吸附。
因此,通过MgO吸附水中的Pb(Ⅱ)的机理可被认为是羟基官能团以及Mg(Ⅱ)与MgO表面重金属离子之间的离子交换所致。MgO对水中的Pb(Ⅱ)的吸附是化学吸附,吸附后形成了新物质,从而导致MgO形态发生变化,因此,难以再生。
2.7 氧化镁吸附剂对其他离子的吸附
为了研究实验制备的氧化镁对其他有害离子是否具有良好的吸附性能,利用多离子混标溶液(pH=2)进行了多组分吸附实验。吸附剂用量与吸附后pH的变化如图12所示,可以看出,随着吸附剂的增加,溶液的pH随之增加,H+竞争能力减弱,这有利于吸附剂发挥良好的吸附性能。从图13中可以看出,适量的吸附剂对Cd、Cr、Ni、As、Co、P、Se、Be、Bi、Cu、Fe、Mn、V、Zn、Al均具有优异的吸附性能,去除率均能达到99%以上。因此,该高比表面积介孔网状氧化镁具有去除多种有害离子的优异的吸附性能,是优秀的水处理剂,具有较高的应用价值。
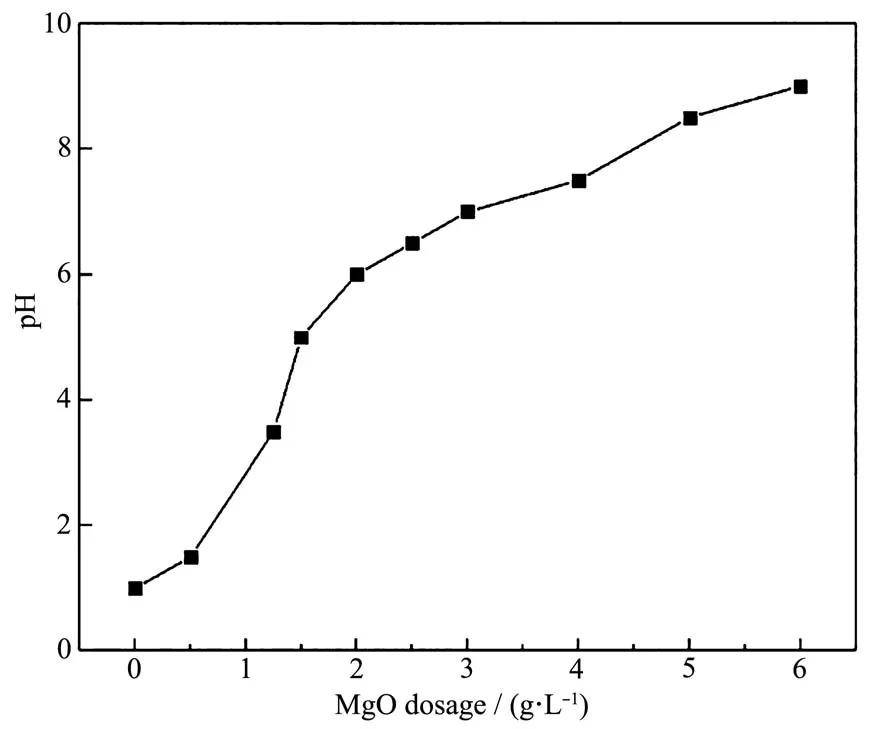
图12 吸附剂用量与氧化镁吸附其它离子后pH的关系Fig.12 Relationship between adsorbent dosage and pH after for adsorption of other ions on MgO
图13 氧化镁吸附剂对其他离子的吸附Fig.13 Adsorption of other ions on MgO
3 结 论
综上所述,以天然存在、资源丰富的水菱镁矿为原料,通过简单的“煅烧-水化-煅烧”法制备出具有 188 m2·g-1的高比表面积、0.85 cm3·g-1的高孔体积以及平均孔径为12.33 nm的介孔网状MgO,且实验过程中无须加入任何试剂。该产物显示出优异的水处理性能,实验探究了各因素对吸附性能的影响,优化的最佳实验条件:吸附剂用量为0.05 g·L-1,吸附时间为45 min,溶液pH=6~8,吸附温度为室温。在该条件下铅离子的去除率可达到99.8%以上。该氧化镁吸附剂的吸附动力学和等温线数据与伪二级模型和Langmuir模型高度吻合,表明重金属离子在该氧化镁吸附剂上为单层化学吸附,其最大吸附量为7 431.5 mg·g-1,该数值远远高于其他报道的基于MgO吸附剂的数值。我们提出了涉及羟基官能团以及Mg(Ⅱ)与MgO表面重金属离子之间的离子交换的吸附机理。另外,该氧化镁可同时吸附多种离子,对Cd、Cr、Ni、As、Co、P、Se、Be、Bi、Cu、Fe、Mn、V、Zn、Al离子均具有优异的吸附性能。以上结果表明,该MgO吸附剂具有高效、易制备、易推广的优点,对环境无害,有望成为在废水中快速去除重金属离子的优秀吸附剂。

