黄芪总黄酮通过抗炎抗氧化作用减轻大鼠肝纤维化的实验研究*
谌卫龙,李卫明,张守华,雷俊,涂小飞,曾俊权
(江西省儿童医院,1.普外科;2.检验科,南昌330006;3.井冈山大学医学部,吉安343009)
黄芪为补虚良药,广泛地应用于临床[1],但同时由于中药药物成分复杂, 在临床应用中引起一些问题,比如对肾功能损害、过敏发应等。 因此,利用现代中药药物提纯技术寻找出并利用现代实验技术验证中药的有效成分是改善中药不良反应的主要方法。黄芪总黄酮(TFA)是从中药黄芪中分离的主要活性成分,在多种方剂中均有应用,既往文献报道其具有抗氧化、保肝、抗细胞凋亡、抗肿瘤、免疫调节和抗病毒等多种生物学作用[2-4]。 也有报道黄芪能改善红细胞变形能力, 降低纤维蛋白原及全血比黏度,抑制血小板黏附[5,6]。 本实验进一步验证黄芪总黄酮改善肝纤维化的效果及机制。 据此,本实验通过构建大鼠肝纤维化模型,初步探讨黄芪的主要有效成分黄芪总黄酮 (total flavonoids of astragalus,TFA) 对改善肝纤维化效果和机制的研究。
1 材料与方法
1.1 材料
1.1.1 动物 32 只SPF 级SD 大鼠, 重量180-220g,由南昌大学动物实验中心提供,所有动物普通饮食,自由饮水。
1.1.2 试剂仪器黄芪总黄酮购于南京春秋生物工程有限公司;四氯化碳购于上海试剂三厂;RNA 提取试剂盒、RIPA 裂解液、BCA 蛋白浓度测定试剂盒购自碧云天生物技术有限公司;RNA 逆转录、荧光定量PCR 试剂盒购自全式金生物有限公司;丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽(GSH) 测试盒购自南京建成生物工程研究所;NF-κB、TNF-α、FXR 多克隆一抗和多克隆二抗购自Abcam 公司; 引物由上海生工生物工程公司合成。
1.2 方法
1.2.1 造模、分组及给药 大鼠随机分为4 组:正常组(Normal)、模型组(Model)、TFA 高剂量 组、TFA低剂量组,每组8 只。用CCl4诱导大鼠形成肝纤维化模型。 除正常组,其余三组给予40% CCL4橄榄油混合液皮下注射,每周2 次,共8 周。 第5 周开始,TFA 低剂量组和TFA 高剂量组给15mg/kg 和30mg/kg 的TFA 灌胃,1 次/日,治疗4 周,模型组予等量的生理盐水灌胃。
1.2.2 标本采集8 周后,采腹腔静脉血,分离血清,用于AST、ALT、ALB 等肝功能检测;取部分肝叶用4% 甲醛溶液固定做常规组织病理学观察,另一部分用于做Western blot、定量PCR、MDA、SOD、GSH等检测。
1.2.3 肝功能等指标检测 应用全自动生化仪器检测血清AST、ALT、ALB 等含量。 各组肝组织匀浆,根据试剂盒说明书检测MDA、SOD、GSH 等氧化水平。
1.2.4 Realtime PCR 法检测肝组织中相关炎症因子的表达 根据试剂盒提取肝组织总RNA, 逆转录合成cDNA,以cDNA 为模板,按照说明书进行扩增,检测NF-κB、TNF-α、FXR 的mRNA,以βactin 作为内参。 引物序列如下:β-actin 上游:5’-TTCAACACCCCAGCCATGT -3’, 下 游 :5’ -GCATACAGGGACAACACAGCC-3’;NF-κB 上 游5’-TCTGTTTCCCCTCATCTTTCCC-3’, 下游5’-GTCTTAGTGGTTCTGTGCTTCTC-3’;TNF-α 上 游5’-CGCTCTTCTGTCTACTGAACTTC-3’,下游5’-CTGCTTGGTGGTTTGCTACG-3’;FXR 上 游5’-TGGACTCATACAGCAAAC AGAGA-3’, 下游5’-GTCTGAAACCCTGGAAGTCTTTT-3’
1.2.5 Western blot 分析 取各组肝组织用RIPA 裂解液提取总蛋白,BCA 法检测蛋白浓度。 蛋白样品经凝胶电泳分离, 电转至PVDF 膜,5%BSA 封闭,加入TNF-α (1:1000)、FXR (1:1000)、NF-κB(1:2000)多克隆一抗及β-actin(1:2000)一抗,4℃孵育过夜。Quantity One 4.0 软件进行条带灰度分析。β-actin 作为内参。
1.3 统计学数据分析 采用SPSS 23.0 软件进行数据结果分析。 数据采用(±s)表示,组间或组内采用ANOVA-One 分析, 方差不齐时采用Tamhane’T2分析。
2 结果
2.1 TFA 对大鼠肝纤维化模型肝功能的影响 与正常组比较, 皮下注射CCl48 周能造成明显的肝纤维化及肝损伤, 模型组与正常组相比AST、ALT明显升高,ALB 下降(P<0.05);TFA 可以明显减轻CCL4引起的肝功能异常(P<0.05),较模型组相比AST、ALT 降低(P<0.05),ALB 升高(P<0.05),并且TFA 高剂量组较低剂量组有更好的护肝降酶作用(表1)。
表1 TFA 对大鼠肝纤维化模型肝功能的影响(±s)
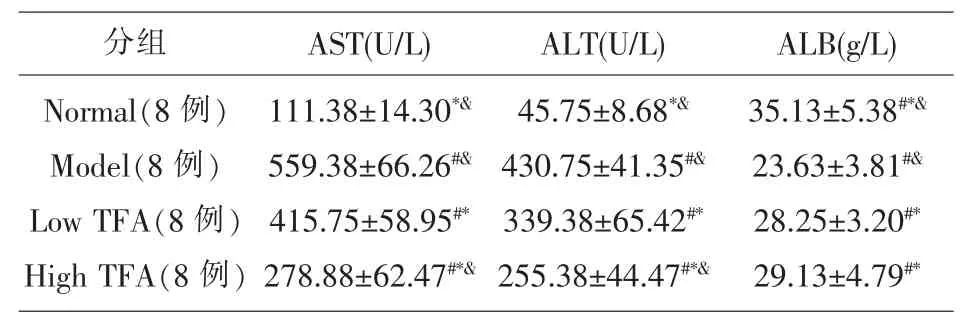
表1 TFA 对大鼠肝纤维化模型肝功能的影响(±s)
#P<0.05 vs Normal, *P<0.05 vs Model,& P<0.05 vs Low TFA
分组 AST(U/L) ALT(U/L) ALB(g/L)Normal(8 例)Model(8 例)Low TFA(8 例)High TFA(8 例)35.13±5.38#*&23.63±3.81#&28.25±3.20#*29.13±4.79#*111.38±14.30*&559.38±66.26#&415.75±58.95#*278.88±62.47#*&45.75±8.68*&430.75±41.35#&339.38±65.42#*255.38±44.47#*&
2.2 TFA 对大鼠肝纤维化模型肝脏病理改变及胶原纤维的影响 HE 染色可见正常组大鼠肝细胞大小正常,形态规则,肝索围绕中央静脉呈放射状排列,肝小叶结构完整(Fig1 A),模型组大鼠肝组织HE 染色可见肝细胞坏死、脂肪变性,大量炎症细胞浸润,肝索排列紊乱,肝组织汇管区间、汇管区与中央静脉间大量纤维组织形成并可见假小叶形成(Fig1B)。 经TFA 治疗4 周后,低剂量组仍可见肝纤维化(箭头所示纤维化改变),肝小叶结构较完整, 可见明显的细胞脂肪变以及炎性细胞浸润(Fig1C),高剂量组显示肝纤维化程度减轻,少量的细胞脂肪变以及炎性细胞浸润(Fig1D)。
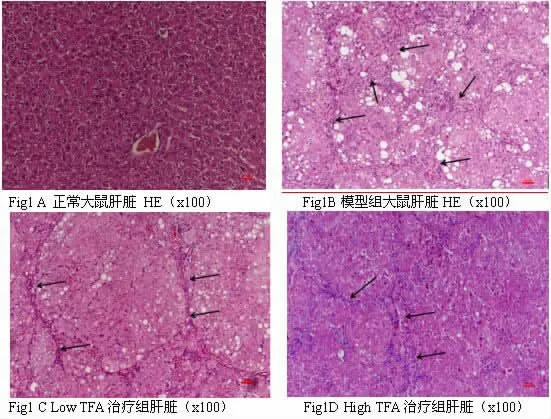
图1 小鼠肝脏HE 染色图
2.3 TFA 对大鼠肝纤维化模型肝脏相关炎症因子及FXR mRNA 表达的影响 与正常组相比, 模型组NFκB、TNF-α mRNA 水平明显升高 (P<0.05),FXR mRNA 水平降低(P<0.05)。 经过TFA 治疗4周后, 与模型组对比, 均明显抑制肝组织中NFκB、TNF-α mRNA 表达, 上调FXR mRNA 的表达(Fig2)。 其中,高剂量组更为明显,说明高剂量组TFA 有较好的抗炎效果。
2.4 TFA 对大鼠肝纤维化模型肝脏相关炎症因子及FXR 蛋白表达的影响 与正常组比较, 模型组NF-κB、TNF-α 蛋白表达升高(P<0.05),FXR 蛋白水平降低(P<0.05)。 经过TFA 治疗4 周后,与模型组对比,均明显抑制肝组织中NF-κB、TNF-α 蛋白表达,上调FXR 蛋白的表达(Fig3)。 其中,高剂量组更为明显, 结果与mRNA 水平一致, 说明TFA有较好的抗炎效果。
2.5 TFA 对大鼠肝纤维化模型肝脏过氧化相关指标的影响 与正常组相比,模型组MDA 升高(P<0.05),GSH、SOD 水平降低(P<0.05)。 经过TFA 治疗4 周后,与模型组对比,明显下调肝组织中MDA 水平,上调GSH、SOD(P<0.05)(Fig4)。 其中,高剂量组更为明显, 说明TFA 有较好的抗过氧化损伤作用。

图2 TFA 对大鼠肝纤维化模型肝脏相关炎症因子及FXR mRNA 表达的影响
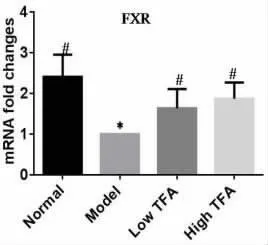
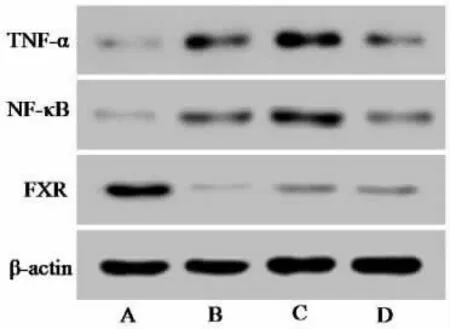
图3 TFA 对大鼠肝纤维化模型肝脏相关炎症因子及FXR 蛋白表达的影响
3 讨论
肝纤维化是以各种因素如乙肝、毒素和药物、寄生虫、酒精、肝淤血、遗传代谢性疾病等导致肝脏慢性炎症,刺激纤维结缔组织异常增生,胶原蛋白、纤连蛋白等细胞外基质(ECM)的增生与降解失衡,最终过度沉积在肝脏组织,是多种慢性肝脏疾病中晚期共有的病理生理过程[7-9]。 傅缨等的研究显示, 发酵虫草菌粉可通过上调基质金属蛋白酶1(MMP-1)及降低金属蛋白酶组织抑制因子-1(TIMP-1)表达,发挥抗肝纤维化作用[10]。 肝纤维化在早期阶段是可以逆转的, 但若致病因素持续存在, 长时间的肝脏炎症、 肝纤维化可进展为肝硬化,此阶段病变难以逆转,部分可导致肝细胞癌。四氯化碳(CCl4)是一种十分经典的急慢性肝损伤造模毒物,广泛应用于肝脏疾病等基础研究[11]。 本实验结合既往前期的造模经验, 采用CCl4皮下注射方法,8 周后成功构建大鼠肝纤维化模型[12]。 模型大鼠可见肝脏纤维化改变, 肝细胞可见脂肪变性以及坏死,这与人体肝纤维化病理改变类似。 本实验在造模第四周即开始给予TFA 治疗, 与第一天即开始给药治疗相比, 此时间点给药更符合人类患病后治疗过程。
已有众多研究证明, 许多慢性疾病包括肿瘤以及心血管、内分泌、消化系统等疾病均与人体内蓄积过多的氧自由基有一定关系[13-15]。 机体是通过酶和抗氧化物来清除有害自由基的, 比如超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶等。 当机体受到有害物质等攻击时, 大量的氧和自由基的释放,抢夺其他分子包括蛋白质、脂类、糖类等以及脱氧核糖核酸上的电子, 在此过程中将产生更多的自由基,引发链式反应,当机体天然的防御机制不能根除这些自由基时,导致细胞损伤,细胞膜被侵蚀,细胞完整性丧失等。 戴颖等的研究显示熊果酸可通过阻断氧化应激和脂质过氧化过程,增加细胞ECM 的降解,并减少ECM 的沉积等机制,治疗大鼠肝纤维化[16]。
TFA 在清除自由基作用方面已有相关报道,并且在心肌、肝脏、肺等组织器官均可经抗氧化而发挥药理作用[17,18]。 有研究报道TFA 可增加急性心肌梗死模型大鼠心肌细胞钙内流及改善心脏血流动力学, 并且可有效的维护心肌细胞膜的稳定性[19]。 在肺纤维化方面,徐昌君等通过博莱霉素构建肺纤维化小鼠,后给予黄芪多糖、黄芪皂苷以及黄芪黄酮, 发现黄芪黄酮改善肺纤维化效果最为理想,并发现TFA 可通过抑制TGF-β 和TNF-α 表达而抑制肺纤维化的进程[20]。 麦静愔等发现TFA 可下调大鼠脂肪酸转位酶和环氧化酶-2 的表达,对肝组织的胶原增生有明显的抑制作用而改善肝纤维化进程[21]。 本实验利用CCl4构建肝纤维化模型后给予不同剂量的TFA, 亦发现可以改善肝纤维化大鼠肝功能,下调TNF-α 等炎性蛋白指标,并且高剂量组TFA 更为明显。 进一步检测SOD、MDA等指标发现,TFA 亦可明显改善肝脏过氧化损伤。
法尼酯衍生物X 受体( FXR)是一种胆汁酸受体,属于核受体超家族,在消化、泌尿等系统的组织器官均高表达。 在消化系统中广泛参与胆汁酸、胆固醇代谢以及糖代谢[22,23]。 当配体与FXR 结合后,FXR 的空间结构发生改变并被活化, 活化的FXR与视黄醇类X 受体α (retinoid X receptor α,RX Rα)形成异二聚体,调节靶基因的转录。 近来研究更发现FXR 具有显著的抗肿瘤功能, 调控细胞增殖和凋亡等过程[24,25]。陈科全发现FXR 激动剂GW 4064 能导致HSC-T6 细胞株TIMP-1 及TIMP-2表达减少,减弱对MMP 的降解,最终增强MMP 降解ECM 的能力,从而缓解肝纤维化[26]。 激动FXR能抑制细胞凋亡,并阻止肝纤维化进程[27],本实验中亦发现TFA 能上调肝脏FXR 的表达,这可能解释了TFA 改善肝纤维化的作用机制。 综上所述,TFA 能改善肝纤维化的进程, 其机制可能与改善过氧化损伤、上调FXR 的表达有关,具有很好的开发和应用前途。

图4 TFA 对大鼠肝纤维化模型肝脏过氧化相关指标的影响


