姜黄素对脓毒症急性肺损伤大鼠的保护作用
段金旗 林 艳
(张家口学院医学院,张家口 075000)
目前,脓毒症发病率、病死率居高不下,临床救治十分困难,是当今重症医学所面临的难题[1]。姜黄素具有抗肿瘤、清除自由基、抗氧化、抗炎等药理作用,在多种疾病的治疗方面有广阔的应用前景[2]。许多文献报道姜黄素对脓毒症引起的器官损伤有保护作用,但对于脓毒症引发的急性肺损伤(acute lung injury,ALI)疗效,目前研究甚少[3]。本研究采用盲肠结扎穿刺(CLP)建立脓毒症ALI大鼠模型,观察大鼠肺组织病理变化,进一步研究姜黄素对脓毒症ALI中炎症因子的表达及相关作用机制。
1 材料与方法
1.1材料 TNF-α、IL-6 ELISA 试剂盒(武汉博士德公司);HMGB1抗体(Santa Cruze公司);RNA 提取试剂(美国 Gibco公司);SYBR Green PCR 试剂盒(TaKaRa 公司);HMGB1引物合成(中国北京鼎国生物技术公司);BCA 蛋白浓度测定试剂盒(碧云天生物工程有限公司);姜黄素和二甲基亚砜(DMSO)(美国 Sigma公司);Real-time PCR检测仪ABI7900(美国 Applied Biosystems公司)。
1.2方法
1.2.1动物分组与给药 清洁级,雄性,6~8周龄SD 大鼠,体质量180~200 g,购自湖南斯莱克景达实验动物有限公司,合格证号:SCXK(湘) 2015-0013,术前适应性喂养1周。 大鼠随机分为 3 组(每组10 只):对照组、模型组及治疗组。对照组大鼠在麻醉开腹后立即关闭腹腔,术后不给药。而模型组和治疗组均依照文献[4]采用CLP法建立脓毒症ALI模型。治疗组术后 2 h 经腹腔注射200 mg/kg的姜黄素(0.1% DMSO溶解),模型组术后 2 h 经腹腔注射0.1 % DMSO (1 ml/kg)。
1.2.2标本处理 建模后,将大鼠麻醉腹主动脉采血4 ml ,分离血清,-80℃保存;对肺组织进行灌洗,收集灌洗液,-20℃保存;手术切取右肺叶于液氮中保存。
1.2.3检测指标
1.2.3.1观察大鼠生存率 以各组大鼠造模时间为起始点,观察大鼠存活情况,以天为时间节点,共观察7 d。
1.2.3.2HE染色观察肺组织病理变化 将切除的右肺上叶组织固定于4%多聚甲醛中24 h,乙醇逐级脱水,石蜡包埋,连续切片,制备5 μm石蜡切片。脱蜡后,HE染色,于光学显微镜200倍视野下观察组织病理学变化,并采集图像。
1.2.3.3电镜观察肺组织超微结构变化 取右肺上叶组织,2.5%戊二醛预固定后,梯度乙醇脱水,无水丙酮/包埋剂渗透,包埋、超薄切片,采用电子透射电镜观察并对比各组血管内皮细胞、肺泡上皮细胞等超微结构变化。
1.2.3.4ELISA法检测血清和BALF中TNF-α、IL-6含量 大鼠腹腔麻醉后,腹主动脉取血,分离血清,备用。并取左肺用预冷的生理盐水进行支气管肺泡灌洗,共3次,收集BALF,于4℃离心收集上清液。测定BALF及血清中TNF-α、IL-6水平。具体方法严格按照试剂盒说明书进行。
1.2.3.5qRT-PCR法检测肺组织HMGB1 mRNA表达 取肺脏组织,TRIzol法提取总RNA,按反转录试剂盒说明书逆转录合成cDNA,HMGB1、GAPDH引物序列由北京鼎国生物技术公司合成,再以反转录出来的cDNA为模板配成20 μl反应体系,在Real-time PCR仪上设定扩增参数,检测样品中HMGB1和GAPDH内参基因Ct值,重复3次,表达量用2-ΔΔCt法计算。
1.2.3.6Western blot检测肺组织HMGB1蛋白表达 在液氮中将肺组织充分研磨,采用蛋白裂解液(RIPA)裂解,均浆后使用BCA试剂盒测定蛋白浓度。配平各组蛋白浓度后,加热变性,进行电泳分离、转膜、脱脂牛奶封闭30 min,加入HMGB1抗体4℃过夜,加二抗室温孵育2 h,ECL显影。以HMGB1与β-actin的灰度值比值作为HMGB1蛋白表达量。

2 结果
2.1大鼠生存率 如图1所示,治疗组7 d生存率高于模型组(P<0.05)。
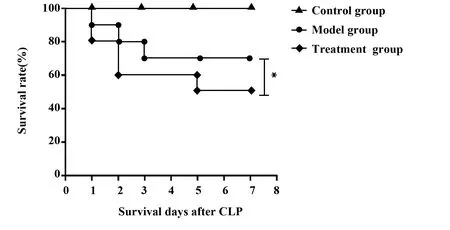
图1 各组大鼠存活率比较Fig.1 Survival rate comparison of each group of ratsNote:*.P<0.05.
2.2HE染色观察大鼠肺组织病理变化 对照组未见病理改变;模型组水肿明显,肺泡及间质出现炎症、出血,肺损伤逐渐加重,48 h后损伤到达高峰;治疗组24 h后损伤到达高峰,48 h时肺损伤程度明显减轻,见图2。
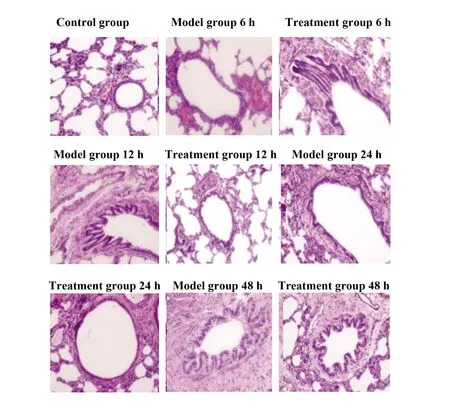
图2 各组肺组织病理变化(×200)Fig.2 Pathological changes of lung tissue in each group(×200)
2.3电镜观察各组大鼠肺组织超微结构变化 对照组肺泡毛细血管膜及肺泡上皮形态、数量基本正常,细胞连接紧密;模型组在6、12 h时肺泡上皮细胞数量下降,细胞器减少,连接显疏松,在24、48 h时肺泡毛细血管内皮脱落,胞浆出现浑浊,细胞连接疏松;治疗组在各时间点受损程度均较模型组轻,见图3。
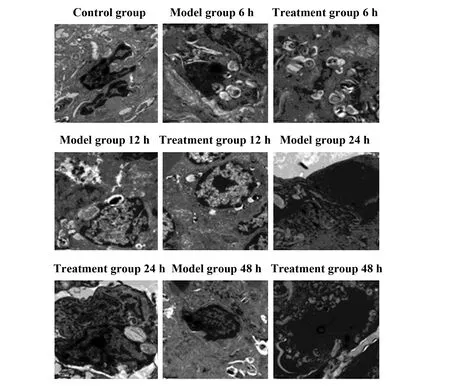
图3 各组肺组织超微结构变化Fig.3 Ultra-structural changes of lung tissue in each groupNote:Length of scale=1 μm.
2.4qRT-PCR检测各组大鼠肺组织HMGB1 mRNA表达 对照组大鼠各时间点肺组织HMGB1 mRNA表达明显低于模型组或治疗组(P<0.05);与模型组相比,治疗组在12、24、48 h时HMGB1 mRNA表达明显下降(P<0.05),见图4。
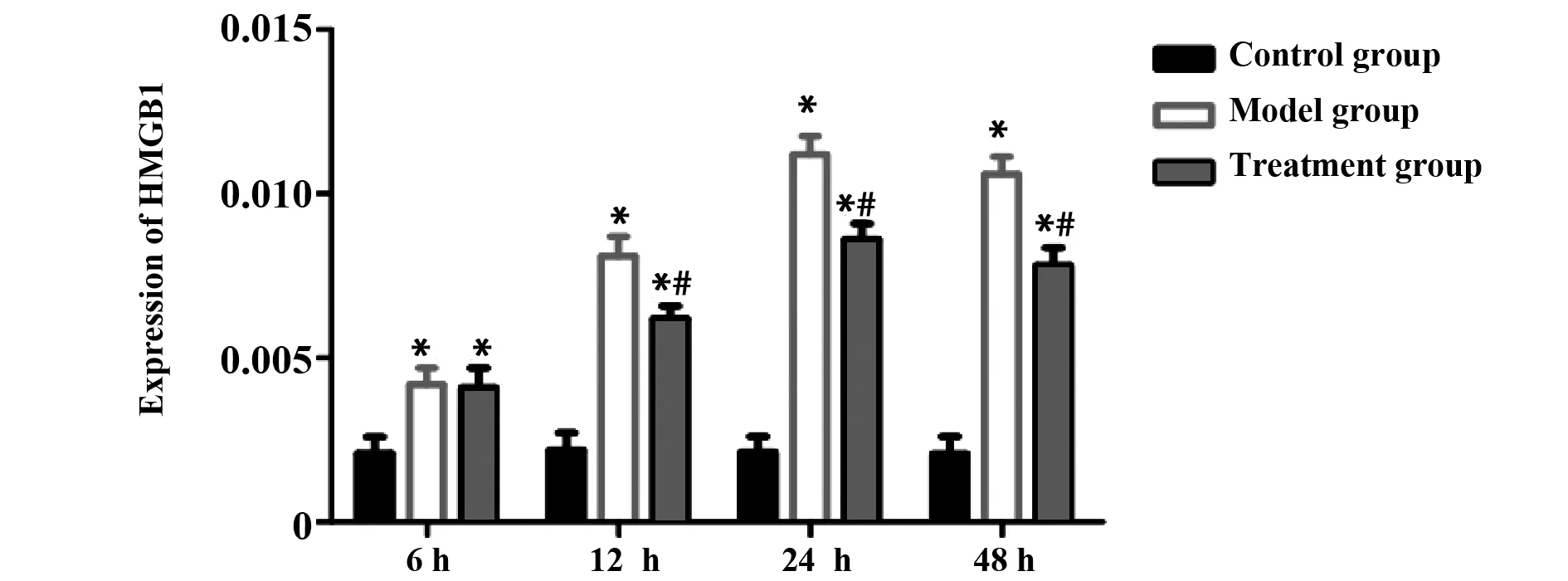
图4 不同时间各组大鼠肺组织HMGB1 mRNA表达Fig.4 Expression of HMGB1 mRNA in lung tissue of rats at different timeNote:Compared with control group,*.P<0.05;compared with model group,#.P<0.05.
2.5Western blot检测各组大鼠肺组织HMGB1蛋白表达 对照组大鼠各时间点肺组织HMGB1 蛋白表达差异无统计学意义,且低于模型组或治疗组;与模型组相比,治疗组各时间点HMGB1蛋白表达明显下降(P<0.05),见图5。

图5 大鼠肺组织HMGB1蛋白表达Fig.5 Expression of HMGB1 in rat lung tissueNote:1.Control group;2.Model group 6 h;3.Model group 12 h;4.Model group 24 h;5.Model group 48 h;6.Treatment group 6 h;7.Treatment group 12 h;8.Treatment group 24 h;9.Treatment group 48 h.
2.6ELISA法检测大鼠血清及BALF中TNF-α和IL-6含量变化 大鼠血清及BALF中TNF-α和IL-6含量变化情况相似。在不同时间点,对照组TNF-α和IL-6含量变化差异无统计学意义(P>0.05),但明显低于模型组或治疗组;与模型组相比,治疗组大鼠在24、48 h时血清和BALF中TNF-α和IL-6含量明显下降(P<0.05),见图6。
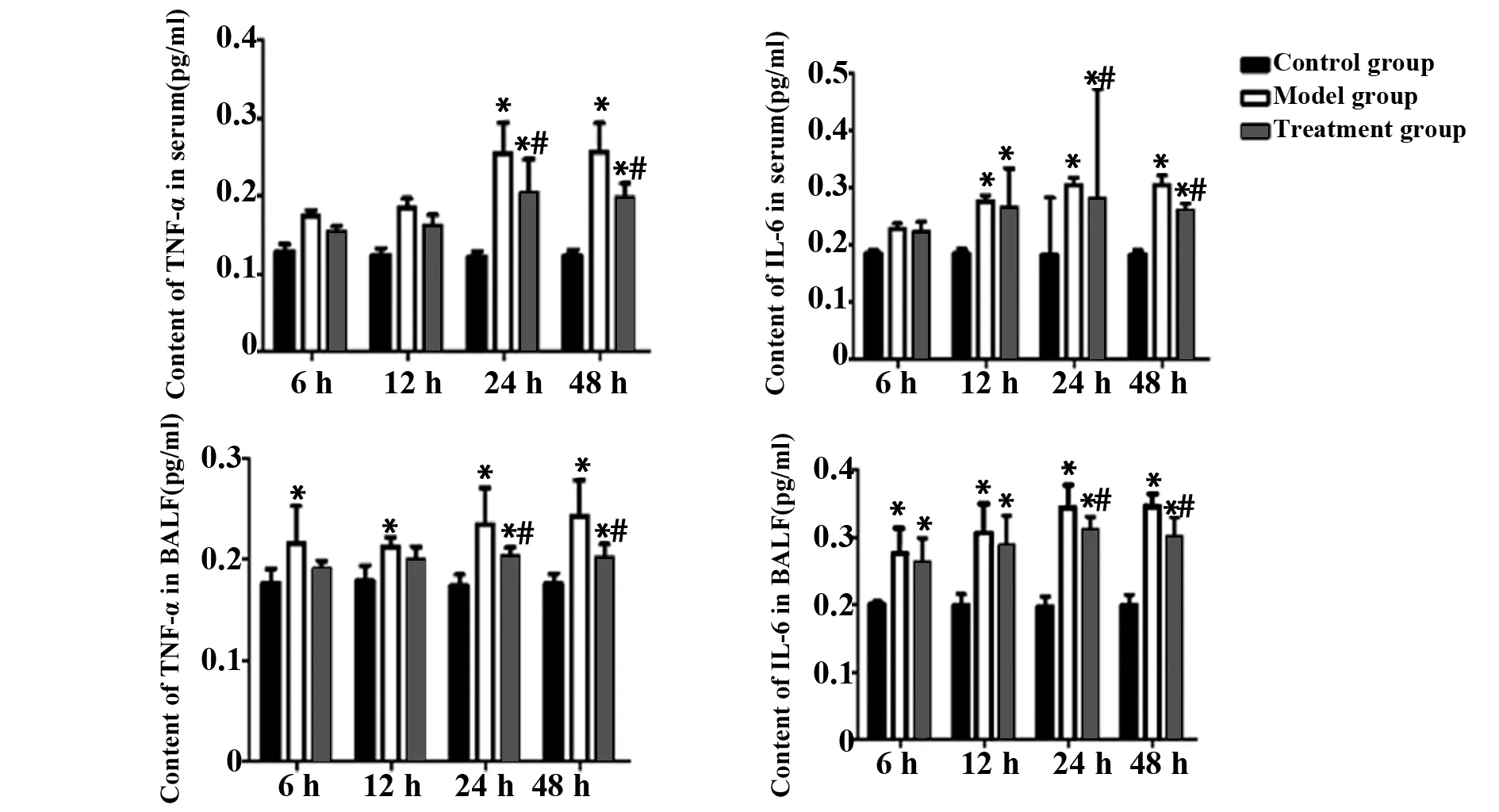
图6 大鼠血清及BALF中TNF-α、IL-6含量变化Fig.6 Changes of TNF-α and IL-6 in serum and BALF of ratsNote:Compared with control group,*.P<0.05;compared with model group,#.P<0.05.
3 讨论
脓毒症最新定义为宿主对感染引起失控反应导致危及生命的器官功能障碍综合征,具有30%~70%的病死率,是重症患者死亡的重要原因之一[5-7]。姜黄素是姜科植物根茎中提取的天然黄色多酚类化合物,其结构为双阿魏酰甲烷,因其提取工艺简单、安全、廉价,且具有抗肿瘤、抗淀粉样蛋白、抗菌、抗氧化、抗炎等作用,而逐渐成为医学界的一个研究热点[8]。文献报道,姜黄素对细菌或注入内毒素引发的脓毒症动物模型组织器官具有保护作用[9]。脓毒症是引发ALI最重要的危险因素之一,目前还缺乏有效治疗手段,而有关姜黄素对脓毒症ALI方面的报道更少。CLP法建立脓毒症ALI模型是目前公认与临床相关性较高的建模方法,本研究采用此模型探索姜黄素对脓毒症ALI中炎症因子的调节作用机制。
大鼠生存率结果显示,治疗组7 d生存率高于模型组,说明姜黄素能改善大鼠7 d生存率。生存率研究还发现,模型组在48 h时死亡率为40%明显高于治疗组,这提示及早干预治疗脓毒症性ALI对提高生存率有重要作用;HE染色结果显示,对照组未见病理改变,模型组水肿明显,肺损伤随时间延长逐渐加重,而治疗组各时间点损伤程度较模型组减轻,说明姜黄素能减轻肺损伤炎症程度,这一结论在电镜观察结果中也得到证实。
TNF-α主要由激活的淋巴细胞、单核/巨噬细胞等分泌,它能直接介导肿瘤细胞的凋亡和坏死,促进微血栓形成,诱导其他细胞因子如IL-1、IL-6等的产生[10]。IL-6 是一种多功能的细胞因子,能刺激造血干细胞的生长和增加急性相蛋白的合成,还能激活 T、B 淋巴细胞的免疫反应而调节机体免疫[11]。还有许多文献报道,IL-6具有抑制炎症反应的作用,是 TNF-α和 IL-1β的反调控/抗炎因子[12]。ELISA检测结果显示,在不同时间点,对照组中TNF-α、IL-6含量变化无统计学意义(P>0.05),而与模型组相比,治疗组在24、48 h时大鼠血清和BALF中TNF-α、IL-6含量明显下降(P<0.05),说明经姜黄素治疗后能降低肺组织炎症浸润程度,血清和BALF中TNF-α、IL-6水平较模型组降低,有利于防止过度炎症造成的肺损伤,提示姜黄素对脓毒症ALI大鼠具有保护作用。
HMGB1是一种非组蛋白染色质结合蛋白,参与DNA的转录、复制、修复以及炎症反应等[13]。以往研究证实HMGB1 能直接导致ALI,表现为炎症细胞因子释放增加、损伤肺实质细胞、肺泡充血和肺出血等[14]。TLR4能特异性地识别病原相关分子模式,激活核转录因子NF-κB,介导炎症因子TNF-α、IL-1β和IL6等表达,引起相应炎症介质合成和释放[15]。近年来大量研究结果还证实,HMGB1是TLR4的重要的内源性配体,如果抑制TLR4的功能,不仅有利于脓毒症ALI抗炎作用,还能发挥抗脓毒症作用,提示TLR4参与了脓毒症ALI发病过程,干预TLR4可能会成为治疗脓毒症的新途径[16]。研究中qRT-PCR和Western blot检测结果显示,与对照组相比,模型组在各时间点HMGB1 mRNA和蛋白表达明显上升,经姜黄素治疗后HMGB1 mRNA和蛋白表达下降,说明HMGB1可能在不同水平参与脓毒症ALI的发展,而姜黄素能够抑制HMGB1的表达,可能下调TLR4进而降低肺部TNF-α、IL-6表达。
综上所述,姜黄素可以在脓毒症ALI大鼠中发挥治疗作用,但实验仍存在几个问题:首先,脓毒症ALI大鼠模型不能完全反映人类脓毒症ALI发病;其次,本研究评估了姜黄素对模型组大鼠存活率的短期影响,而不是长期效果。因此还需要进一步长期研究姜黄素对脓毒症ALI的保护作用。

