千里香中黄酮类成分的分离鉴定及抗氧化活性研究
向方桃,陈封政,陈建明,田 冲,杨孝蓉,李书华*
1乐山师范学院附属医院;2乐山师范学院 乐山特色农产品药用成分研发工程中心,乐山 614000;3固态发酵资源利用四川省重点实验室,宜宾 644000;4成都格纯生物医药有限公司,成都 610000
千里香(Murrayapanaculata(L.) Jack)为芸香科九里香属植物,主要分布于我国南方等地。九里香属在我国有6种及2个变种[1],1978年植物分类学家黄成就将M.panaculata(L.) Jack的中文名称由九里香更名为千里香[2]。2015版《中国药典》收载的九里香为千里香(M.panaculata(L.) Jack)和九里香(M.exoticaL.)的干燥叶和带叶嫩枝,其主要功能为行气止痛,活血化瘀[3]。药典里对九里香仅有性状鉴别、显微鉴别以及水分和总灰分检查,缺少成分鉴别和有效成分的含量测定。国内外对九里香的研究报道较多,但仔细分析发现这些文献研究的品种多为九里香(M.exoticaL.),主要侧重于九里香的提取物的生理活性研究:抑菌、抗炎、杀虫、抗生育、消炎、镇痛等药理作用[4-6]以及成分分析、分离与鉴定[7,8]。目前国内外对千里香的研究主要集中挥发性成分分布[9],精油的抑菌活性及成分分析[10],氯仿萃取物提取物对家蝇成虫、萝卜蚜、椰心菜甲和斜纹夜蛾有杀灭作用和对香蕉、芒果的炭疽病的抑制作用[11],醇提取物对稻瘟病病原菌的抑制作用[12]以及千里香的多甲氧基基黄酮成分分离与鉴定[13,14]等方面。
国内外对黄酮的抗氧化活性研究较多,黄酮抗氧化活性的机理是其酚羟基可能被氧化成羰基等因素,多甲氧基基黄酮由于酚羟基较少,其抗氧化活性比对应的黄酮弱[15]。
为了进一步阐明千里香的活性成分,我们对千里香枝叶的化学成分进行了分离鉴定,并对所得到的单体化合物进行了抗氧化活性研究。
1 材料与方法
1.1 材料与仪器
旋转蒸发仪YRE-501(巩义市予华仪器有限责任公司),电子天平FA1004(鹤壁市力科电子有限公司),7200型可见分光光度计(尤尼柯仪器有限公司),制备液相色谱SACID100 mm(成都格莱精密仪器有限公司);Varian INOVA 400核磁共振谱仪。
薄层色谱硅胶GF254和柱色谱硅胶(300~400目,青岛海洋化工有限公司产品);维生素C(上海阿拉丁生化科技股份有限公司);DPPH(1,1-二苯基-2-三硝基苯肼)(百灵威科技有限公司)。
千里香,2018年7月购自安国冷背药材有限公司,经乐山师范学院成英副教授鉴定为芸香科九里香属植物千里香(M.panaculata(L.) Jack)的干燥叶及嫩枝,标本保存于乐山师范学院乐山特色农产品药用成分研发工程中心(20180701)。
1.2 方法
1.2.1 提取与分离
称取10 kg千里香干燥叶及嫩枝,粉碎,平均分装于2个50 L的塑料桶中,分别向每个桶中加入25 L乙酸乙酯,室温浸泡5天后过滤,得到第一次浸提液。然后再次分别向每个桶中加入20 L乙酸乙酯,室温浸泡5天,过滤,得到第二次浸提液。合并两次浸提液,在50 ℃条件下减压浓缩,得到流浸膏408 g。将流浸膏用乙酸乙酯溶解,上清液滴加于300 g 300~400目硅胶上,水浴挥干溶剂,得到吸附了样品的硅胶。将2 500 g 300~400目硅胶湿法装入玻璃层析柱中,然后将吸附了样品的硅胶置于柱上端,以不同比例的石油醚:丙酮混合液(8∶1→1∶1)为洗脱液,得到6个部分。将每个部分通过制备液相分离,结合多次硅胶柱层析分离和重结晶纯化,得到6个化合物:1(50 mg)、2(15 2mg)、3(95 mg)、4(30 mg)、5(110 mg)和6(36 mg)。
1.2.2 化合物抗氧化活性的测定
根据Hu等[15]的研究方法,以维生素C为阳性对照,采用DPPH自由基清除率检测法,研究化合物的抗氧化活性。
抗氧化反应体系:用移液器分别准确取100 μL不同浓度的化合物或Vc溶液,3.90 mL 75 μmol/L的DPPH溶液,摇匀后放置于暗处30 min后,在517 nm波长处测定吸光度A0,同时测定100 μL化合物溶液+3.90 mL甲醇的吸光度A1以及3.90 mL 75 μmol/L的DPPH溶液+100 μL甲醇的吸光度A2。所有样品均做三个重复,取平均值。按照下面公式计算化合物对DPPH自由基的清除率。
DPPH自由基的清除率=[1-(A0-A1)/A2]×100%
式中:A0=100 μL化合物溶液+3.90 mL DPPH溶液;A1=100 μL化合物溶液+3.90 mL甲醇的吸光度;A2=3.90 mL DPPH溶液+100 μL甲醇的吸光度。
2 实验结果
2.1 结构鉴定
化合物1淡黄色粉末;10%硫酸-乙醇喷雾加热后显黄色。1H NMR(400 MHz,CDCl3)δ:7.56(1H,d,J= 8.0 Hz,H-6′),7.39(1H,s,H-2′),6.96(1H,d,J= 8 Hz,H-5′),6.59(1H,s,H-3),6.41(1H,s,H-6),3.98(3H,s,4′-OCH3),3.95(6H,s,3′-OCH3,8-OCH3),3.93(6H,s,5-OCH3,7-OCH3)。13C NMR(100 MHz,CDCl3)δ:178.2(C-4),160.8(C-2),156.6(C-7),156.3(C-9),151.9(C-5),151.8(C-4′),149.2(C-3′),130.5(C-8),123.9(C-1′),119.7(C-6′),112.2(C-5′),108.7(C-10),108.5(C-2′),106.9(C-3),92.4(C-6),61.5(8-OCH3),56.4(5-OCH3),56.3(7-OCH3),56.1(3′-OCH3),56.0(4′-OCH3)。上述核磁数据与文献[16]报道的5,7,8,3′,4′-五甲氧基黄酮基本一致。
化合物2淡黄色粉末;10%硫酸-乙醇喷雾加热后显黄色。1H NMR(400 MHz,CDCl3)δ:7.17(2H,s,H-2′,6′),6.64(1H,s,H-3),6.44(1H,s,H-6),4.01(3H,s,4′-OCH3),3.99(3H,s,8-OCH3),3.95(9H,s,3′-OCH3,5′-OCH3,5-OCH3),3.92(3H,s,7-OCH3)。13C NMR(100 MHz,CDCl3)δ:177.9(C-4),160.3(C-2),156.7(C-7),156.4(C-9),153.5(C-3′),153.5(C-5′),151.9(C-5),140.8(C-4′),130.6(C-8),126.7(C-1′),108.8(C-10),107.9(C-3),103.2(C-2′),103.2(C-6′),92.5(C-6),61.4(8-OCH3),61.0(4′-OCH3),56.6(5-OCH3),56.3(7-OCH3),56.2(3′-OCH3),56.2(5′-OCH3)。上述核磁数据与文献[17]报道的5,7,8,3′,4′,5′-六甲氧基黄酮基本一致。
化合物3淡黄色粉末;10%硫酸-乙醇喷雾加热后显黄色。1H NMR(400 MHz,CDCl3)δ:7.08(2H,s,H-2′,6′),6.64(1H,s,H-3),6.58(1H,s,H-8),6.44(1H,s,H-6),3.97(3H,s,5-OCH3),3.95(6H,s,3′-OCH3,5′-OCH3),3.94(3H,s,7-OCH3),3.92(3H,s,4′-OCH3)。13C NMR(100 MHz,CDCl3)δ:177.6(C-4),164.1(C-7),160.9(C-5),160.5(C-2),159.9(C-9),153.5(C-3′),153.5(C-5′),140.8(C-4′),126.8(C-1′),109.2(C-10),108.9(C-3),103.4(C-2′),103.4(C-6′),96.2(C-6),92.9(C-8),61.1(4′-OCH3),56.5(5-OCH3),56.4(3′-OCH3),56.4(5′-OCH3),55.8(7-OCH3)。上述核磁数据与文献[7]报道的5,7,3′,4′,5′-五甲氧基黄酮基本一致。
化合物4淡黄色粉末;10%硫酸-乙醇喷雾加热后显黄色。1H NMR(400 MHz,CDCl3)δ:7.08(2H,s,H-2′,6′),6.81(1H,s,H-8),6.70(1H,s,H-3),4.00(3H,s,5-OCH3),3.99(3H,s,7-OCH3),3.94(6H,s,3′-OCH3,5′-OCH3),3.92(6H,s,4′-OCH3,6-OCH3)。13C NMR(100 MHz,CDCl3)δ:177.6(C-4),161.4(C-2),158.0(C-7),154.6(C-9),153.6(C-3′),153.6(C-5′),152.5(C-5),141.0(C-4′),140.5(C-6),126.7(C-1′),112.7(C-10),107.9(C-3),103.5(C-2′),103.5(C-6′),96.3(C-8),62.2(5-OCH3),61.6(6-OCH3),61.1(4′-OCH3),56.4(3′-OCH3),56.4(5′-OCH3),56.4(7-OCH3)。上述核磁数据与文献[18]报道的5,7,3′,4′,5′-六甲氧基黄酮基本一致。
化合物5淡黄色粉末;10%硫酸-乙醇喷雾加热后显黄色。1H NMR(400 MHz,CDCl3)δ:7.54(1H,d,J= 8 Hz,H-6′),7.35(1H,s,H-2′),6.99(1H,d,J= 8 Hz,H-5′),6.70(1H,s,H-8),6.57(1H,s,H-3),3.99(6H,s,3′-OCH3,4′-OCH3),3.98(3H,s,7-OCH3),3.92(3H,s,6-OCH3)。13C NMR(100 MHz,CDCl3)δ:182.7(C-4),164.3(C-2),158.9(C-7),153.3(C-9),152.9(C-4′),152.4(C-5),149.4(C-3′),132.7(C-6),123.6(C-1′),120.2(C-6′),111.2(C-5′),108.8(C-2′),106.0(C-10),104.2(C-3),90.7(C-8),60.9(4′-OCH3),56.4(6-OCH3),56.1(3′-OCH3),56.1(7-OCH3)。上述核磁数据与文献[7]报道的5-羟基-6,7,3′,4′-四甲氧基黄酮基本一致。
化合物6淡黄色粉末;10%硫酸-乙醇喷雾加热后显黄色。1H NMR(400 MHz,CDCl3)δ:7.61(1H,d,J= 8 Hz,H-6′),7.44(1H,s,H-2′),7.01(1H,d,J= 8 Hz,H-5′),6.74(1H,s,H-3),4.13(3H,s,7-OCH3),3.99(9H,s,3′-OCH3,4′-OCH3,8-OCH3),3.96(3H,s,6-OCH3)。13C NMR(100 MHz,CDCl3)δ:183.1(C-4),164.4(C-2),153.2(C-4′),152.6(C-7),149.9(C-9),149.9(C-3′),145.9(C-5),136.7(C-6),132.9(C-8),123.5(C-6′),120.3(C-1′),111.3(C-5′),108.8(C-2′),106.8(C-10),103.7(C-3),62.1(6-OCH3),61.8(7-OCH3),61.2(6-OCH3),56.2(3′-OCH3),56.0(4′-OCH3)。上述核磁数据与文献[7]报道的化合物5-羟基-6,7,8,3′,4′-五甲氧基黄酮基本一致。
2.2 化合物抗氧化活性的测定结果与分析
对从千里香中分得的6个化合物及千里香的乙酸乙酯提取物进行了抗氧化试验,结果显示千里香的乙酸乙酯提取物浓度为250 μg/mL时对DPPH自由基的清除率为15.26%,维生素C浓度为40 μM时对DPPH自由基的清除率为48.06%,6个化合物表现出不同程度的抗氧化作用(各化合物对DPPH自由基的清除率见图1),化合物1~4的抗氧化作用很弱,化合物5和6的有一定的抗氧化作用,但明显弱于维生素C。通过结构分析,化合物5和化合物6均含有5位酚羟基,5位羟基与4位的羰基协同作用,形成一个六元环系来稳定和清除自由基[25],故表现出一定的抗氧化活性;而化合物1~4则不含有酚羟基,缺少这种体系,故其抗氧化能力很弱。化合物1和3的抗氧化活性几乎没有差别,化合物2和4的抗氧化活性也很一致,但化合物2和4的抗氧化能力略强于化合物1和3。从上述结果可以看出,结构类似的多甲氧基黄酮在均无酚羟基存在的情况下,含甲氧基多的化合物抗氧化活性略强于含甲氧基少的化合物。
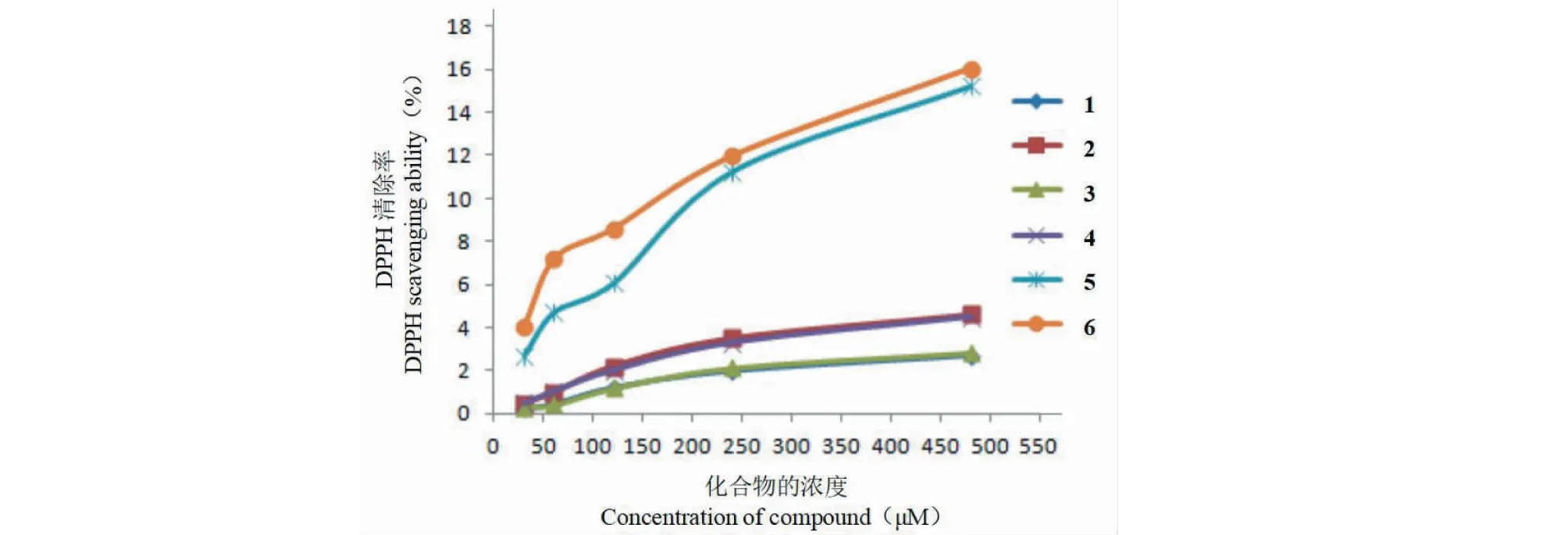
图1 化合物对DPPH的清除曲线Fig.1 DPPH free radical scavenging abilities of compounds
3 结论
本文对千里香的乙酸乙酯提取物进行了分离纯化,得到了6个多甲氧基黄酮,其中化合物1是首次从九里香属植物里分离得到,也是首次从千里香植物里分离得到,丰富了千里香化合物的结构类型。化合物2和5填补了chembook资源平台对照品的空白。对分离得到的6个多甲氧基黄酮进行了清除DPPH自由基试验,结果显示6个化合物均具有一定的抗氧化活性,其中含有5位酚羟基的多甲氧基黄酮的抗氧化活性明显强于不含酚羟基的多甲氧基黄酮,对于结构类似均无酚羟基的多甲氧基黄酮,则含甲氧基多的化合物抗氧化活性略强于含甲氧基少的化合物。
通过本文的研究结合文献[13,14],可以看出千里香(M.panaculata(L.) Jack)一般不含有香豆素类化合物,而九里香(M.exoticaL.)[19,20]则富含香豆素类化合物,这从植物化学分类学上佐证了千里香和九里香的区别,以此推测《中国药典》将千里香和九里香不加区别使用值得商榷。
致谢:感谢成都格纯生物医药有限公司在分离工作中提供的部分设备和帮助。

